Содержание статьи
Введение
Остеоартрит (ОА) является одним из самых распространенных заболеваний костно-мышечной системы и поражает около 11–13% населения [1, 2]. Согласно данным, полученным в ходе Глобального исследования бремени болезней, травм и факторов риска (Global Burden of Disease Study), инициированного Всемирным банком и поддержанного Всемирной организацией здравоохранения, в 2017 г. повсеместно было зарегистрировано 303,1 млн случаев ОА тазобедренных и коленных суставов, а стандартизированные по возрасту показатели распространенности болезни увеличились с 1990 по 2017 г. на 9,3% [3]. В большинстве эпидемиологических исследований указывается на то, что ОА значительно чаще наблюдается у женщин, и в первую очередь среди наиболее возрастных групп [4–5]. Соц иально-экономическое значение ОА заключается в развитии стойкой утраты трудоспособности в молодом возрасте, а также способности к самообслуживанию и в снижении качества жизни людей старшего поколения. Результаты метаанализов исследований свидетельствуют о повышении риска смерти как от общих причин, так и от сердечно-сосудистых событий в когорте пациентов с ОА по сравнению с общей популяцией [6]. Вместе с тем стали возрастать затраты на лечение ОА, что прежде всего обусловлено необходимостью проведения эндопротезирования крупных суставов.
На протяжении последних двух десятилетий широко обсуждается вопрос о клинической гетерогенности ОА. Разделен
‘e8е его на отдельные субтипы/фенотипы важно для определения специфических факторов риска, имеющих приоритетное значение для развития и прогрессирования болезни, особенностей течения и исходов, а также подбора персонифицированного лечения, включая немедикаментозные воздействия и лекарственную терапию. Наиболее распространенными фенотипическими вариантами являются метаболический, возрастной, эстроген-зависимый, посттравматический, болевой, кристаллический, генетически детерминированный и некоторые другие. Выделение характерных черт указанных фенотипов находит свое отражение в исходах заболевания. Наличие совокупности факторов риска обусловливает более яркую клиническую картину и способствует развитию фун eaциональных ограничений и структурных изменений в околосуставных мягких тканях, хряще и субхондральной кости. При этом следует отметить, что в настоящее время должен превалировать мультимодальный подход, основанный на использовании комбинированной терапии с учетом домини f0ующего фенотипа ОА, наличия коморбидности и уже назначенной лекарственной терапии [7].
При этом лекарственная терапия ОА ограничена применением обезболивающих препаратов, включая НПВП, и симптом-модифицирующих препаратов замедленного действия (Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA). Все они включены в отечественные клинические рекомендации, утвержденные Министерством здравохранения РФ (2021) [8], и Европейские рекомендации ESCEO (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 2019) [9]. К этим препаратам относятся кристаллический глюкозамина сульфат, хондроитина сульфат, диацереин, неомыляемые соединения авокадо и сои, гиалуроновая кислота. Известно, что все они обладают целым рядом биологических эффектов, заключающихся в противовоспалительном и хондропротективном действии, что реализуется в замедлении прогрессирования ОА. Особым преимуществом препаратов из группы SYSADOA следует считать их относительную б езопасность, что в условиях коморбидности, обусловленной развитием хронической неинфекционной патологии у людей старшего возраста, позволяет избежать нежелательных лекарственных реакций [10].
Более 25 лет в качестве SYSADOA для лечения ОА используются инъекционные формы, содержащие сульфатированные глюкозаминогликаны, аналогичные матриксу гиалинового хряща, — хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, низкомолекулярные полипептиды и микроэлементы. Эффективность этой группы была показана в нескольких клинических исследованиях [11–13].
Одним из таких препаратов является АМБЕНЕ® БИО. Это современный инъекционный хондропротектор российского производства, который содержит комплекс полипептидов, имеющих молекулярную массу 300–600 Да (цитомедины), мукополисахариды (хондроитина сульфат), аминокислоты, ионы натрия, калия, магния, железа, меди, цинка и производится по современной технологии биоэкстракции с использованием нано- и ультрафильтрации [14].
В ФГБНУ НИИР им. В.А. Насоновой было проведено пострегистрационное многоцентровое неинтервенционное клиническое исследование «Колибри».
Цель исследования: оценка эффективности и безопасности терапии лекарственным препаратом АМБЕНЕ® БИО (производитель — ООО «ПРОМОМЕД РУС») у пациентов с ОА крупных и мелких суставов различной локализации при применении двумя курсами в течение 48 нед. с перерывом в 24 нед.
Материал и методы
В исследование было включено 118 пациентов с установленным на первичном амбулаторном приеме диагнозом «остеоартрит крупных (гонартроз) или мелких суставов» (табл. 1).
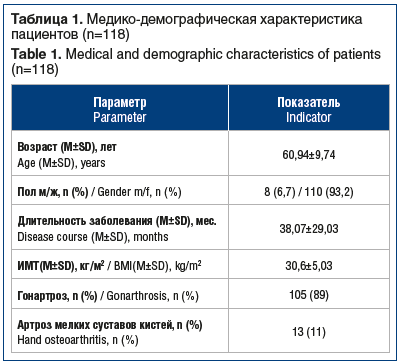
Длительность участия пациентов в исследовании составила 330±14 дней. Критериями включения в наблюдательную программу служили:
подписанное информированное согласие на участие в исследовании и адекватное сотрудничество в ходе его проведения;
возраст 18 лет и старше;
ОА коленных, тазобедренных или мелких суставов кистей I–III рентгенологической стадии по Kellgren — Lawrence;
боль при движении ≥40 мм по 100-мм визуальной аналоговой шкале (ВАШ);
прием стабильной дозы НПВП в течение не менее 4 нед. до начала исследования;
желание и способность пациента принять участие в исследовании и выполнять предписания врача, направленные на достижение результата терапии и соблюдение требований исследования.
В исследование не включались пациенты с выраженными структурными изменениями в суставах, с осложненным течением какого-либо хронического заболевания, с хондрокальцинозом, патологией гемостаза, анемией, тромбоцитопенией и лейкопенией.
Пациенты получали АМБЕНЕ® БИО по 1 мл 1 р/сут в течение 20 дней согласно инструкции по медицинскому применению лекарственного препарата. Допускалось внутрисуставное введение препарата при гонартрозе по 1–2 мл в целевой сустав с интервалом 3–4 дня курсом 5–6 инъекций. Терапия проводилась двумя курсами, повторный курс осуществлялся через 6 мес. (рис. 1).
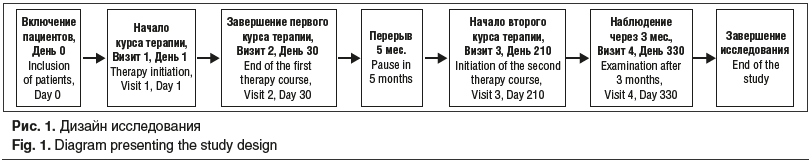
Первичным критерием анализа эффективности (первичной конечной точкой) служила степень контроля над болью при движении, оцениваемая испытуемыми по ВАШ через 30±7 дней от начала лечения (через 10 дней после завершения первого курса), по сравнению с исходным значением.
В качестве вторичных критериев анализа эффективности (вторичных конечных точек) были выбраны следующие параметры:
динамика индекса WOMAC для крупных суставов и баллов по шкале AUSCAN для мелких суставов через 30±7 (визит 2), 210±7 (визит 3) и 330±14 (визит 4)
дней от начала лечения по сравнению с исходными значениями по шкалам;
динамика боли в покое (по ВАШ) через 30±7, 210±7 и 330±14 дней от начала лечения по сравнению с исходными значениями;
динамика боли при движении (по ВАШ) через 210±7 и 330±14 дней от начала лечения по сравнению с исходными значениями;
общая оценка состояния здоровья врачом по ВАШ на фоне терапии через 30±7, 210±7 и 330±14 дней от начала лечения;
общая оценка состояния здоровья пациентом по ВАШ на фоне терапии через 30±7, 210±7 и 330±14 дней от начала лечения;
ответ на терапию по критериям OMERACT-OARSI (статусу «хорошего ответа» соответствовало улучшение показателей боли или функции на ≥50% и ≥20 мм по ВАШ, «удовлетворительного ответа» — улучшение на 20% и 10 мм по ВАШ двух из трех следующих показателей: боль, функция, общая оценка состояния пациентом) через 30±7, 210±7 и 330±14 дней от начала лечения;
снижение потребности в сопутствующей терапии НПВП/анальгетиками через 30±7, 210±7 и 330±14 дней от начала лечения;
динамика изменений по результатам ультразвукового исследования (УЗИ) коленных суставов: толщина синовиальной оболочки и наличие синовиальной жидкости в полости сустава через 210±7 дней от начала лечения.
Безопасность оценивалась на каждом визите путем проведения медицинского осмотра и сбора данных о возможных нежелательных явлениях (НЯ).
Методы обследования
Клинический осмотр. На каждого больного заполнялась индивидуальная регистрационная карта, включающая антропометрические данные (рост, масса тела, индекс массы тела), данные анамнеза, клинического осмотра, включая применение НПВП. Оценка боли и функциональной активности проводилась с использованием ВАШ, WOMAC (при поражении коленного сустава), AUSCAN (при поражении мелких суставов кистей) на каждом визите. Также на каждом визите оценивались общий эффект от проводимой терапии и суточная потребность в НПВП.
Инструментальные методы. Рентгенография кистей (при ОА кистей) и/или коленных суставов выполнялась при включении в исследование. Допускалось использование рентгеновских снимков, выполненных в других лечебных учреждениях. УЗИ пораженных суставов выполнялось при включении в исследование и через 210±7 caдней.
Безопасность терапии оценивалась на основании наличия и тяжести НЯ.
Результаты лечения препаратом АМБЕНЕ® БИО анализировались отдельно в каждой группе пациентов с ОА в зависимости от преимущественной локализации: с поражением коленных суставов и мелких суставов
кистей.
Статистический анализ результатов
Анализ проводился с использованием программы Statistics v.23. Использовались методы описательной статистики с вычислением средних значений переменных, стандартных отклонений, а также с определением статистической значимости различий между средними значениями переменных с помощью метода Вилкоксона для распределения, отличающегося от нормального. При сравнении частот между группами использованы критерий χ2, критерий Фишера, критерий Манна — Уитни.
Результаты исследования
Следует отметить, что количество пациентов, ответивших на терапию по критериям OMERACT-OARSI, было высоким (около 90%) и не различалось между группами.
Данные статистического анализа полученных результатов подтвердили достижение первичной конечной точки — выраженного снижения болевого синдрома при движении — уже после первого курса терапии. Достигнутые результаты удерживались в течение длительного времени. При этом после проведения второго курса терапии наблюдалась дальнейшая положительная динамика (рис. 2).
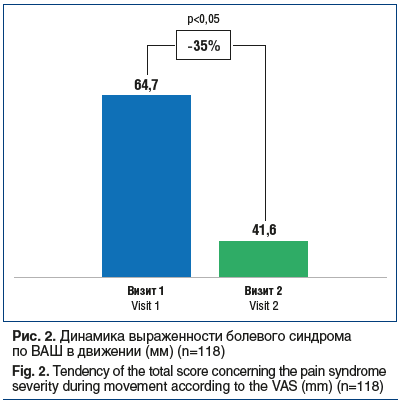
Среди пациентов с гонартрозом наблюдалась существенная положительная динамика по всем шкалам индекса WOMAC (боль, скованность, нарушение функции, общий показатель), а также регЦ 8стрировалось значимое уменьшение боли по 100-мм ВАШ, особенно сразу после завершения 20-дневного курса терапии (табл. 2).
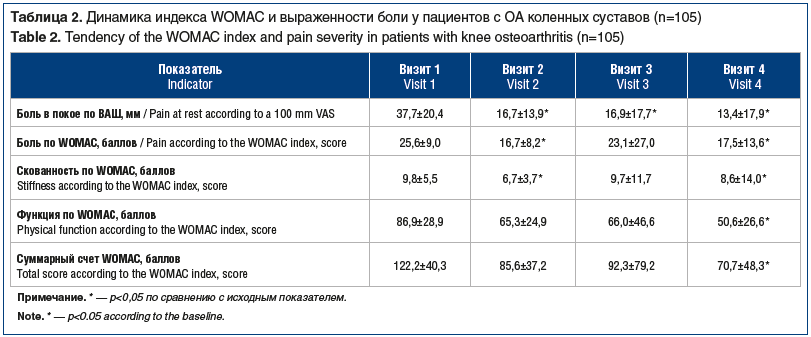
Различия между исходными и конечными значениями этих показателей были статистически значимыми (р<0,005). Важно отметить, что повторный курс инъекционной терапии, проведенный через 24 нед., оказал дополнительный положительный эффект, выразившийся в улучшении функции в целевом суставе и уменьшении боли в среднем на 24%.
По данным УЗИ после двух курсов терапии АМБЕНЕ® БИО наблюдалась тенденция к уменьшению толщины синовиальной оболочки (р=0,42), при этом более чем у половины пациентов с ОА коленного сустава уменьшился или полностью исчез выпот в полости сустава, что свидетельствует о значительном снижении активности воспалительного процесса.
Больные с гонартрозом дали высокую оценку результативности проводимЦ eй терапии согласно критериям ответа OMERACT-OARSI. Так, уже после завершения первого курса терапии хороший эффект наблюдался в 65% случаев, а удовлетворительный — в 22% случаев. 103 пациента были полностью удовлетворены результатами терапии в течение длительного периода (48 нед.), более чем у 82% пациентов эффект от терапии сохранялся в течение года.
Потребность в постоянном приеме НПВП по сравнению с началом лечения снизилась с 73,4% до 45,8% больных (p=0,003).
Таким образом, терапия АМБЕНЕ® БИО позволяет не только эффективно купировать болевой синдром у больных с ОА, но и повысить безопасность проводимого лечения за счет снижения риска развития НЯ на фоне приема НПВП.
Немногочисленную группу составили пациенты с поражением мелких суставов кистей рук. Интересно отметить, что пациенты этой группы (средний возраст 56,6±9,07 года) оказались моложе пациентов с ОА коленных суставов (средний возраст 61,8±10,8 года) примерно на 5 лет, однако длительность заболевания была такой же (44,0±6,92 и 42,3±26,2 мес. соответственно).
Результаты оценки боли, скованности и функции мелких суставов свидетельствовали о том, что терапия препаратом АМБЕНЕ® БИО оказала существенный положительный эффект (табл. 3).
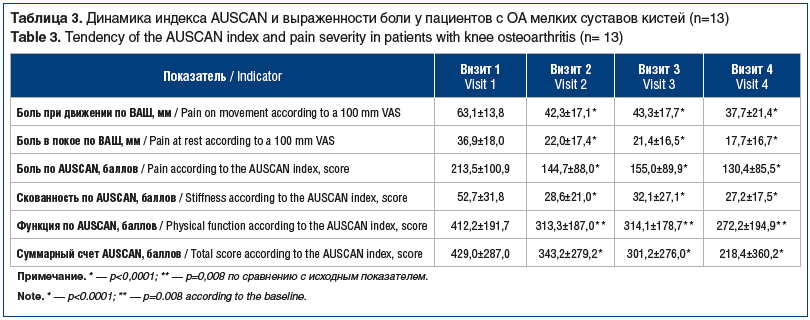
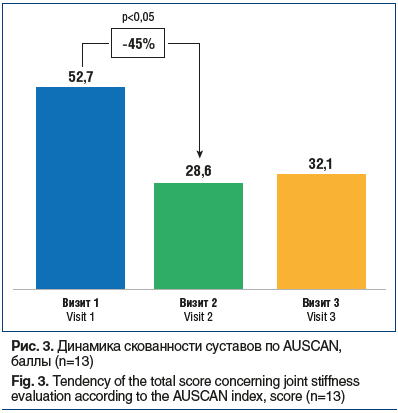
Выраженное, увеличившееся почти в 2 раза снижение скованности наблюдалось уже после первого курса терапии препаратом АМБЕНЕ® БИО, а лечебный эффект сохранялся в течение 6 мес. (рис. 3).
Также значимо уменьшилась интенсивность боли после первого и второго курсов терапии по сравнению с исходной. Одновременно исследователями регистрировалось постепенное улучшение функции кисти.
Оценка ответа на терапию по критериям OMERACT-OARSI показала, что Визиту 3 хороший эффект от проводимой терапии наблюдался у 75% больных, к Визиту 4 — у 83,3%, и только у 1 пациента стабильно на протяжении исследования не отмечалось положительной динамики согласно опроснику.
На момент Визита 1 пациенты с ОА мелких суставов кистей рук в 100% случаев нуждались в постоянном приеме НПВП, а изучаемая схема терапии позволила Визиту 4 снизить данный показатель более чем в 2 раза (до 58,4%) (р=0,01).
Исследование продемонстрировало высокий профиль безопасности и хорошую переносимость проводимой терапии. Не было зафиксировано случаев серьезных НЯ, потребовавших прервать курс лечения. В течение всего исследования не наблюдалось негативного влияния терапии препарЦ 0том АМБЕНЕ® БИО на показатели клинического и биохимического анализа крови.
Таким образом, проведенное исследование показало достижение всех выбранных конечных точек вне зависимости от локализации ОА, что говорит о высокой эффективности терапии препаратом АМБЕНЕ® БИО.
Применение современного отечественного инъекционного хондропротектора АМБЕНЕ® БИО в комплексной терапии ОА обеспечивает существенное улучшение состояния больных и способствует эффективному снижению боли за счет специально подобранного состава биологически активных веществ и широкого спектра фармакологических эффектов. Помимо хондроитина сульфата в его состав входят 15 аминокислот, пептиды, микро- и макроэлементы. Благодаря комплексному составу АМБЕНЕ® БИО хрящевая ткань получает дополнительный субстрат для синтеза новых структурных единиц, что критически важно для увеличения эффективности терапии. АМБЕНЕ® БИО оказывает патогенетическое действие на пораженные суставы и не только облегчает боль и восстанавливает нарушенное функционирование, но и способствует снятию воспаления, прекращению деградации хряща и восстановлению хрящевой ткани.
Одним из преимуществ АМБЕНЕ® БИО является современная технология производства — биоэкстракция, которая позволяет получать препарат с определенным количеством действующего вещества (100 мг в 1 мл), полностью очищенный от примесей, с определенным размером пептидов и точным рН. Именно благодаря этой технологии АМБЕНЕ® БИО обладает высокой эффективностью и благоприятным профилем безопасности. Удобный короткий курс лечения препаратом позволяет обеспечить высокую приверженность терапии и сохранить результат в течение не менее 6 мес.
Выводы
Терапия препаратом АМБЕНЕ® БИО ОА мелких и крупных суставов позволяет добиться статистически значимого уменьшения выраженности болевого синдрома и улучшения функционального состояния сустава у большинства пациентов независимо от пола, возраста и сопутствующих заболеваний.
Применение АМБЕНЕ® БИО позволяет снизить потребность в НПВП и сократить кратность их приема, что особенно важно для коморбидных пациентов.
Высокая эффективность предлагаемой схемы терапии наблюдается при ОА как крупных, так и мелких суставов.
Анальгетический и хондропротективный эффекты препарата АМБЕНЕ® БИО наблюдаются уже после первого курса терапии, усиливаются после второго курса и сохраняются до 6 мес.
По данным УЗИ отмечается уменьшение выпота в полости коленных суставов и снижение толщины синовиальной оболочки через 12 мес., что свидетельствует о наличии противовоспалительного действия исследуемого препарата.
Терапия препаратом АМБЕНЕ® БИО характеризуется высоким профилем безопасности и хорошей переносимостью.
Полученные результаты подтверждают целесообразность выбранной схемы терапии и повторных курсов каждые полгода для поддержания достигнутого эффекта и замедления прогрессирования ОА.
Сведения об авторах:
Феклистов Алексей Юрьевич — младший научный сотрудник лаборатории остеопороза ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0002-7661-3124.
Алексеева Ольга Геннадьевна — к.м.н., научный сотрудник лаборатории инструментальной диагностики ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0003-3067-9175.
Воробьева Любовь Дмитриевна — к.м.н., младший научный сотрудник лаборатории псориатического артрита ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0002-8626-8419.
Сухинина Анастасия Валерьевна — врач-рентгенолог отделения лучевой диагностики ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0003-1505-7563.
Андрианова Ирина Александровна — к.м.н., научный сотрудник лаборатории аксиального спондилоартрита ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0003-0291-524Х.
Меньшикова Ирина Вадимовна — д.м.н., профессор кафедры госпитальной терапии № 1 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России; 119048, Россия, г. Москва, ул. Трубецкая, д. 8; ORCID iD 0000-0003-3181-5272.
Сороцкая Валентина Николаевна — д.м.н., доцент, профессор кафедры внутренних болезней ФГБОУ ВО ТулГУ; 300012, Россия, г. Тула, пр. Ленина, д. 92; ORCID iD 0000-0003-3684-7310.
Зоткин Евгений Германович — д.м.н., ведущий научный сотрудник ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0002-4579-2836.
Контактная информация: Зоткин Евгений Германович, e-mail: ezotkin@mail.ru.
Источник финансирования: исследование проведено при поддержке ООО «ПРОМОМЕД ДМ».
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 12.02.2022.
Поступила после рецензирования 21.03.2022.
Принята в печать 13.04.2022.
About the authors:
Alexey Yu. Feklistov — Junior Researcher of the Laboratory of Osteoporosis, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0002-7661-3124.
Olga G. Alekseeva — C. Sc. (Med.), Researcher of the Laboratory of Instrumental Diagnostics, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0003-3067-9175.
Lyubov D. Vorobyova — C. Sc. (Med.), Junior Researcher of the Laboratory of Psoriatic Arthritis, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0002-8626-8419.
Anastasia V. Sukhinina — radiologist of the Department of Radiation Diagnostics, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0003-1505-7563.
Irina A. Andrianova — C. Sc. (Med.), Researcher of the Laboratory of Axial Spondyloarthritis, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0003-0291-524Х.
Irina V. Menshikova — Dr. Sc. (Med.), Professor of the Department of Hospital Therapy, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 build. 2, Trubetskaya str., Moscow, 119991, Russian Federation.
Valentina N. Sorotskaya — Dr. Sc. (Med.), Associate Professor, Professor of the Department of Internal Diseases, Tula State University; 92, Lenin Ave, Tula, 300012, Russian Federation; ORCID iD 0000-0003-3684-7310.
Evgeniy G. Zotkin — Dr. Sc. (Med.), Senior Researcher of the Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0002-4579-2836.
Contact information: Evgeniy G. Zotkin, e-mail: ezotkin@mail.ru.
Funding Sources: the study was supported by PROMOMED DM LLC.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 12.02.2022.
Revised 21.03.2022.
Accepted 13.04.2022.
.
Информация с rmj.ru






