Содержание статьи
Введение
Пандемия COVID-19 представляет собой глобальную проблему, включающую лечение пациентов не только с острым течением заболевания, но и с постковидными синдромами (long COVID). Быстрое распространение COVID-19 требует принятия многих инновационных решений, в том числе по оптимизации тактики применения генно-инженерных и таргетных препаратов у пациентов с иммуновоспалительными ревматическими заболеваниями (РЗ). На фоне COVID-19 нередко наблюдается развитие системного гипервоспаления, сопровождающегося «цитокиновым штормом» (ЦШ) с формированием острого респираторного дистресс-синдрома (ОРДС), нарушениями гемостаза и тяжелым васкулитом, в ряде случаев жизнеугрожающего характера [1]. ЦШ представляет собой неконтролируемую системную воспалительную реакцию, развивающуюся под влиянием целого ряда факторов, включая инфекционные агенты и сопутствующие заболевания [2]. Вместе с тем остаются дискуссионными представления о ЦШ и синдроме высвобождения цитокинов [3]. Большинство исследователей считают, что непосредственное участие в формировании ЦШ у пациентов с COVID-19 принимают интерлейкин (ИЛ) 6, ИЛ-1β, фактор некроза опухоли-α (ФНО-α), интерферон-γ, макрофагальные воспалительные белки 1α и 1β и другие цитокины [4, 5]. При этом ИЛ-6 отводится ключевая роль в развитии синдрома гипервоспаления. Доказано, что его повышенная концентрация в крови ассоциирована с развитием тяжелых структурных изменений в легких и нарастающей дыхательной недостаточности, а также ОРДС, ведущих к высокой летальности среди пациентов с COVID-19. При повышении уровня ИЛ-6 более 80 пг/мл риск развития дыхательной недостаточности у пациентов повышается в 22 раза [6, 7].
Блокада ИЛ-6-зависимого провоспалительного каскада и неблагоприятных биологических эффектов данного цитокина является ключевым аспектом патогенетической терапии COVID-19, что обеспечивает предотвращение активации антиген-презентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, а также блокирует избыточную продукцию других провоспалительных цитокинов и острофазовых белков в гепатоцитах (C-реактивного белка (СРБ), фибриногена, сывороточного белка амилоида А, гепсидина и др.) [8–10]. В настоящее время выделяют
4 стадии ЦШ [11]:
Стадия 1. Общие симптомы: слабость, лихорадка, головная боль, тошнота.
Стадия 2. Симптомы, требующие умеренных терапевтических вмешательств: гипотензия, токсическое поражение тканей, функциональные нарушения отдельных органов.
Стадия 3. Симптомы, требующие агрессивных терапевтических вмешательств: тахипноэ, гипоксия, токсическое поражение тканей, шок и др.
Стадия 4. Жизнеугрожающие симптомы: ОРДС, тяжелая гипоксия, тяжелое токсическое поражение тканей, полиорганная недостаточность.
Ключевые симптомы ЦШ развиваются в конце первой — начале второй недели заболевания, и при своевременном поступлении пациента в стационар имеется «окно возможностей» для проведения упреждающей противовоспалительной терапии с помощью генно-инженерных биологических препаратов (ГИБП).
Собственный опыт применения ГИБП для лечения COVID-19
Известно, что для лечения тяжелого и критического COVID-19 используются моноклональные антитела к рецепторам ИЛ-6 (левилимаб, тоцилизумаб и сарилумаб) или к самому ИЛ-6 (олокизумаб), а также ГИБП канакинумаб — моноклональные антитела к ИЛ-1β. Согласно методическим рекомендациям Минздрава России при лечении нетяжелого COVID-19 можно использовать ингибитор ИЛ-17 — нетакимаб [11]. Назначение антицитокиновых препаратов при СОVID-19 рассматривается, прежде всего, в качестве упреждающей терапии развития ЦШ. В 2017 г. тоцилизумаб был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (U.S. Food and Drug Administration, FDA) для купирования синдрома высвобождения провоспалительных цитокинов при проведении терапии лимфоцитами с химерными антигенными рецепторами (Chimeric Antigen Receptors Cell Therapy, CAR-Т-терапии), а в марте 2020 г. появились первые данные о его эффективности при лечении COVID-19. В апреле 2020 г. начато применение off-label сарилумаба, а в июне 2020 г. — олокизумаба. В декабре 2020 г. ингибитор рецепторов ИЛ-6 левилимаб (Илсира®,ЗАО «БИОКАД») был зарегистрирован по показанию «Патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19)». Основанием для этого явились результаты клинического исследования BCD-089–4/CORONA, посвященного изучению эффективности и безопасности левилимаба у пациентов c тяжелым течением COVID-19 (в исследование было включено 206 пациентов, из которых 103 получали подкожно однократно левилимаб в дозе 324 мг, а 103 — плацебо). Однократное введение левилимаба пациентам с тяжелой формой COVID-19 обеспечивало увеличение на 20% частоты достижения устойчивого клинического улучшения (выписки из стационара), а также в 3,3 раза снижало частоту перевода пациентов в отделение реанимации и интенсивной терапии. Кроме того, левилимаб при подкожном введении в дозе 324 мг показал благоприятный профиль безопасности, сравнимый с таковым у ингибиторов рецепторов ИЛ-6 [10]. В июне 2021 г. Минздрав России одобрил препарат олокизумаб по новому показанию — «Патогенетическая терапия синдрома высвобождения цитокинов при новой коронавирусной инфекции (COVID-19) среднетяжелого и тяжелого течения». Препарат стал вторым лекарственным средством, получившим регистрацию по упрощенной схеме.
Сравнивая между собой ГИБП, применяемые при лечении COVID-19, следует отметить, что они представляют собой моноклональные антитела с различной молекулярной структурой. Так, тоцилизумаб и олокизумаб являются гуманизированными препаратами, сарилумаб — человеческим, а левилимаб имеет аминокислотную последовательность, максимально приближенную к человеческой [10]. Механизм действия тоцилизумаба, левилимаба и сарилумаба сводится к блокаде мембранных и растворимых рецепторов ИЛ-6, а олокизумаба — к ингибированию самого цитокина, что ведет к подавлению ИЛ-6-зависимого провоспалительного каскада. Следует отметить, что тоцилизумаб и сарилумаб зарегистрированы только для лечения РЗ, а левилимаб и олокизумаб применяются в терапии синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции и ревматоидного артрита [10].
Согласно рекомендациям Минздрава России тоцилизумаб и сарилумаб назначаются при тяжелом и критическом течении COVID-19 внутривенно с развитием эффекта в течение 12 ч. Левилимаб и олокизумаб вводятся подкожно — при среднетяжелом течении COVID-19, но особенностью левилимаба является быстрое нарастание концентрации в крови (ко 2-м суткам достигаются терапевтические значения, максимальные — к 4-м суткам), а блокада 90% мембранных рецепторов ИЛ-6 происходит уже в первые часы после введения данного лекарственного средства [11].
Следует отметить, что Ассоциацией ревматологов России в 2020 г. были разработаны клинические рекомендации по лечению РЗ в период пандемии COVID-19.
Хорошо известен тот факт, что на фоне применения ГИБП в остром периоде COVID-19 повышается риск развития бактериальной, в том числе оппортунистической (грибковой) инфекции [11]. Особенности течения вторичной бактериальной инфекции на фоне иммуносупрессивной терапии включают: отсутствие лихорадки или субфебрилитет, низкие (или незначительно повышенные) маркеры воспаления (уровень СРБ в сыворотке крови, умеренно повышенное количество лейкоцитов в периферической крови или нейтропения).
Нами были изучены особенности комплексной терапии иммуновоспалительных РЗ в условиях пандемии COVID-19. Проведен анализ течения COVID-19 у пациентов с РЗ, получавших комбинированную терапию генно-инженерными и базисными синтетическими противоревматическими препаратами и находившихся под наблюдением в ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России в период с марта 2020 г. по март 2021 г. За этот период было зарегистрировано заболевание COVID-19 у 133 (9,57%) из 1389 больных РЗ, включенных в регистры центра антицитокиновой терапии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России (табл. 1). В 76% случаев пациенты получали ГИБП в сочетании с синтетическими базисными противовоспалительными средствами.
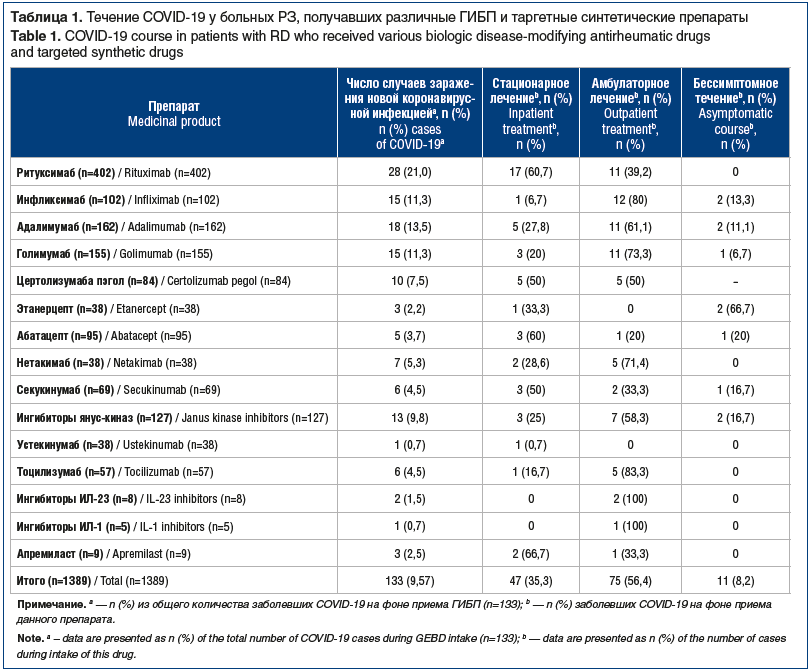
Применение ритуксимаба ассоциировалось с более тяжелым течением COVID-19, что потребовало госпитализации в 60,7% случаев, по сравнению с группой пациентов, получавших лечение ингибиторами ФНО-α (инфликсимаб, адалимумаб, голимумаб, цертолизумаба пэгол и этанерцепт), у которых в случае заболевания COVID-19 стационарное лечение было проведено только в 15 (24,5%) из 61 случая. Использование блокаторов костимуляции Т-клеток, ингибиторов ИЛ-6, ИЛ-17, ИЛ-1, ИЛ-23 не влияло на тяжесть течения COVID-19.
Обострение суставного синдрома наблюдалось лишь у 7 (14,9%) из 47 госпитализированных пациентов с РЗ. Низкий процент обострений у пациентов с РЗ на фоне COVID-19, вероятно, был связан с применением дексаметазона в диапазоне доз от 16 мг до 32 мг, обладающего способностью снижать активность иммуновоспалительного процесса при РЗ. Данное положение подтверждает тот факт, что из 47 больных РЗ, находившихся на стационарном лечении по поводу COVID-19, 21 (44,7%) пациент получал дексаметазон внутримышечно или внутривенно, а 6 пациентов из них продолжили пероральный прием данного препарата. При этом следует подчеркнуть, что у пациентов этой группы сохранялся высокий уровень СРБ (>10 верхних границ нормы) без клинических признаков инфекционного заболевания и активности РЗ. Не наблюдалось высокой частоты осложнений со стороны сердечно-сосудистой системы. Так, артериальная гипотония отмечалась лишь у 2 из 133 (1,5%) пациентов (через 8 нед. после перенесенного COVID-19), а ухудшение течения гипертонической болезни — у 3 (2,3%) больных, включенных в исследование. Вместе с тем у 23 (17,3%) из 133 пациентов мы наблюдали клинические проявления астенического синдрома (слабость, выраженная усталость, тревожность), а у 5 из 133 (3,7%) — выпадение волос. На следующем этапе исследования нами оценивалась взаимосвязь между проводимой терапией ГИБП, а также таргетными синтетическими препаратами до инфицирования COVID-19 и степенью выраженности поражений легких, характерных для COVID-19. ГИБП и таргетные синтетические препараты до инфицирования получали 47 пациентов. Оказалось, что у значительной части пациентов (n=19, 40%) интерстициальные поражения легких соответствовали изменениям легочной ткани, определяемым как КТ-1. Поражение легочной ткани КТ-2 определялось у 12 (25,5%), а КТ-3 — у 13 (27,6%) больных. Наиболее тяжелые случаи течения COVID-19 (КТ-3 и КТ-4) наблюдались чаще всего у пациентов (n=9), получавших лечение ритуксимабом (табл. 2).
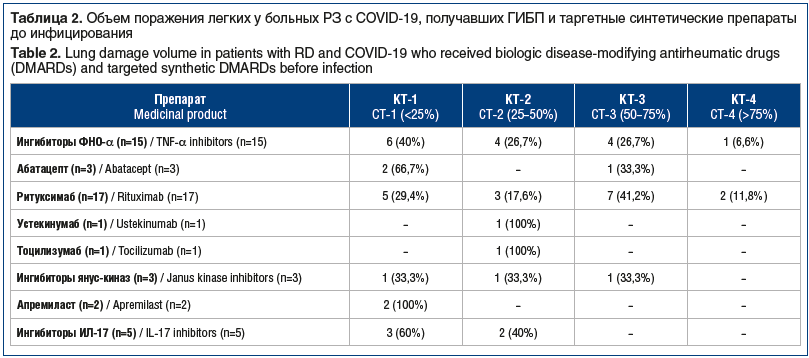
В проекте рекомендаций Ассоциации ревматологов России указано положение о том, что пациенты с РЗ составляют группу риска инфицирования и тяжелого течения COVID-19, однако терапия с использованием ГИБП не сопровождается увеличением риска тяжелого течения COVID-19, кроме применения ритуксимаба. Наряду с этим в рекомендациях обращается внимание на перечень противопоказаний к назначению ГИБП, а также необходимость контроля за развитием бактериальной инфекции и особенностями ее течения на фоне терапии биологическими препаратами [11]. Результаты проведенного нами исследования подтверждают основные положения отечественных рекомендаций, поскольку нам не удалось выявить статистически значимых различий в отношении риска инфицирования SARS-CoV-2 и тяжелого течения COVID-19 у пациентов с РЗ, получавших ГИБП и таргетные синтетические препараты, по сравнению с общей популяцией, но была обнаружена связь с более тяжелым течением новой коронавирусной инфекции при использовании анти-В-клеточной терапии.
Дискутабельным остается вопрос об эффективности применения ингибиторов янус-киназ в комплексном лечении пациентов с COVID-19. В рамках работы ковид-центра ФГБОУ ВО СЗГМУ им. И.И. Мечникова проведено исследование, целью которого было сравнение влияния комплексной терапии с применением барицитиниба и дексаметазона на течение интерстициальной пневмонии, вызванной COVID‑19. Проведен ретроспективный анализ историй болезни 122 человек, госпитализированных в центр по лечению больных COVID‑19. Все пациенты были разделены на три группы: первая группа — 64 пациента, получавшие комплексную терапию, в том числе барицитиниб; вторая группа — 33 пациента, в комплексную терапию которых входил дексаметазон; третья группа (группа сравнения) — 25 пациентов, получавших стандартную комплексную терапию. В первой группе объем поражения легких у пациентов составлял 25–50% и 50–75% (КТ-2 и КТ-3) у 78% больных, более 75% — у 14,1% больных, что сопровождалось тяжелыми клиническими проявлениями, высокими значениями лабораторных показателей. На фоне терапии положительная динамика по КТ наблюдалась в 48,4% случаев. Во второй группе объем поражения легочной ткани КТ-2 и КТ-3 наблюдался у 84,9% обследуемых, клинико-лабораторные показатели соответствовали среднетяжелому течению. На фоне комплексной терапии положительная динамика по КТ отмечена в 18,2% случаев. В группе сравнения на фоне терапии положительная динамика по КТ зарегистрирована у 56% пациентов. У пациентов всех трех групп на фоне лечения клинико-лабораторные показатели нормализовались.
Особенностями пациентов, получавших барицитиниб, явились наличие наибольшего количества коморбидной патологии и тяжелое течение COVID-19. Во всех группах происходила нормализация клинико-лабораторных показателей. В результате стандартной комплексной терапии, а также терапии, включавшей барицитиниб или дексаметазон, положительная динамика по данным КТ наблюдалась у 48,4, 18,2 и 56% пациентов соответственно [2].
Клинические наблюдения
Клиническое наблюдение применения левилимаба в лечении COVID-19
Пациент Б., 57 лет, с 2017 г. наблюдается в клинике ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России по поводу анкилозирующего спондилита (АС) с внесуставными проявлениями (язвенный колит). В связи с неэффективностью базисной терапии салазопрепаратами в сочетании с глюкокортикоидами, а также невозможностью применения адекватных доз НПВП в августе 2017 г. ему была назначена генно-инженерная биологическая терапия адалимумабом. Недостаточная эффективность проводимого лечения послужила поводом для переключения пациента в ноябре 2017 г. с адалимумаба на голимумаб. На фоне комбинированной терапии голимумабом в сочетании с салофальком была достигнута лекарственная ремиссия АС.
В мае 2021 г. пациенту был введен первый компонент комбинированной векторной вакцины для профилактики новой коронавирусной инфекции COVID-19. На 5-й день после вакцинации пациент отметил повышение температуры тела до 39 °C, появился кашель с трудно отделяемой мокротой, участковым терапевтом амбулаторно инициирована терапия противовирусными (фавипиравир), антибактериальными (левофлоксацин) препаратами. На фоне терапии сатурация снизилась до 88%. При проведении мультиспиральной компьютерной томографии (МСКТ) грудной клетки на догоспитальном этапе были выявлены признаки двухстороннего интерстициального поражения легочной ткани в объеме 19% (КТ-1). Из лабораторных показателей обращало на себя внимание увеличение скорости оседания эритроцитов (СОЭ) до 60 мм/ч и повышение СРБ до 94,44 мг/л (при нормальных значениях 0–1 мг/л), результат полимеразной цепной реакции (ПЦР) на SARS-CoV-2 положительный от 22.06.2021. Пациент был госпитализирован в центр по лечению COVID-19 ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России 23.06.2021 с диагнозом: «Новая коронавирусная инфекция COVID-19, вирус идентифицирован 22.06.2021, тяжелое течение. Внебольничная двусторонняя полисегментарная пневмония, дыхательная недостаточность 2-й степени». Следует полагать, что COVID-19 развился в ближайшие дни после введения первого компонента вакцины. Голимумаб был отменен и добавлен дексаметазон внутривенно по общепринятой схеме. Однако в связи с быстрым нарастанием объема поражения легких (72%, КТ-3), снижением сатурации и высокой лабораторной активностью заболевания пациенту 24.06.2021 был подкожно введен левилимаб в дозе 324 мг. Наряду с этим была продолжена противовирусная терапия фавипиравиром, а также антибактериальными средствами (левофлоксацином), антикоагулянтами и глюкокортикостероидами. В результате проведения комплексной терапии с применением левилимаба отмечалось быстрое снижение активности воспалительного процесса (снижение уровней СРБ и СОЭ), а через 6 дней — значимое снижение уровней D-димера и ферритина (табл. 3).
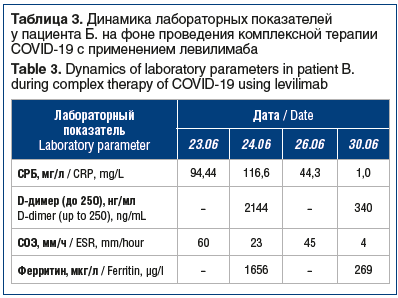
Пациент был выписан из стационара после получения отрицательного результата ПЦР-теста на SARS-CoV-2 и переведен в реабилитационный центр. Терапия салофальком и голимумабом возобновлена после стационарного лечения на 3-й и 6-й день соответственно. Нежелательных явлений на фоне проводимой терапии не наблюдалось. У больного сохраняется минимальная клинико-лабораторная активность АС.
Клиническое наблюдение течения COVID-19 на фоне применения комбинированной иммуносупрессивной терапии
Пациентка Е., 65 лет. Дебют суставного синдрома в 1995 г., когда развился артрит мелких суставов кистей. Диагноз ревматоидного артрита (верифицирован в 1997 г., из сопутствующих заболеваний обращали на себя внимание гипертоническая болезнь и сахарный диабет 2 типа с инсулиновой недостаточностью). В связи с недостаточной эффективностью синтетических базисных препаратов (метотрексат, лефлуномид) в апреле 2019 г. была назначена комбинированная терапия ритуксимабом и метотрексатом 15 мг/нед. (для пациентки максимально переносимая доза), на фоне которой была достигнута умеренная активность заболевания. Последнее введение ритуксимаба выполнено в ноябре 2019 г. в дозе 500 мг.
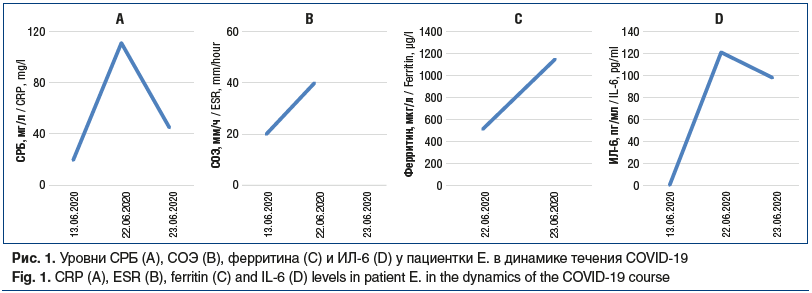
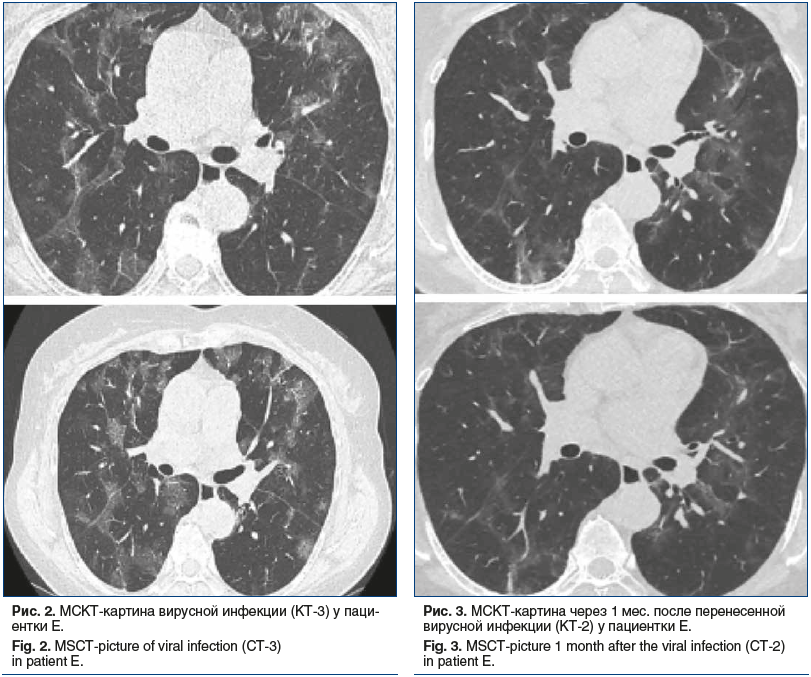
В июне 2020 г. пациентка отметила повышение температуры тела до 38,3 °C, появление аносмии, малопродуктивного кашля, нарастающей слабости, а также ухудшение течения ревматоидного артрита. Через 4 дня (12.06.2020) присоединилась диарея. При проведении МСКТ грудной клетки было обнаружено поражение легких в объеме 44% (КТ-2), свойственное для COVID-19. Положительный результат ПЦР на SARS-CoV-2 подтвердил диагноз данного инфекционного заболевания, и 13.06.2020 пациентка была госпитализирована в ковид-центр. Начата терапия дексаметазоном (суммарная доза 68 мг за 5 сут), гидроксихлорохином, левофлоксацином, метронидазолом, азитромицином, антикоагулянтами, проводилась оксигенация. При МСКТ в динамике (от 22.06.2020) наблюдалось нарастание объема поражения легких до 50%. Динамика лабораторных показателей пациентки приведена на рисунке 1.
Учитывая нарастание объема поражения легких (рис. 2-3),
прогрессирующую дыхательную недостаточность и ухудшение лабораторных показателей (СРБ >100 мг/л, ферритин >1000 мкг/л, ИЛ-6 120 пг/мл), было заподозрено развитие у пациентки ЦШ, что явилось основанием для назначения тоцилизумаба 400 мг однократно (23.06.2020). После введения данного препарата отмечалось снижение маркеров воспаления, улучшение сатурации, купирование суставного синдрома. Пациентка выписана 01.07.2020 из стационара для продолжения лечения в амбулаторных условиях. По данным контрольной МСКТ от 21.07.2020 обнаружено значительное уменьшение интенсивности зон уплотнения легочной ткани по типу «матового стекла», а также зон ретикулярных изменений по типу «булыжной мостовой» без консолидации, что соответствовало пневмонии в стадии частичного разрешения по сравнению с данными от 22.06.2020.
Учитывая благоприятный эффект, оказанный введением тоцилизумаба на течение ревматоидного артрита (6 мес. низкой активности), было решено продолжить терапию этим ГИБП для поддержания достигнутой низкой активности заболевания. В марте 2021 г. при обследовании пациентки в амбулаторных условиях признаков воспаления не отмечалось: СОЭ 7 мм/ч, СРБ 1,4 мг/л, индекс DAS28-СОЭ 1,88, что соответствовало ремиссии ревматоидного артрита. На контрольной МСКТ легких в марте 2021 г. наблюдалось разрешение пневмонических
очагов
Заключение
Таким образом, по результатам проведенного исследования синтетические базисные (метотрексат, лефлуномид и др.), таргетные синтетические (тофацитиниб, барицитиниб, апремиласт) и ГИБП, применяемые в лечении РЗ, за исключением глюкокортикоидов в высоких дозах и анти-В-клеточных препаратов (ритуксимаб), не оказывают негативного влияния и не ассоциируются с тяжелым течением COVID-19. Применение ингибиторов ИЛ-6 является стандартом патогенетической терапии синдрома высвобождения цитокинов при COVID-19. Упреждающая терапия ингибиторами ИЛ-6 обеспечивает торможение системного воспаления и способствует подавлению синдрома ЦШ, а также направлена на снижение риска полиорганной недостаточности и летального исхода. В определенной степени эта терапия может быть отнесена к ресурсосберегающим технологиям, обеспечивающим увеличение доли выписанных из стационара пациентов после перенесенного тяжелого COVID-19, а также снижение потребности в реанимационной поддержке.
Благодарность
Редакция благодарит компанию ЗАО «БИОКАД» за оказанную помощь в технической редактуре настоящей публикации.
Aknowledgement
The technical edition is supported by BIOCAD JSC.
Сведения об авторах:
Самигуллина Рузана Рамиловна — ассистент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи
им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, г. Санкт-Петербург,
ул. Кирочная, д. 41; ORCID iD 0000-0002-6341-3334.
Мазуров Вадим Иванович — д.м.н., академик РАН, заслуженный деятель науки Российской Федерации, профессор, главный научный консультант, директор НИИ ревматологии и заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-0797-2051.
Трофимов Евгений Александрович — к.м.н., доцент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи
им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, г. Санкт-Петербург,
ул. Кирочная, д. 41; ORCID iD 0000-0003-3236-4485.
Контактная информация: Самигуллина Рузана Рамиловна, e-mail: dr.samigullina@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 14.07.2021.
Поступила после рецензирования 06.08.2021.
Принята в печать 31.08.2021.
About the authors:
Ruzana R. Samigullina — Assistant Professor of the Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care named after
E.E. Eichwald, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., Saint Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-6341-3334.
Vadim I. Mazurov — Academician of the Russian Academy of Sciences, Honored Scientist of the Russian Federation, Dr. Sc. (Med.), Professor, Chief Scientific Consultant, Director of the Research Institute of Rheumatology, Head of the Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, North-Western State Medical University named after
I.I. Mechnikov; 41, Kirochnaya str., Saint Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-0797-2051.
Evgeny A. Trofimov — C. Sc. (Med.), Associate Professor of the Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care named after
E.E. Eichwald, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., Saint Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-3236-4485.
Contact information: Ruzana R. Samigullina, e-mail: dr.samigullina@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 14.07.2021.
Revised 06.08.2021.
Accepted 31.08.2021.
.
Информация с rmj.ru




