Хронические заболевания суставов
Н. В. Чичасова, доктор медицинских наук, профессор
Г. Р. Имаметдинова, кандидат медицинских наук
Е. В. Иголкина, кандидат медицинских наук
Е. Л. Насонов, доктор медицинских наук, профессор, академик РАМН
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Наряду с артериальной гипертензией (АГ), заболевания суставов различной локализации являются одной из самых частых причин обращения пациентов к врачу. Социальная значимость патологии суставов определяется большой распространенностью, многолетним персистированием боли и воспаления, постепенным ухудшением качества жизни больных. Наиболее распространенным заболеванием суставов является деформирующий остеоартроз (ОА), особенно у лиц старше 65 лет, у которых его распространенность достигает 97%. Среди хронических воспалительных заболеваний суставов наиболее частым является ревматоидный артрит (РА) — заболевание, практически облигатно приводящее к инвалидизации больных уже через 3–5 лет от дебюта болезни. Все заболевания суставов характеризуются развитием хронической боли, наиболее частая причина которой — наличие хронического воспаления синовиальной оболочки. Синовит при РА характеризуется наибольшей выраженностью, но и при ОА он может достигать значительной интенсивности. При ОА развитие боли может быть связано и с другими патогенетическими звеньями болезни. В норме болевые окончания имеют все структуры сустава, за исключением хряща. При ОА происходит частичная васкуляризация и иннервация хряща. Истончение и повреждение хряща снижает его амортизационные свойства, увеличивается нагрузка на субхондральную кость с развитием ее отека и боли. Кроме того, фибрилляция хряща также индуцирует боль и воспаление. Лечение хронической боли при ОА осложняется трудностью подбора наиболее эффективных и безопасных препаратов пациентам преимущественно пожилого возраста, имеющим сопутствующую патологию (наиболее часто со стороны кардиоваскулярной системы (КВС)). Необходимость подбора адекватной терапии определяется негативным влиянием боли на прогноз при ОА, так как:
- около 20% больных не получают адекватного лечения хронического болевого синдрома, поэтому уровень боли у них по 10-сантиметровой визуальной аналоговой шкале (ВАШ) составляет 5 см и более [1];
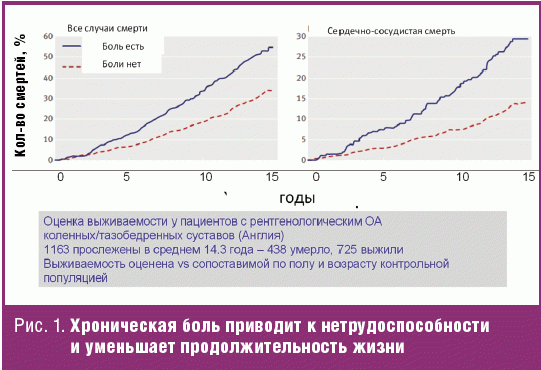
- хроническая боль при ОА приводит к уменьшению продолжительности жизни больных в среднем на 10–12 лет (рис. 1) [2];
- продолжительность жизни пожилых больных с ОА в большей степени зависит от интенсивности боли, чем от наличия сопутствующих потенциально жизнеугрожающих заболеваний [3];
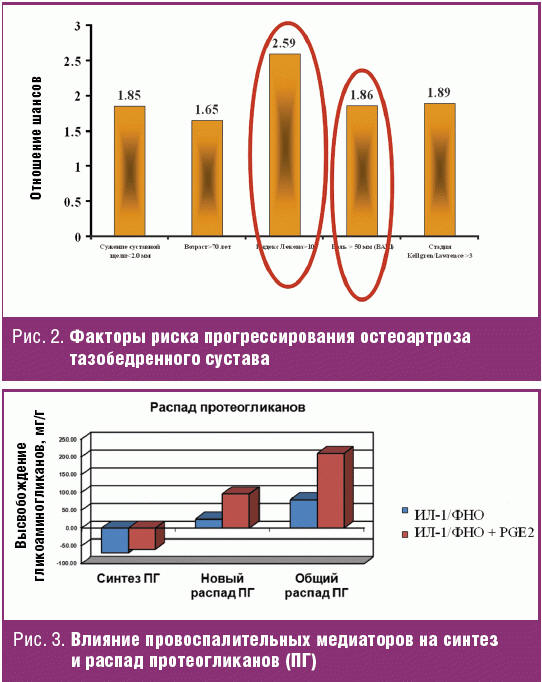
- риск прогрессирования ОА в равной степени связан с болевым синдромом, как и с рентгенологическими изменениями (рис. 2) [4].
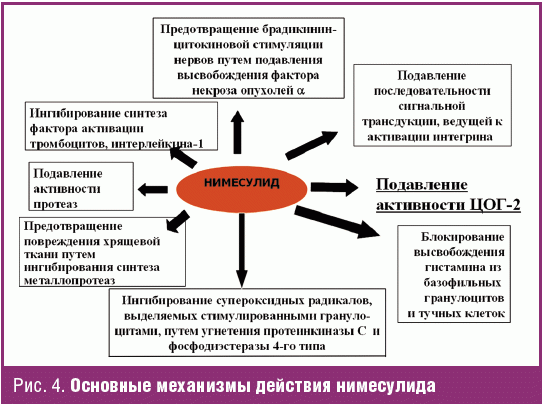
Таким образом, адекватное обезболивание при ОА, связанное с воспалительными процессами в различных структурах сустава, имеет важное значение для улучшения функционального и жизненного прогноза больных. Гиперэкспрессия простагландина PGE2 (ЦОГ-2-зависимый механизм (ЦОГ-2-циклооксигеназа 2-го типа)) не только обуславливает развитие синовита, но и потенцирует выделение других медиаторов воспаления (интерлейкинов, металлопротеиназ и др.), вызывает повреждение хрящевой ткани, снижает порог к апоптозу хондроцитов, индуцированному NO. На рис. 3 показано, что избыток PGE2 увеличивает распад протеогликанов, основных структурных элементов хрящевой ткани [5].
При РА, несмотря на применение базисных противовоспалительных препаратов и генно-инженерных биологических препаратов, по данным когортного исследования, включившего 15 000 больных, прослеженных в течение 10 лет, средний уровень боли сохранялся на одинаковом уровне, что определяет актуальность адекватного обезболивания и больных РА [6]. При РА хронический синовит имеет большую выраженность, чем при ОА, что приводит к многолетнему персистированию боли. Именно боль вызывает функциональную недостаточность опорно-двигательного аппарата больных уже на ранних стадиях болезни, приводит к дестабилизации сердечно-сосудистой системы, развитию тревоги и депрессии. Кроме того, гиперэкспрессия ЦОГ-2 в нейронах спинальной хорды приводит к феномену вторичной гиперальгезии и развитию общих симптомов болезни, таких как лихорадка, утомляемость.
Нестероидные противовоспалительные препараты (НПВП) обладают анальгетическим, противовоспалительным и жаропонижающим эффектами, благодаря чему являются незаменимыми в лечении артрологических заболеваний. Быстрое развитие обезболивающего эффекта и определяет облигатность их применения в лечении суставной патологии. Позитивный лечебный эффект НПВП связан с ингибицией ЦОГ-2. Этот фермент, участвующий в каскаде распада поврежденных при воспалении и других поражениях клеточных мембран, отвечает за выделение провоспалительных простагландинов и других медиаторов воспаления не только в суставах, но и в других органах и тканях, в первую очередь в стенках сосудов. Исходя из вышесказанного, становится ясно, что использование селективных ингибиторов ЦОГ-2 имеет важное клиническое и социальное значение.
Преимущества селективных ингибиторов ЦОГ-2 в лечении хронических заболеваний хорошо известны:
- достоверное уменьшение частоты развития нежелательных явлений со стороны желудочно-кишечного тракта (ЖКТ), почек, печени [7];
- отсутствие негативного влияния на синтез основных компонентов матрикса суставного хряща, в отличие от неселективных НПВП [5, 8];
- возможность длительного применения при хронических заболеваниях суставов и пролонгация противовоспалительной терапии ОА при необходимости (упорный синовит и пр.).
Выбор препарата, особенно с целью уменьшения хронической боли, во многом зависит от индивидуальной ответной реакции пациента, что определяет индивидуализированный подход для назначения НПВП. Ограниченное количество препаратов, преимущественно подавляющих ЦОГ-2, уже создает сложности индивидуального подбора эффективного средства. По этой причине врач, с одной стороны, должен быть ориентирован о потенциальных неблагоприятных эффектах препарата, а с другой стороны, должен быть в полной мере информирован о дискуссиях в отношении появления не доказанных данных о «токсичности» тех или иных средств. Наиболее ярким примером подобной дискуссии было обсуждение «кардиотоксичности» ингибиторов ЦОГ-2, в связи с чем регуляторные органы Европы и США опубликовали документы, в которых четко написано, что возможность неблагоприятных явлений со стороны КВС имеется у всех НПВП (в том числе и неселективных), что соотношение риск/польза говорит о сохранении селективных НПВП для лечения боли и воспаления. В ряде стран Запада, например, в Ирландии, на основании отдельных клинических случаях о гепатотоксичности нимесулидов последние были исключены из оборота. На вопросах эффективности и безопасности нимесулидов следует остановиться отдельно. Препарат Найз относится к ингибиторам ЦОГ-2, что доказано в исследованиях in vitro на молекулярных моделях [10] и in vivo [11]. Кроме того, препарат обладает еще несколькими важными механизмами действия (рис. 4) [12, 13].
Успех лечения любым НПВП, в том числе и Найзом, зависит от ряда обстоятельств.
1. Выбор препарата должен осуществляться с учетом факторов риска развития побочных реакций.
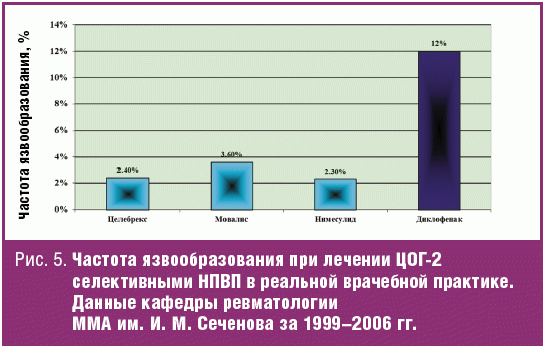
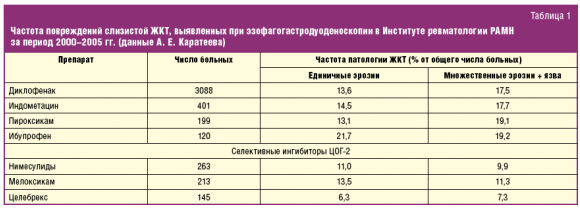
Факторы риска развития НПВП-гастропатии хорошо знакомы клиницистам: пожилой возраст, язвенный анамнез, наличие сопутствующей патологии и сопутствующей терапии, использование высоких доз НПВП, использование одновременно нескольких НПВП. Однако влияние этих факторов риска на различные проявления непереносимости НПВП имеет определенное различие. До настоящего времени наиболее частой причиной прерывания лечения НПВП являлась диспепсия (тошнота, рвота, гастралгии, чувство тяжести в верхней части живота) — до 5% всех отмен НПВП. К настоящему времени доказано, что эти симптомы не коррелируют с факторами риска развития НПВП-гастропатии и с тяжелыми повреждениями слизистой оболочки ЖКТ (язва, кровотечение, перфорация). Развитие же эрозивно-язвенного поражения слизистой желудка в 58–80% случаев не имеет симптоматики [14, 15] и плохо коррелирует с риском кровотечения. Наиболее часто множественные эрозии и язвы желудка развиваются, независимо от возраста, в первые месяцы назначения НПВП и при продолжении лечения склонны к рецидивированию. В наибольшей степени язвенно-эрозивные повреждения слизистой желудка коррелируют с наличием «язвенного» анамнеза. Таким образом, в начале лечения НПВП и в первые месяцы их применения больные нуждаются в эндоскопическом контроле. При выявлении эрозивного язвенного процесса, развившегося при приеме НПВП, врач должен сделать следующие выводы: а) этой категории больных показано назначение селективных ингибиторов ЦОГ-2; б) эта категория больных нуждается в динамическом клинико-эндоскопическом наблюдении. Назначение ингибиторов ЦОГ-2 значительно уменьшает частоту развития НПВП-гастропатии, но не полностью предупреждает ее рецидив [9]; в) для профилактики НПВП-индуцированных язв не эффективны Н2-блокаторы или антациды, профилактику можно проводить лишь ингибиторами протонной помпы. Ассоциируются с факторами риска тяжелые осложнения со стороны ЖКТ: кровотечения и перфорации. Имеются данные, что у лиц старше 65 лет до 70% осложненных кровотечением гастродуоденальных язв заканчиваются летальным исходом. Следовательно, именно пожилой контингент больных в первую очередь нуждается в назначении средств с наибольшей селективностью в отношении ЦОГ-2, тем более что у лиц пожилого возраста, как правило, имеются несколько факторов риска непереносимости НПВП: сопутствующие заболевании и сопутствующая терапия, необходимость сочетания с препаратами, имеющими сходные реакции непереносимости. Поскольку нимесулид является «НПВП с преимущественным воздействием на ЦОГ-2», он оказывает комплексное, но при этом сбалансированное влияние на обе формы ЦОГ, хотя и обладает преимущественным эффектом в отношении ЦОГ-2. В терапевтических концентрациях нимесулид ингибирует 88% активности ЦОГ-2 и 45% активности ЦОГ-1 [16]. При этом если воздействие на ЦОГ-1 прекращается по истечении 24 часов, то воздействие на ЦОГ-2 продолжается намного дольше [17], и это различие сохраняется также при длительном применении [18]. Этот своеобразный механизм действия объясняет низкое число осложнений со стороны ЖКТ. По данным многолетнего эндоскопического контроля за переносимостью различных НПВП можно отметить, что нимесулид не отличается по безопасности от других селективных ингибиторов ЦОГ-2 (рис. 5) и явно уменьшает частоту повреждений слизистой верхних отделов ЖКТ по сравнению с неселективными НПВП. Хорошая переносимость Найза в отношении желудочно-кишечного тракта отмечена отечественными исследователями (табл. 1) [19]. Хорошая переносимость нимесулида отмечена и в зарубежных контролируемых исследованиях [20, 21], при постмаркетинговом изучении переносимости нимесулида в 17 странах у 118 831 385 больных [22, 23]. Эпидемиологические данные (анализ более 10 000 спонтанных сообщений о серьезных побочных эффектах за 3 года) показали, что нимесулид в 2 раза реже, чем другие НПВП, вызывал повреждение ЖКТ [24]; в популяционном исследовании при анализе 2813 случаев развития ЖК-кровотечения относительный риск его развития для нимесулида был 3,2; для Диклофенака — 3,7; для мелоксикама — 5,7 и для рофекоксиба — 7,2 [25].
2. При назначении НПВП следует учитывать, что применение всех неселективных НПВП ведет к повреждению интерстиция почек.
Известно, что при РА, заболевании, требующем многолетнего непрерывного использования НПВП, по данным патологоанатомических исследований частота интерстициального нефрита достигает 100%. Фермент ЦОГ-2 в интерстиции почек отсутствует, поэтому назначение селективных ЦОГ-2 ингибиторов не влияет на уровень клубочковой фильтрации. Анализ сообщений о побочных реакциях со стороны почек за 10 лет применения нимесулида у 100 000 больных (с 1988 по 1997 гг.) продемонстрировал 11 сообщений, из которых только в 4 случаях проводилась монотерапия нимесулидом [26]. Исходя из этих данных, возможно применение Найза (как и других ингибиторов ЦОГ-2) при ХПН 1–2 степени в неизмененных суточных дозировках, требуемых для подавления воспалительного процесса.
3. Неселективные НПВП во многих случаях оказывают негативное влияние на функцию печени, особенно Диклофенак.
Влияние селективных ингибиторов ЦОГ-2 на печень сопоставимо с плацебо. Говоря о переносимости НПВП со стороны печени, особенно в связи с полемикой, периодически возникающей в печати, следует привести конкретные статистические данные:
- при кратковременном использовании нимесулида повышение уровней аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) отмечается у 0,4% больных, при использовании его более 6 месяцев — у 1,5% больных [27], напомним, что прием Диклофенака вызывает повышение АСТ и АЛТ примерно у каждого пятого больного;
- по сообщению органов здравоохранения Финляндии с 1985 по 2002 гг. во всем мире было зарегистрировано лишь 195 случаев непереносимости нимесулида со стороны печени (www.pharmabiz.com);
- при регистрации нимесулида для использования в детской практике в Индии было проведено исследование его безопасности 600 педиатрами, при этом не было ни одного сообщения о тяжелых гепатотоксических реакциях [28];
- в крупном популяционном исследовании гепатотоксичности нимесулида [29] представлен анализ частоты лекарственного поражения печени у 400 тыс. больных, получавших различные НПВП за период 1997–2001 гг. Было показано, что НПВП в целом повышают риск развития патологии печени, однако частота данной патологии очень низкая (общая частота гепатопатий — 29,8/100 тыс. пациенто-лет, относительный риск 1,4). При этом нимесулид вызывал гепатопатии в 35,3 случая на 100 тыс. пациенто-лет. Это значительно реже, чем Диклофенак — 39,2 и ибупрофен — 44,6. Тяжелое поражение печени (цитолиз, холестатический синдром) при применении НПВП — редкое осложнение (1 случай на 10 тыс. больных);
- в обширной монографии, посвященной применению нимесулида [30], отмечается, что во многих случаях возникновение печеночных реакций, по-видимому, связано с приемом других потенциально гепатотоксичных лекарственных препаратов либо с существовавшими ранее состояниями и предрасположенностью к печеночной недостаточности.
При анализе всех пациентов в Ирландии (стране, исключившей нимесулид из списка разрешенных), которым была проведена трансплантация печени в связи с возникновением острой печеночной недостаточности по неизвестной причине на протяжении предшествующих 13 лет, выяснилось, что из 32 рассмотренных случаев в анамнезе у 6 пациентов было обнаружено упоминание о приеме нимесулида в течение шести месяцев перед трансплантацией. На основании этого было высказано предположение о возможной корреляции между приемом нимесулида и печеночной патологией. Тем не менее, в сводной таблице отдельных случаев пациентов, принимавших нимесулид, упоминается, что эти пациенты в течение 6 предшествующих месяцев помимо нимесулида одновременно получали другие лекарственные препараты, потенциально способные вызвать гепатопатию, в отношении которых корреляция с возникновением печеночной патологии была оценена как вероятная/возможная [16]. Кроме этого, у двух пациентов были отмечены другие возможные причины развития гепатопатии. За исключением данных упомянутого исследования в настоящее время отсутствуют сведения, позволяющие установить четкую причинно-следственную связь между печеночной недостаточностью и приемом нимесулида на протяжении предшествующих 6 месяцев.
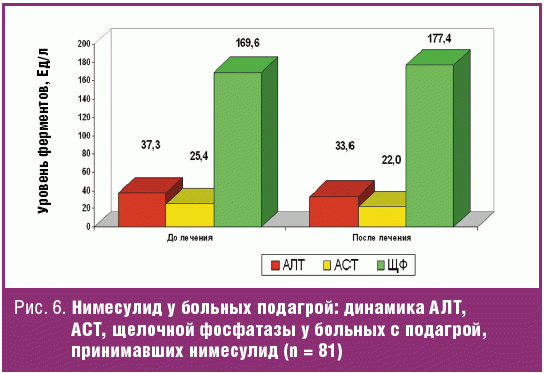
Особый интерес привлекает исследование, проведенное в Институте ревматологии РАМН по переносимости нимесулида у больных подагрой (рис. 6) [31]. Больные подагрой имеют немало факторов риска лекарственного повреждения печени (употребление алкоголя, жировой гепатоз печени, частое развитие желчнокаменной болезни и др.). Тем не менее, как видно из рис. 6, не было зарегистрировано изменения биохимических параметров, отражающих функциональную способность печени.
НПВП-индуцированная гепатопатия носит характер метаболической или иммунологической идиосинкразии. Факторами риска ее развития являются: пожилой возраст, женский пол, патология гепатобилиарной системы, тяжелые сопутствующие заболевания, сочетанный прием препаратов, влияющих на метаболизм НПВП, генетические аномалии, гипоальбуминемия, гепатотоксические реакции в анамнезе.
Таким образом, особенного гепатотоксического влияния на печень для нимесулидов не зарегистрировано. Единичные сообщения о симптомах непереносимости со стороны печени при приеме нимесулида должны настораживать практического врача при необходимости назначения НПВП больным с факторами риска.
4. Лечение неселективными ингибиторами ЦОГ больных, имеющих сопутствующие заболевания бронхов, в первую очередь больных с бронхиальной астмой, может привести к усугублению симптоматики.
Регуляция просвета бронхов осуществляется простагландинами, вырабатываемыми ЦОГ-1, поэтому подавление этой изоформы ЦОГ может привести к бронхоспазму или изменению течения бронхиальной астмы (хорошо известна особая форма астмы — «аспириновая астма»). Селективное ингибирование ЦОГ-2 позволяет избежать данного осложнения. Кроме того, как видно из рис. 4, нимесулид блокирует выделение гистамина из базофильных гранулоцитов и тучных клеток.
5. При лечении больных с дегенеративными поражениями суставов (ОА периферических суставов или позвоночника) следует учитывать, что все неселективные НПВП отрицательно влияют на хрящ [21–23] и утяжеляют течение артроза.
Именно по этой причине в рекомендациях Европейской противоревматической лиги (European League Against Rheumatism, EULAR) имеются указания, что начинать лечение ОА следует с анальгетических средств, а НПВП следует назначать короткими курсами и в низких терапевтических дозах. Однако известно, что у ряда больных ОА заболевание протекает с упорным болевым и воспалительным синдромом, обуславливая почти постоянную потребность в НПВП. Для этой когорты больных препаратами выбора являются селективные ингибиторы ЦОГ-2, которые не имеют отрицательного влияния на хрящ [32], а для Целебрекса показано даже увеличение синтеза активных гликозаминогликанов в экспериментальном исследовании и положительное влияние на течение ОА коленных суставов в 2-летнем плацебо-контролируемом исследовании TRIAL [33].
6. Поскольку ЦОГ-2 участвует в процессе активации остеокластов, селективные ингибиторы ЦОГ-2 предпочтительны и в лечении больных, имеющих остеопороз или факторы риска его развития.
7. Наиболее частыми коморбидными состояниями при заболеваниях суставов являются заболевания КВС, что должно учитывать при лечении больных.
Среди больных, страдающих заболеваниями опорно-двигательного аппарата, АГ регистрируется более чем у 1/3 пациентов. Известно, что неселективные ингибиторы ЦОГ, то есть все классические НПВП, способны повышать артериальное давление (АД) вследствие влияния на простагландины почек и снижать эффективность большинства антигипертензивных препаратов: бета-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента (АПФ), диуретиков (за исключением блокаторов кальциевых каналов) [34, 35]. Отсутствие у селективных ингибиторов ЦОГ-2 подавляющего влияния на агрегацию тромбоцитов заставило внимательно изучить вопросы воздействия этих препаратов на сердечно-сосудистую систему.
Основные выводы, которые можно сделать по данным многочисленных лабораторных и клинических исследований, метаанализа, включившего около 1,5 млн пациентов с патологией суставов:
- хроническое воспаление само по себе является реальным фактором риска развития и прогрессирования повреждения сосудистой стенки с развитием атеросклероза, а степень повышения концентрации С-реактивного белка является столь же весомым фактором прогноза риска развития атеросклероза, как и повышение концентрации холестерина сыворотки;
- подавление воспалительных явлений в суставах приводит к уменьшению риска развития острых коронарных катастроф и острой сердечной смерти;
- увеличение риска развития острого инфаркта миокарда (ОИМ) по данным метаанализа, включившего 1 400 000 пациентов, отмечено для индометацина, Диклофенака, но не для ингибиторов ЦОГ-2 (за исключением рофекоксиба, увеличение суточной дозы которого прямо коррелирует с отрицательным влиянием на сердечно-сосудистую систему, что послужило основанием для снятия этого препарата с производства) [35];
- неселективные ингибиторы ЦОГ, то есть все классические НПВП, способны повышать АД вследствие влияния на простагландины почек и снижают эффективность большинства антигипертензивных препаратов: бета-адреноблокаторов, ингибиторов АПФ, диуретиков (за исключением блокаторов кальциевых каналов) [31, 32];
- ингибиторы ЦОГ-2 не влияют на АД и эффективность лекарственных средств для снижения АД.
Последний тезис подтвержден данными отечественных исследований лечения больных с суставной патологией Найзом при сопутствующей АГ [37, 38]. Как видно из табл. 2, практически у всех больных обеих групп к концу периода «отмывки» отмечалось увеличение среднесуточного АД [38]. Тем не менее, в течение 1-й недели лечения различия в среднем систолическом давлении были достоверно выше при приеме Диклофенака, а на фоне Найза практически не отличались от исходного (p < 0,001). В меньшей степени на фоне Диклофенака в течение 1-й недели лечения увеличилось среднесуточное диастолическое АД — на 3,31 ± 5,42; увеличение этого параметра к концу 1-й недели лечения Найзом не зарегистрировано. У 16 из 20 больных, получавших Диклофенак, отмечено негативное влияние препарата на течение АГ — повышение систолического и/или диастолического давления, сопровождавшееся неприятными субъективными ощущениями — головная боль, кардиалгии (16), развитие гипертонического криза (2 больных — отмена Диклофенака через 6–14 дней приема), увеличение потребности в приеме антигипертензивных препаратов (6 больных). Среди больных, получавших Найз, не отмечено случаев увеличения потребности в антигипертензивной терапии и значимого изменения уровня АД, так что все 20 больных закончили 3-недельный период лечения. Диклофенак был отменен 8 больным в связи с изменением течения АГ: развитие гипертонического криза (2 пациента) и нарастание уровня АД как систолического, так и диастолического (2 больных), что потребовало увеличения дозы эналаприла у обеих больных; у 2 больных в связи с гастралгиями, у 1 больного из-за диареи; у 1 больной из-за головной боли. Увеличение среднесуточного систолического давления у больных, закончивших лечение Диклофенаком, было статистически достоверным и составило 15,74 ± 11,0; к концу лечения Найзом — 1,71 ± 5,22 (р > 0,05).

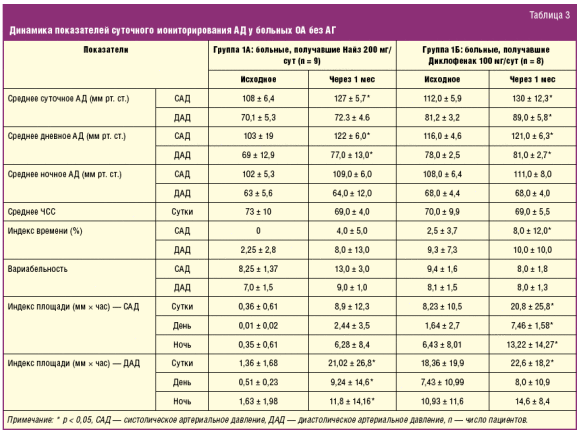
Аналогичные результаты продемонстрированы в исследовании В. И. Мазурова и соавт. [37], сравнивших гемодинамические показатели у больных ОА (n = 40), имеющих (23 пациентов) или не имеющих (17 пациентов) сопутствующую АГ, при назначении Найза или Диклофенака на 1 месяц. Через 1 месяц лечения статистически значимых различий в уменьшении боли по ВАШ на фоне приема Найза или Диклофенака не отмечено (p > 0,05). Данные средних параметров суточного мониторирования АД представлены в табл. 3. При назначении Найза больным ОА без АГ (группа 1А) среднее суточное САД и среднее дневное САД и ДАД повышались в пределах нормальных значений без субъективных ощущений. В группе 1Б, получавшей Диклофенак, отмечено более значимое увеличение систолического и диастолического АД, как среднесуточного, так и среднедневного (p < 0,05), что сопровождалось ухудшением самочувствия больных, а в одном случае потребовалось назначение гипотензивной терапии.
В группе больных с ОА и АГ, получавших Найз (группа 2А) статистически значимого увеличения уровня АД не было зарегистрировано, а при лечении Диклофенаком (группа 2Б) достоверно увеличились уровень среднесуточного САД (p < 0,01), среднедневного САД (p < 0,05), при этом индекс площади САД за сутки увеличился более чем в 2 раза (p < 0,05), а ДАД — почти в 3 раза (p < 0,05), что свидетельствует о стабильности повышения АД в течение суток. Эти изменения АД сопровождались ухудшением самочувствия больных, появлением одышки, отеков нижних конечностей, потребовалась коррекция гипотензивной терапии (увеличение дозы Ренитека или применение комбинированной терапии).
При изучении параметров системной гемодинамики в подгруппах больных, получавших Найз, существенных их изменений выявлено не было. В подгруппе пациентов с исходно нормальным уровнем АД, получавших Диклофенак, отмечалось достоверное (p < 0,05) увеличение общего периферического сопротивления, снижения параметров, отражающих общую производительность сердца (сердечный индекс, ударный индекс) и существенное увеличение объемов внеклеточной жидкости. Еще более значимая отрицательная динамика показателей системной гемодинамики выявлена у больных с АГ, получавших Диклофенак. При сравнительном исследовании влияния Найза и Диклофенака на функцию эндотелия у больных ОА с АГ было установлено, что прием Найза не влиял на показатели эндотелийзависимой (ЭЗВД) и эндотелийнезависимой вазодилатации (ЭНВД), тогда как при лечении Диклофенаком были получены статистически значимые (p < 0,05) изменения ЭЗВД, ЭНВД и количества десквамированных эндотелиоцитов. Эти данные свидетельствуют, что неселективный ингибитор ЦОГ Диклофенак достоверно ухудшал функцию эндотелия, хотя механизмы такого влияния остаются неясными и требуют дальнейшего изучения [37].
Эти данные еще раз подтверждают, что применение селективных ингибиторов ЦОГ-2, к которым относится препарат Найз, положительно влияет на состояние эндотелия сосудов. У больных с риском развития тромбозов эти препараты должны назначаться совместно с низкими дозами Аспирина. Такое сочетание может привести к увеличению частоты осложнений со стороны ЖКТ, поэтому эти больные должны тщательно наблюдаться с эндоскопическим исследованием состояния ЖКТ и мониторингом параметров гемодинамики, проведением профилактических мероприятий.
Отечественными авторами была оценена безопасность применения нимесулида в реальной клинической практике [37] у 322 больных ревматическими заболеваниями, не менее 12 месяцев получавших нимесулид в дозе 200 мг/сутки, с анализом частоты осложнений со стороны ЖКТ, КВС и печени. Всем больным была проведена эзофагогастродуоденоскопия, оценена динамика АД и биохимических показателей крови. Серьезная патология ЖКТ (кровотечение или перфорация язвы) не развилась ни у одного больного. Язвы желудка и 12-перстной кишки обнаружены у 13,3% больных, что значительно реже, чем на Диклофенаке (18,1% у 4931 больного, получавшего неселективные НПВП) [43]. Инфаркт миокарда был зафиксирован у 1 мужчины 68 лет с длительным анамнезом ишемической болезни сердца и АГ. Стойко повышенное АД в период госпитализации отмечено у 11,5%. Не было выявлено ни одного случая развития клинических симптомов поражения печени — желтухи, гепатомегалии, симптомов печеночной недостаточности. В 7 случаях (2,2%) у больных РА, получавших еще и метотрексат и лефлуномид, было зарегистрировано повышение активности печеночных ферментов (АСТ, АЛТ) более чем в 2 раза.
Таким образом, не получено данных о более высокой токсичности нимесулидов по сравнению с другими НПВП. В этой связи Европейское медицинское агентство (European Medicines Agency, EMEA), обеспечивающее контроль над оборотом лекарственных средств в Европе, рассмотрев данные о переносимости нимесулидов со стороны печени, не нашло оснований для его запрещения (пресс-релиз от 21.09.2007), т. к. гепатотоксичность нимесулида не превышает гепатотоксичности других НПВП, широко используемых в странах Европы.
Препарат Найз является эффективным противовоспалительным препаратом. При лечении больных ОА он имеет дополнительные преимущества, так как в спектре своего механизма действия имеет и ингибицию интерлейкина-1-бета [40], ингибицию апоптоза хондроцитов [41], подавление активности металлопротеиназ [42], что подтверждает отсутствие у него отрицательного влияния на суставной хрящ. Таким образом, препарат Найз зарекомендовал себя активным безопасным селективным НПВП, при индивидуальной оценке его эффективности количество больных «ответчиков» достигает 93% в сочетании с хорошей переносимостью.
Литература
- Breivik H., Collett B., Ventafridda V. et al. // Eur. J. Pain. 2005 [epub ahead of print].
- Nuesch E., Dieppe P., Reichembach S. et al. All cause and disease specific mortality in patients with knee or hip osteoarthritis: population based cohort study // BMJ. 2011, 3342: d1165–1173.
- Pincus T., Sokka T. Abstract presented during the American College of Rheumatology 2005 Scientific Sessions. San Diego, California.
- Dougados M., Hawker G., Lohmander S. et al. OARSI/OMERACT criteria of being considered a candidate for total joint replacement in knee/hip osteoarthritis as an endpoint in clinical trials evaluating potential disease modifying osteoarthritic drugs // J. Rheumatol. 2009; 36: 2097–2099.
- Mastbergen S. C., Bijlsma J. W. J., Lafeber F. P. E. G. Synthesis and release of human cartilage matrix proteoglycan are differently regulated by nutric oxide and prostaglandine-E2 // Ann. Rheum. Dis. 2008, v. 67: 52–58.
- Lee Y., Wolfe F., Michaud K. Patterns of pain medication use among rheumatoid arthritis patients from 2000–2010 // Arthr. Rheum. 2011, 63: 159–160.
- Насонов Е. Л., Лазебник Л. Б., Беленков Ю. Н. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М., 2006, 88 с.
- Чичасова Н. В. Лечение остеоартроза: влияние на хрящевую ткань различных противовоспалительных препаратов // РМЖ. 2005, т. 13, № 8, 539–542.
- Каратеев А. Е., Коновалова Н. Н., Литовченко А. А. и др. НПВП-ассоциированное заболевание желудочно-кишечного тракта при ревматизме в России // Клин. мед. 2005, № 5, 33–38.
- Garcia-Nieto B., Perez C., Checa A., Gago F. Molecular model of the interaction between nimesulide and human cyclooxigenase-2 // Rheumatology. 1999; 38 (Suppl.): 14–18.
- Shan A. A., Murray F. E., Fitzgerald D. J. The in vivo assessment of nimesulide cyclooxigenase selectivity // Rheumatology. 1999; 38 (Suppl.): 19–23.
- Raicford K. Current satus of the therapeutic uses and actions of the preferential cyclo-oxigenase-2 NSAID, nimesulide // Inflamopharmacol. 2006, 14: 120–137.
- Bennet A. Nimesulide a well established cyclooxygenase-2 inhibitor with many other pharmacological properties to inflammatory diseases. In: Therapeutic roles of selective COX-2 inhibitors. Ed. Vein J. R., Botting R. M. William Harvey Press, 2001: 524–540.
- Armstrong C. P., Blower A. L. Non-steroidal anti-inflammatory drugs and life threatening complication of peptic ulceration // Gut. 1987, 28: 527–532.
- Singh G., Ramey D. R., Morfield D. et al. Gastrointestinal tract complications on nonsteroidal anti-inflammatory drug treatment in rheumatoid arthritis // Arch. Intern. Med. 1996, 156: 1530–1536.
- Matia C., Ciarcia S., Muhindo A., Colluzi F. Nimesulide. 25 years later // Minerva Med. 2010, 101: 285–293.
- Cullen L., Kelly L., Connor S. O., Fitzgerald D. J. Selective cyclooxygenase-2 inhibition by nimesulide in man/J. Pharmacol. Exp. Ther. 1998, 287: 578–582.
- Suleyman H., Cardici E., Albayrak A., Halici Z. Nimesulide is a selective COX-2 inhibitory, atypical non-steroidal drug // Curr. Med. Chem. 2008, 15: 278–283.
- Каратеев А. Е. Российский опыт применения нимесулида: обзор клинических испытаний // Consilium med. 2011, № 13 (9): 89–95.
- Husskisson E. C. Double-blind randomized, multicenter clinical study to evaluate the efficacy and tolerability of nimesulide vs diclofenac in patients suffering from osteoarthritis // Helsinn. Healthcare. 1997, 36–44.
- Porto A., Almedia H., Cunha M. J., Macciocchi A. Double-blind evaluation by endoscopy the tolerability of nimesulide and diclofenac on gastric mucosa in osteoarhritic patients // Eur. J. Rheum. Inflamm. 1994, 14: 33–38.
- Mele G., Memeo A., Mellesi L., Gatti F. Postmarketing surveillance on nimesulide in the treatment of 8354 patients over 60 years old affected with acute and chronic musculo-sceletal diseases // Arch. Med. Internal. 1992, 44: 213–221.
- Fusetti G., Magni E., Armandola M. C. Tolerability of nimesulide. Epidemiological data // Drugs. 1993, 46 (Suppl. 1): 277–280.
- Conforti A., Leone L., Vidal X. et al. Adverse drug reactions related to use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from northern Italian area // Drug Saf. 2001, 24: 1091–1090.
- Laporte J., Ibanez L., Vidal X. et al. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents // Drug Saf. 2004, 27: 411–420.
- Leone R., Conforti A., Chiotto E. et al. Nimesulide and renal impairment // Eur. J. Clin. Pharmacol. 1999, 55: 151–154.
- Boelsterli A. Mechanisms of NSAID-induced hepatotoxicity // Drug Saf. 2002, 25, 633–648.
- Kulkarni S. Safety of nimesulide // Curr. Sci. 2002, 83, 1442–1443.
- Traversa G., Bianchi C., Da Cas R. et al. Cohort study of hepatotoxicity associated with nimesulide and other non-steroidal anti-inflammatory drugs // BMJ. 2003, 327, 18–22.
- Rainsford K. D. Nimesulide actions and uses. BIRKhAUSER, 2005.
- Каратеев А. Е., Барскова В. Г. Безопасность нимесулида: эмоции или взвешенная оценка // Consilium Med. 2007, № 9: 60–64.
- Mastberger S. C., Lafeber F. P., Bijlsma J. W. Selective COX-2 inhibition prevents proinflammatory cytocin-induced cartilage damage // Rheumat. 2002, 41: 801–808.
- Hajjal H. E. L., Marcelis A., Devogelaer J.-P., Manicourt D.-H. Celecoxib has a positive effect on the overall metabolism of hyaluronan and proteoglycans in human osteoarthritic cartilage // J. Rheum. 2003, 30: 2444–2451.
- Ruoff G. Management of pain in patients with multiple health problems: a guide for the practicing physician // Amer. J. Med. 1998; 105 (1B): 53 S-60 S.
- Johnson A. G., Nguyen T. V., Day R. O. Do nonsteroidal anti-inflammatory drugs affect blood pressure? A meta-analysis // Ann. Int. Med. 1994, 121: 289–300.
- Мареев В. Ю. Опубликовано ООО ОССН по материалам симпозиума конгресса «Человек и лекарство», 2005 год. Адаптировано из: Graham et al. // Lancet. 2005; 365: 475–481.
- Отчет о результатах пилотного исследования по сравнительной оценке влияния найза (нимесулида) и Диклофенака на гемодинамические показатели у больных остеоартрозом в сочетании с эссенциальной артериальной гипертензией (В. И. Мазуров, О. В. Побегай, И. В. Мартынов).
- Чичасова Н. В., Имаметдинова Г. Р., Насонов Е. Л. Возможности применения селективных ингибиторов ЦОГ-2 у больных с заболеваниями суставов и гипертензией // Научно-практ. ревм. 2004, № 2: 37–40.
- Каратеев А. Е., Алексева Л. И., Братыгина Е. А., Аширова Т. Б. Оценка частоты развития побочных эффектов при длительном применении нимесулида в реальной клинической практике // РМЖ. 2009, № 17 (21): 1466–1472.
- Di Batista J. A., Fahmi H., He Y. et. al. Differential regulation of interleukin-1-induced cyclooxigenase-2 gene expression by nimesulide in human synovial fibroblasts // Clin. and Exp. Rheum. 2001, v. 19, № 1 (Suppl. 22), S3-S5.
- Mikherjee P., Rachita C., Aisen P. S., Pasineti G. M. Non-steroidal anti-inflammatory drugs protect against chondrocyte apoptotic death // Clin. and Exp. Rheum. 2001, v. 19, № 1 (Suppl. 22): S7-S11.
- Benett A., Villa G. Nimesulide: an NSAID that preferentially inhibits COX-2, and has various unique pharmacological activities // Exp. Opinion Pharmacother. 2000, 1: 277–286.
- Каратеев А. Е., Насонова В. А. Развитие язв желудка и двенадцатиперстной кишки у больных, принимающих нестероидные противовоспалительные препараты: влияние стандартных факторов риска // Тер. архив. 2008, № 5: 62–66.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru