Содержание статьи
Введение
На протяжении многих десятилетий рентгеноконтрастная флебография (Contrast Venography, CV) являлась «золотым стандартом» в обследовании пациентов с хроническими заболеваниями вен нижних конечностей (Chronic Venous Disorders, CVD) [1]. Особое значение этот метод диагностики приобретал при подозрении на тромбоз глубоких вен (Deep Vein Thrombosis, DVT). Комплексное обследование с использованием дистальных и проксимальных методов введения контраста позволяло исключать тромботическую окклюзию на уровне любого сегмента нижних конечностей и таза (Lower Extremities Deep Vein Thrombosis, LEDVT), а также установить степень выраженности морфологических и функциональных изменений в глубоких венах как у пациентов с посттромботической болезнью (Post-Thrombotic Disease, PTD), так и с первичным варикозным расширением вен нижних конечностей (Varicosity Disease, VD) [1]. В России вплоть до середины 1990-х годов практически всем пациентам с хронической венозной недостаточностью, поступающим в хирургический стационар, перед операцией выполнялось флебографическое обследование, недостатки которого были очевидны: инвазивность, риск развития аллергических реакций на контрастный препарат, лучевая нагрузка на пациента и персонал [2].
Ситуация радикально изменилась с активным и повсеместным внедрением во флебологическую практику методов ультразвукового исследования (duplex Ultrasound, US), которые на сегодня стали основными в диагностике гемодинамических нарушений при первичном обследовании всех пациентов с CVD нижних конечностей [3, 4]. Однако некоторые задачи при использовании US остаются нерешенными. В первую очередь это касается диагностики DVT на уровне вен таза и нижней полой вены, а также глубоких вен голени [5, 6]. Кроме того, US не позволяет получать подробную информацию об особенностях анатомического строения и объемной архитектонике венозных коллекторов нижних конечностей, знание которых, например, для проведения реконструктивных оперативных вмешательств всегда было важной задачей [2, 7].
Вместе с тем в начале 2000-х годов интенсивно стали развиваться и использоваться в клинической практике для диагностики нарушений кровотока методы магнитно-резонансной (МРТ; Magnetic Resonance Imaging, MRI) и компьютерной (КТ; Computed Tomography, CT) томографии [8]. Однако, несмотря на то, что со времени появления первых наиболее значимых научных публикаций об использовании MРТ и КТ во флебологической практике прошло около 30 лет [9–11], многие вопросы диагностической значимости и приоритетов этих методов исследований у пациентов с СVD на сегодняшний день не имеют окончательного решения.
Изначально в наши планы не входило описание физических явлений, лежащих в основе магнитного резонанса, однако по мере накопления информации мы все чаще ловили себя на мысли о необходимости сделать это, пусть даже в самых общих чертах. Это важно хотя бы для понимания тех терминов, которые мы будем активно использовать при описании и обсуждении различных методик проведения MРТ применительно к венозной системе в объеме проведения магнитно-резонансной венографии (Magnetic Resonance Venography).
Вашему вниманию представляется работа, посвященная анализу имеющихся данных о возможностях MРТ-ангиографических исследований в визуализации сосудистого русла нижних конечностей (Magnetic Resonance Angiography, MRA).
Физические основы МРТ
С целью даже самого поверхностного понимания сути явлений, происходящих в тканях живого организма при МРТ, необходимо совершить краткий экскурс в основы квантовой физики, или, иначе, физики элементарных частиц, как бы это страшно и безнадежно ни звучало [12].
Атом водорода, являясь основной элементарной частицей живого организма, находится в постоянном активном движении, характеризующемся свойственным только ему «гиромагнитным отношением», от величины которого зависит ориентация данной частицы в пространстве. Вращаясь, атом водорода генерирует вокруг себя магнитное поле, являясь, по сути, маленьким магнитом, из большого числа таких магнитов и состоит любая ткань человека (рис. 1A).
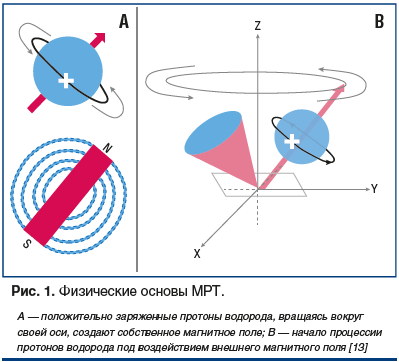
Полюсы атомов водорода в организме не расположены хаотично, а ориентированы таким образом, что все магнитные силы уравновешивают друг друга, в результате чего организм человека в целом находится в магнитном балансе. При помещении человека в магнитное поле томографа с напряженностью 1,5 Тл, которое в 30 000 раз сильнее гравитационного поля Земли, с протонами водорода (есть еще электрон) происходят интересные явления. Во-первых, протоны водорода выстраиваются в участке ткани, подверженном магнитному воздействию, вдоль магнитного поля двумя способами — параллельно и антипараллельно. Кроме того, протоны начинают совершать колебательные движения вокруг своей оси (процессировать) с определенной (Ларморовой) частотой, величина которой прямо пропорциональна напряженности внешнего магнитного поля (рис. 1В). Следовательно, чем выше напряженность воздействующего снаружи магнита, тем большее количество протонов займет параллельную ориентацию, а колебательная частота их будет выше. Количество выстроенных параллельно протонов водорода будет составлять суммарную намагниченность (рис. 2) [14].
![Рис. 2. Разнонаправленность процессии протонов водо- рода (А) с созданием вектора суммарной намагниченности (В) [15] Рис. 2. Разнонаправленность процессии протонов водо- рода (А) с созданием вектора суммарной намагниченности (В) [15]](https://medblog.su/wp-content/uploads/2020/12/1608830854_10_vozmozhnosti-mrt-issledovanij-v-vizualizatsii-sosudistogo-rusla-nizhnih-konechnostej-shajdakov-e-v-sannikov-a-b-emelyanenko-v-m-kryukova-l-n-baranova-a-e-rachkov-m-a.png)
Под воздействием внешнего магнитного поля атом водорода возбуждается, в результате чего изменяется направление основного вектора намагниченности. Однако это состояние длится недолго, атом водорода начинает отдавать полученную энергию в ткани или релаксирует (рис. 3).
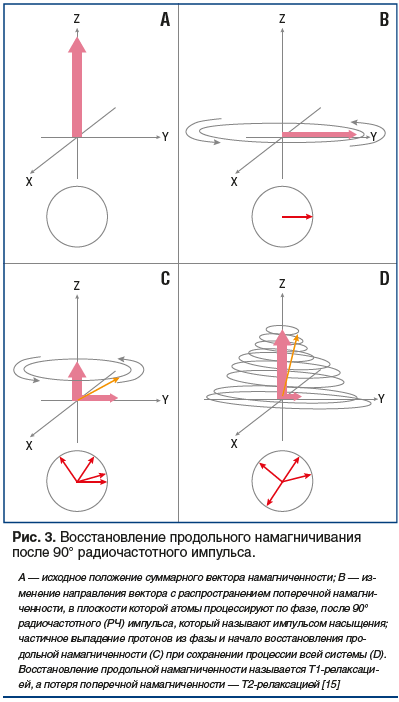
При этом атом водорода совершает обратное движение, которое происходит в двух плоскостях Z и XY. Характеристикой этих вращательных обратных движений с точки зрения физики элементарных частиц является спин [16]. Процесс обратной отдачи энергии (релаксации) происходит в два этапа, которые принято обозначать как Т1 и Т2. Во время Т1-релаксации (спин-решетчатой) возвращение основного вектора намагниченности происходит в плоскости Z и является, по сути, временным критерием, необходимым для достижения 63% продольной намагниченности от первоначального уровня намагниченности. Т2-релаксация (спин-спиновая) идет одновременно с Т1-релаксацией, однако эти вращения происходят в плоскости XY и являются временным критерием, необходимым для достижения протонами 37% от изначального значения смещенных по фазе протонов [12]. Исходя из этого можно считать, что Т2-релаксация представляет собой скорость обратного смещения протонов по фазе (рис. 4А).
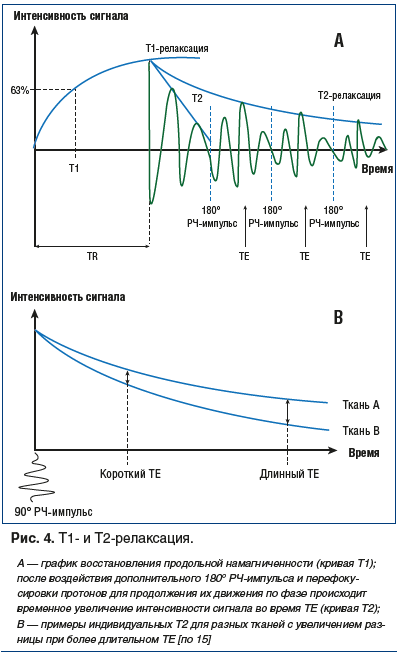
Все дело в том, что в обычных условиях протоны вращаются вокруг своей оси вне фазы, что позволяет им поддерживать стройность своего порядка (можно представить два колеса телеги, вращающихся в разном направлении). Когда происходит изменение вектора намагниченности, протоны внутри молекулы воды в плоскости XY начинают вращаться по фазе, как, например, два колеса телеги при обычном движении. Таким образом, во время Т1-релаксации протоны возвращают себе параллельную ориентацию относительно основного вектора намагниченности в плоскости Z, продолжая еще вращаться по фазе. В течение времени Т2 фазовое вращение протонов вокруг своей оси в плоскости XY прекращается, и элементарная частица (водород) возвращается к своей спокойной жизни. Т2-релаксация по времени протекает гораздо быстрее Т1-релаксации. Исходя из расположения плоскостей, в которых происходит возвращение возбужденных протонов к своему первоначальному состоянию, Т1-релаксация получила название поперечной релаксации, а Т2-релаксация — продольной. Кривые Т1- и Т2-релаксации являются различными для каждой ткани, что и легло в основу разработки принципов магнитно-ядерного резонанса [12]. В результате этих обратных вращательных моментов со стороны протонов во время Т2-релаксации создается магнитное поле, «посылающее» сигнал, получивший название «спин-эхо». Созданное протонами магнитное поле в период Т2-релаксации индуцирует в приемной катушке MРТ-сканера электрический ток, который в итоге трансформируется в изображение [17]. Приемные магнитные катушки устроены по принципу кодирования поступающего сигнала за счет появления собственного магнитного поля и включения двух градиентов, один из которых (фазово-кодирующий градиент) ориентирован в переднезаднем направлении по оси Y, а второй (частотно-кодирующий градиент) — справа налево по оси X [13]. В результате этих кодирований информация поступает на матрицу (k-пространство) или временную область, где в зависимости от заданной программой импульсной последовательности сканирования выстраивается окончательное изображение [12, 18]. Однако прежде, чем перейти к непосредственной характеристике используемых импульсных последовательностей при проведении МРТ, необходимо остановиться на таком понятии, как контраст изображения.
Как было отмечено выше, при релаксации происходят одновременно два процесса — Т1 и Т2. В принципе все изображения сочетают в себе Т1- и Т2-контрасты. Однако в зависимости от установленных параметров той или иной последовательности каждая из релаксаций может сделать основной или второстепенный вклад в получение контраста изображения [19]. Любая ткань человеческого тела имеет свои характеристики релаксации, на чем и построен основной принцип ядерного магнитного резонанса (рис. 4В).
Т1-взвешенное изображение
В данном случае контраст изображения зависит от Т1-релаксации. В результате этого мы получаем сильный сигнал от всех тканей, в которых уже произошла продольная релаксация, время которой зависит от количества протонов, находящихся в данной ткани. Понятно, что быстрее релаксируются ткани с меньшим количеством воды, а вклад в Т1-взвешенное изображение водных структур организма будет незначительным. Именно по этой причине кровь в просвете сосуда будет иметь «черный вид». Изображение, полученное в период Т1-релаксации, получило название Т1-взвешенного изображения.
Т2-взвешенное изображение
В данном случае контраст изображения зависит от Т2-релаксации. По причине того, что все ткани с различной структурой за достаточно длительный период времени подверглись полной Т1-релаксации и только в структурах с повышенным содержанием протонов водорода (воды) еще осталась фазовая когерентность, жидкость (кровь в просвете сосуда) получит «яркий вид». Изображение, полученное в период Т2-релаксации, получило название Т2-взвешенного изображения.
Контраст протонной плотности
Контраст изображения протонной плотности занимает промежуточное положение между Т1- и Т2-взвешенными изображениями. Это происходит по той причине, что в определенный период времени активная Т2-релаксация еще не наступила, а Т1-релаксация уже утратила свои лидирующие позиции.
В результате при анализе в этих трех последовательных изображениях, например, яркость жидкости будет иметь палитру перехода от черной к серой и от серой к яркой.
Таким образом, характер (интенсивность) получаемого сигнала при MРТ будет зависеть от нескольких характеристик: числа протонов водорода на единицу плотности (протонной плотности); времени Т1-релаксации; времени Т2-релаксации; применяемой импульсной последовательности.
Т1- и Т2-взвешенные изображения являются прежде всего изображениями, выведенными на экран, однако прежде чем их собрать, необходимо при сканировании применить определенные последовательности РЧ-импульсов. Познакомимся с основными из этих последовательностей [12, 18, 19].
Последовательность спин-эха (SE)
В основе данной последовательности лежит повторное применение 180° РЧ-импульса через короткий промежуток времени после первого 90° РЧ-импульса, что позволяет добиться сохранения движения спинов по фазе и, как следствие, получения высокого сигнала, что и влияет в итоге на качество изображения. Градусы в данном случае отображают смещение основного вектора намагниченности [20].
Последовательность мульти-эха (SE Т2)
Данная последовательность подразумевает использование трех последовательных импульсов. За первым 90° РЧ-импульсом следует 180° РЧ-импульс, в результате чего получается изображение протонной плотности. После получения данного изображения дается еще один 180° РЧ-импульс с последующим получением Т2-изображения. Исходя из включения в программу исследования двух последовательных 180° РЧ-импульсов данная последовательность имеет и другое название (Double-Echo-Spin Echo, DESE) [20].
Последовательность турбо спин-эха (TSE)
Еще одно название данной последовательности — быстрое спин-эхо (Fast Spin Echo, FSE). В основе этой последовательности лежит принцип подачи после стандартного 90° РЧ-импульса серии, состоящей из 7 последовательных 180° РЧ-импульсов (Echo Train Length, ETL). Основное преимущество заключается в значительном сокращении времени сканирования, например, в сравнении с SE Т2 — в 7 раз. А с учетом того, что в некоторых предложенных последовательностях количество импульсов может доходить до 100 и более, преимущества становятся очевидными [21].
Последовательность быстрого улучшения спин-эха (Fast Advanced Spin Echo, FASE)
Как и в предыдущей последовательности, в данном случае используется большое количество следующих друг за другом 180° РЧ-импульсов (общее количество импульсов равно 212), однако в дополнение к предыдущей последовательности формирование конечного изображения происходит половинным Фурье-преобразованием (Half-Fourier Imaging, HFI), что наряду с ускорением сканирования дает качественное улучшение полученного изображения [21].
Последовательность градиентного эха
(Gradient Echo, GRE)
Данная последовательность отличается от SE-последовательности способом усиления сигнала. Так, если в SE-последовательности используется повторный 180° перефазирующий импульс, то в последовательности GRE используется принцип обращения полярности градиента. Таким образом, на момент считывания сигнала частотно-кодирующий градиент (Gro) меняет полярность с отрицательной на положительную, чем достигается аналогичный эффект усиления, как от повторного импульса при SE, однако процесс этот происходит намного быстрее. Большое значение в данной последовательности имеет выбор угла переворота FA, который может находиться в диапазоне от 1° до 180° [22].
Последовательность восстановления с инверсией (Inversion Recovery, IR)
В данной последовательности изначальное возбуждение инициируется не 90°, а 180° РЧ-импульсом, в результате чего происходит переворот изначальной суммарной намагниченности. В данном случае процесс Т1-релаксации длится вдвое дольше и задается временем инверсии (Inversion Time, TI). В этой последовательности имеется довольно длительное время повторения импульсов и короткое время эха. Основным преимуществом данной последовательности является то, что кривые Т1-релаксации различных тканей изначально значительно разведены друг от друга, что создает большие различия в Т1-взвешенном изображении. С одной стороны, при использовании данной последовательности длительность сканирования увеличивается, однако возможность соединения последовательности с инверсией с последовательностью TSE значительно сокращает время сканирования без потери качества изображения. Изменение времени инверсии может осуществляться двумя путями: использованием последовательности восстановления с инверсией и ослаблением сигнала жидкости (Fluid Attention Inversion Recovery, FLAIR) или включением последовательности восстановления с коротким временем инверсии (Short TI Inversion
Recovery, STIR) [20–23].
В отношении использования различных импульсных последовательностей необходимо отметить, что их основными динамическими параметрами, от изменения которых зависит оптимальный сбор информации при любом MРТ-исследовании, являются [24]: TR (Repetition Time) — время повторения; ТЕ (Echo Time) — время эха; FA (Flip Angle) — угол переворота; TI (Inversion Time) — время инверсии; NA (Number of Acquisitions) — число сбора данных; MX (Matrix) — матрица; FOV (Field Of View) — поле наблюдения; ST (Slice Thickness) — толщина среза; SG (Slice Gap) — зазор между срезами; PE (Phase Encoding) — кодирование фазы; BW (Bandwidth) — полоса пропускания.
Бесконтрастные методы выполнения MР-ангиографии
Использование бесконтрастных методов выполнения MRA основано на потенциальной способности магнитно-резонансного сигнала реагировать на движение. И хотя при обследовании различных отделов организма человека это может привести к появлению различных артефактов, именно изменения MR-сигнала, вызванные потоком крови при использовании определенных импульсных последовательностей, позволяют визуализировать кровеносные сосуды и даже получить количественные данные о потоке крови. Методы бесконтрастной MRA, основанные на эффекте потока крови, можно разделить на две принципиальные группы: методы, основанные на амплитудных эффектах, — время пролета (Time-of-Flight, TOF), и методы, основанные на фазовых эффектах (Phase Contrast, PC) [25]. В первом случае в результате различной продольной намагниченности поступающая в срез кровь и выходящая из него по сравнению со стационарными спинами (спин-эхо — характеристика движения протона) зависит от продолжительности пребывания в срезе (времени пролета). Другими словами, в данных условиях интенсивность сигнала будет зависеть от скорости вытеснения «насыщенных» спинов «ненасыщенными» (T1-взвешенное изображение). Во втором случае в основе лежит разность между поперечной намагниченностью потока крови и стационарными спинами (неподвижные ткани) с точки зрения различия в них фазовых эффектов (Т2-взвешенное изображение). Применение различных импульсных последовательностей в обеих группах может усилить один эффект и подавить другой. Используемые методики MRA в зависимости от интенсивности сигнала, поступающего от крови и окружающих тканей, могут быть подразделены на MRA «яркой крови», во время которой усиленный интенсивный сигнал поступает от потока крови, а фоновый сигнал с окружающих тканей подавляется (T1-взвешенное изображение), или MRA «черной крови» (Т2-взвешенное изображение), когда гиперинтенсивный сигнал, наоборот, поступает с окружающих сосуд тканей [21, 23].
Понятие «пустота потока» имеет несколько иной физический смысл и в первую очередь обусловлено потерей сигнала, связанного с оттоком. О данном MРТ-феномене речь идет, когда с целью ангиографического исследования используется импульсная последовательность спин-эха. Как было отмечено выше, сигнал могут обеспечить только те спины, которые попали под двойное последовательное воздействие 90° РЧ-импульса и 180° РЧ-импульса. В условиях интенсивного потока крови атомы водорода не успевают попасть под воздействие обоих импульсов и не дают ответный спин-эховый сигнал. Кроме того, может наступать эффект размыва, который удается устранить путем использования в этих случаях дополнительно импульсной последовательности градиентного эха [26]. Однако и в этом случае в условиях Т2-взвешенного изображения будет наблюдаться «пустота потока», отсутствие которой может быть рассмотрено в качестве признака выраженного замедления кровотока или полной окклюзии (тромбоза) сосуда. Возникновение феномена «яркой крови» может быть следствием изменения параметров последовательности SE или GRE путем увеличения количества повторных 180° РЧ-импульсов, длительность периода которых регулируется временем повторения TR и удлинением времени Т1-релаксации. В результате протекающая кровь даст сначала значительно более высокой интенсивности сигнал по сравнению с интенсивностью уже насыщенных спинов в неподвижной ткани. Этот МRI-феномен получил название эффекта усиления притока [25, 26].
Время-пролетная МР-ангиография (Time-of-Flight, TOF)
Механизм контрастирования сосудистой системы при использовании TOF MRA основан на эффекте притока (рис. 5).
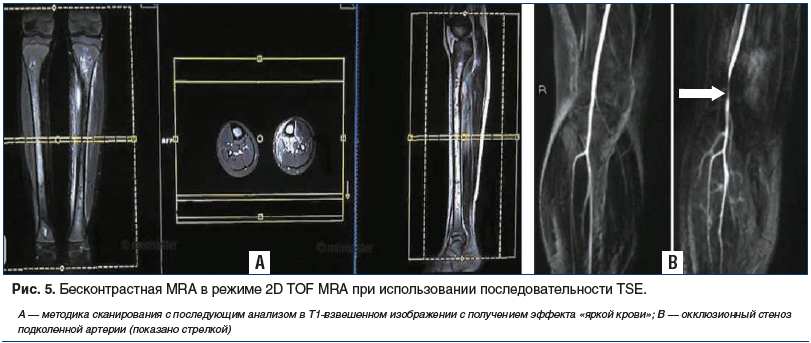
Однако, чтобы получить эффект «яркой крови», во время этого исследования необходимо использовать уже известную импульсную последовательность GRE [26–28], во время которой применяются незначительные по протяженности TR<40 мс и TE<5 мс. В принципе, возможно использование и последовательности SE (SE, SET2 и TSE). Однако, как показала практика, при использовании последовательности SE все же присутствует эффект «вымывания», избежать которого при GRE удается за счет быстрого перефазирования в поперечной намагниченности, но не за счет использования одного или нескольких дополнительных следующих друг за другом 180° РЧ-импульсов. Это происходит по причине гораздо более быстрого изменения полярности градиента [26]. Кроме того, использование при проведении TOF MRA последовательности GRE с использованием матрицы 256×512 (MXPE=256) позволяет осуществлять сканирование в режиме мультисрезов. Данный режим позволяет сохранить фазовую когерентность во время исследования и за счет повторного импульса достигнуть своевременного перефазирования спинов, что в итоге приводит к восстановлению движения спинов по фазе с получением высокого сигнала и четкого изображения «яркой крови». Для достижения оптимального отношения сигнал/шум толщина среза должна быть
не менее 2–3 мм [29].
Использование последовательности GRE позволяет выстраивать 2D- и 3D-модели изображения кровеносного русла нижних конечностей. Основным условием использования двухмерного построения изображения остается строгое соблюдение перпендикулярной направленности плоскости изображения к сканирующему сосуду.
Некоторыми авторами настоятельно рекомендуется при проведении 2D TOF MRA в последовательности GRE 2D (multi-slice) дополнительно использовать ЭКГ-триггерные последовательности. По мнению авторов, синхронизация сбора данных с сердечным циклом позволяет добиться большей интенсивности изображения, что, безусловно, требует дополнительного времени [30].
При 3D TOF MRA происходит возбуждение протонов во всем выбранном объеме среза толщиной 30–60 мм, а уже затем эта «плита перекрытия» разделяется на тонкие срезы дополнительным градиентом фазового кодирования вдоль направления выбора среза. Этот метод позволяет получать срезы толщиной менее 1 мм [31].
Недостатком 3D-метода является постоянное повторное воздействие РЧ-импульса на движущуюся кровь на протяжении сканирующего объема конечности (вокселя) без участия в этом перефазирования, в результате чего интенсивность сигнала закономерно прогрессивно уменьшается. Понятно, что в этом случае на качество получаемого изображения будет влиять скорость кровотока. Так, в артериях с большими скоростными показателями протоны крови в меньшей степени будут подвержены повторному воздействию РЧ-импульса на протяжении одной «плиты перекрытия», в то время как для вен с медленным кровотоком повторное воздействие РЧ-импульса на протяжении одной «плиты перекрытия» приведет к угасанию сигнала. Исходя из этого уменьшение насыщенности в данной ситуации может быть достигнуто за счет увеличения TR. Однако G.L. Parker et al. [31] предложили решать эту задачу иначе, а именно путем разделения общего 3D-сканирования на несколько меньших по габаритам «плит» с перекрытием их на 20–30%, чтобы компенсировать процесс затухания сигнала на периферии этих «плит». Данный метод получил название множественного перекрытия «тонких плит» (Multiple Overlapping Thin Slab Acquisition, MOTSA) и стал, по сути, гибридом 2D TOF и 3D ТОF MRА [29].
Не будем забывать, что при проведении TOF MRI как в формате 2D, так и в формате 3D чрезвычайно важным является определение оптимального угла поворота сканирования для последовательности GRE, который может значительно влиять на контрастность сосудистого фона. Дело в том, что большие углы переворота градиента не только генерируют высокий сигнал на стороне входа крови, но и провоцируют быстрое снижение сигнала по ходу сосуда из-за насыщения [32]. При этом небольшие углы переворота градиента создают не только меньший контраст между сосудами и фоном, но и меньшую насыщенность. Исходя из этого при 2D ТОF MRA обычно используют углы поворота в диапазоне 30–70°, в то время как при 3D ТОF MRA используются более низкие углы 15–20° для улучшения насыщенности [29].
Фазово-контрастная МР-ангиография
Отличием данного метода бесконтрастной MRA является использование для визуализации кровеносных сосудов фазового эффекта поперечной намагниченности, который максимально подавлялся при ТОF MRA.
Существует два способа получения изображения кровотока.
Первый получил название метода магнитудного контраста (Magnitude Contrast method, MC), в основе которого лежит анализ набора данных и который состоит из рефазирования и дефазирования спинов в поперечном намагничивании [33]. Первое измерение осуществляется с помощью GRE-последовательности с получением от текущей крови сигнала высокой интенсивности. Второе измерение направлено на непосредственную регистрацию скорости фазовых сдвигов движущихся спинов. Поскольку неподвижная кровь выглядит одинаково в обоих случаях, вычитание одного набора данных из другого приводит к тому, что сигнал неподвижной ткани вычитается, оставляя видимой только движущуюся кровь. Несмотря на то что данный метод не имеет сегодня широкого применения, его можно считать применимым для визуализации периферических сосудов, особенно в условиях медленного венозного кровотока. Недостатком данного метода является отсутствие информации о направлении и скорости потока крови.
Второй метод получил название непосредственного фазово-контрастного контрастирования (Phase Contrast Method, PC), в основе которого лежит получение также двух наборов данных, различающихся по фазе движущихся спинов, но в условиях непосредственного кодирования скорости кровотока [34, 35]. В связи с этим производители МР-сканеров сегодня представляют набор последовательностей, непосредственно адаптированных к различным скоростям кровотока. При проведении данного исследования важно заранее оценить максимальную скорость потока, ожидаемую в сосуде, чтобы выбрать оптимальную последовательность проведения РС.
Контрастные методы выполнения МР-ангиографии
Общепризнано, что основным недостатком всех бесконтрастных методик проведения MRA (TOF и PC) является лежащий в основе визуализации эффект потока для генерации сосудистого сигнала. Несмотря на многочисленные программные разработки, используемые при ТОF и РС, специалистам так и не удалось исключить появление множественных артефактов, связанных с потерей сигнала от спинового насыщения движущегося потока крови. В итоге при анализе данных в некоторых случаях это приводило к гипердиагностике не только возможных стенозов, но и даже полной окклюзии сосудов [26, 36, 37].
Первые наиболее значимые работы с анализом результатов использования нового метода контрастной МRA появились в конце 1990-х годов, и с этого времени процесс внедрения нового метода диагностики в клиническую практику было уже не остановить. По этой причине контрастно-усиленная МР-ангиография (Contrast-Enhanced MRA, CE MRA) начиная с середины 2000-х годов, несмотря на имеющиеся недостатки методики проведения исследования и не решенные до конца технические задачи, начала постепенно занимать определенную позицию среди методов диагностики сосудистых патологий [38–40]. Среди основных недостатков уже ставшей лидером КТ-ангиографии отмечалось наличие возможного нефротоксического эффекта йодированных контрастных веществ, с повышенной вероятностью развития этого осложнения в группе пациентов с сахарным диабетом, частота которого в качестве сопутствующего заболевания у пациентов с сосудистой патологией высока. Безусловно, приходилось учитывать и лучевую нагрузку на пациента, неминуемо сопровождающую любое КТ-исследование [18, 25, 41, 42].
Понятно, что речь в данном случае идет о введении определенного количества контрастного вещества в сосудистую систему путем пункции кубитальной вены, однако прежде чем сделать акцент на основных технических деталях и принципиально важных моментах непосредственно проведения СЕ МRA, необходимо коротко остановиться на самих контрастных веществах, используемых при проведении CE МRI.
Контрастные вещества для МRA делятся на две группы.
Первая группа объединяет препараты на основе гадолиния (Gd), который с химической точки зрения является редкоземельным металлом, входящим в специальную, 17-ю группу таблицы Менделеева. Как и все вещества этой группы, гадолиний относится к парамагнетикам, т. е. веществам, которые намагничиваются во внешнем магнитном поле в направлении внешнего магнитного поля, чем и было обусловлено его использование в качестве контрастного усилителя при проведении MРТ. Препараты на основе гадолиния подразделяются по своей способности вступать в связь с белками крови. Взаимодействие с белками крови может быть сильным или слабым [43].
Препараты второй группы в своей основе содержат частицы оксида железа, который по своей природе является суперпарамагнитным. Препараты этой группы подразделяются по размеру используемых частиц оксида железа и их специфическому покрытию [44].
Эффект гадолиниевых препаратов заключается в их способности вызывать ускоренную Т1-релаксацию при удлинении Т2-релаксации, что и позволяет добиться значительного повышения визуализации сосудистого русла, в котором находится гадолиний [45]. В чем заключаются отрицательные стороны использования контрастных гадолиниевых препаратов, не обладающих способностью к взаимодействию с белками крови? Было установлено, что препараты этой группы в результате так называемого эффекта трансметаллизации способны высвобождать свободные ионы гадолиния [46]. Так как свободный гадолиний токсичен и не так легко выводится из организма, а потенциал его высвобождения из менее стабильных соединений, не связанных с белками крови, может быть очень велик, это стало причиной для беспокойства. Обоснованность беспокойства была доказана длительным присутствием гадолиния в костных структурах и недостаточно быстрым выведением его через почки [47]. Снизить токсическое влияние на организм контрастов гадолиниевой группы, не имеющих связи с белками крови, попытались уменьшением концентрации агента, однако существенно снизить ее, обеспечив хорошее качество визуализации, не удалось [48].
Инновационным решением стала разработка гадолиниевых контрастных препаратов, имеющих слабую связь с белками крови, и в частности с альбумином [49–51]. Основной задачей, которую пытались решить разработчики, было снижение вероятности освобождения ионов гадолиния. Данные препараты являлись представителями второй линии разработки. Кроме того, проведенные исследования показали, что при использовании новых препаратов достигнуть хорошей визуализации удавалось при значительно меньшей концентрации гадолиния в препарате. Это делало использование новых контрастных препаратов на основе гадолиния перспективным даже у пациентов с заболеваниями почек. С физической точки зрения это объяснялось еще более высокой, чем при использовании препаратов первой линии, Т1-релаксацией [52]. Еще одним преимуществом использования препаратов этой группы стала хорошая визуализация периферической сосудистой сети на достаточно большом поле сканирования [53, 54].
Гадолиниевые препараты, образующие сильную и стабильную ковалентную связь с белками крови, получили название веществ «пула крови» из-за гораздо более длительного периода нахождения их в крови и сильной связи с альбумином, доходящей до 88–96% [55]. Следствием этого стал еще более сильный эффект Т1-релаксации, превышающий в 6–10 раз аналогичное значение при использовании препаратов первой линии [56].
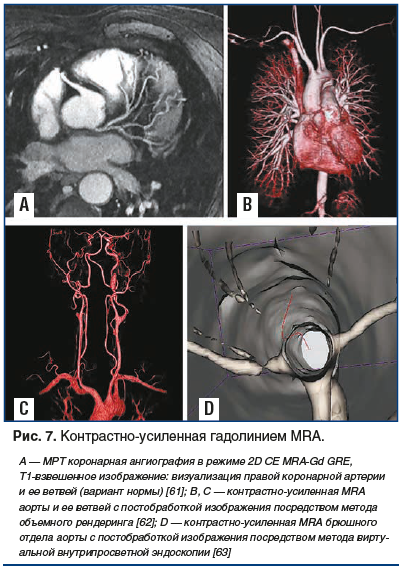
Использование препаратов третьей линии в диагностической практике показало высокий потенциал визуализации не только артерий подвздошно-бедренного и дистальных сегментов (рис. 6) [55], но и коронарных артерий, что дало толчок развитию целого направления в МРТ-диагностике — коронарной МRA (рис. 7А, 7B) [57, 58].

Одним из типичных представителей этой группы препаратов является гадоколуксусная кислота [64, 65].
Вторая основная группа активно разрабатываемых сегодня контрастных веществ, возможность использования которых при MRA вызывает все меньше сомнений, это препараты, содержащие в своем составе в качестве суперпарамагнитного агента ультрамалые частицы оксида железа (Ultra-Small Particles of Iron Oxide, USPIO) [66–68]. Преимуществом препаратов этой группы, по мнению разработчиков, является длительный период внутрисосудистого полураспада с минимальным выходом препарата в интерстициальное пространство [69–71].
Технические особенности проведения контрастно-усиленной МР-ангиографии
Из представленного выше описания понятно, что визуализация любого сосудистого русла при MRA основана на наличии контрастного вещества определенной концентрации в просвете сосуда во время получения изображения. Отмечено было и то, что внедрение MRA в диагностическую практику потребовало разработки контрастных препаратов нового поколения, основным преимуществом которых стало замедление их выхода в интерстициальное пространство. Такими препаратами стали контрастные вещества на основе гадолиния [41, 42]. В идеале МRA-визуализация необходимого отдела сосудистой системы должна выполняться на пике контрастного усиления, когда перекрывающиеся структуры и окружающие ткани слабо визуализируются [72]. То есть сканирование определенного артериального русла должно быть синхронизировано с определенным периодом таким образом, чтобы концентрация гадолиния в этот промежуток времени в конкретной артерии была максимальна, но без контрастного усиления со стороны вен или мягких тканей [73]. Особую роль играет задержка дыхания (иногда до 25 с) при исследовании сосудистого русла грудной или брюшной полости [74].
При исследовании как центрального, так и периферического сосудистого русла любые движения пациента между до- и постконтрастными наборами данных могут привести к пространственной дезориентации сигнала, что неминуемо и значительно ухудшит качество вычитания изображения [75]. Постановка катетера при стандартной MRA осуществляется путем пункции правой кубитальной вены. При размере иглы не менее G22 скорость болюсной инфузии контраста должна быть не менее 2 мл/с [76]. Для большинства исследований (за исключением исследования головы и шеи) пациент помещается ногами вперед, в направлении магнита. В последние годы все больше производителей предлагают специально разработанные для проведения исследования в различных сегментах тела катушки, фазированные антенной решеткой, для более четкого центрирования катушки вокруг интересующей области. Кроме того, появление новых сканеров с увеличенным количеством приемных каналов и одновременным использованием нескольких катушек позволяет охватить сразу все тело пациента без его перемещения (см. рис. 7А) [26].
Как было отмечено выше, синхронизация момента сканирования с пиковой концентрацией нахождения контраста в исследуемом сегменте имеет первостепенное значение [72]. До появления МRA-совместимых инжекторов и быстрых методов визуализации оценка времени поступления контраста в необходимый сосудистый сегмент была исключительно эмпирической. Учитывая, например, что для каротидных артерий время достижения максимальной контрастности может составлять всего 5 с, а для брюшной аорты достигать 60 с, понимаем, с какими техническими сложностями сталкивались специалисты на первых этапах проведения исследований [77]. Появившееся со временем новое программное обеспечение позволило устанавливать определенные для разных сосудистых бассейнов фиксированные временные задержки сканирования, что значительно упростило исследование, но не позволило избежать технических погрешностей, так как эти физиологические параметры могли различаться у отдельных пациентов. К тому же проведение исследования продолжало требовать больших доз контрастного вещества.
Ситуация изменилась с началом использования во вре-
мя проведения CE MRA методов синхронизации. На сегодняшний день используются три основных методики синхронизации. Первая методика основана на проведении тестового болюсного сканирования и заключается во введении 1–2 мл контрастного вещества, разведенного в 30–60 мл физиологического раствора, с проведением пробного сканирования и определением конкретного времени поступления контраста в интересующую анатомическую область. Тестовая болюсная визуализация должна выполняться с использованием быстрой 2D Т1-взвешенной импульсной последовательности в режиме GRE [77]. При этом параметры визуализации (TR, TE, поле зрения, матрица и т. д.) должны быть скорректированы таким образом, чтобы получать временное разрешение примерно одного изображения каждые 1–2 с. Получение кадра с максимальным артериальным усилением будет соответствовать оптимальному времени сканирования [77, 78]. Вторая методика основана на принципе синхронизации MRA в реальном времени и связана с инновационными разработками в этом направлении. Одна из таких разработок принадлежит компании General Electric Medical System (США), в которой мониторинг поступления контрастного болюса и инициирование сбора данных с необходимой части тела автоматизированы и интегрированы в единую импульсную последовательность, в основе которой лежит принцип быстрого спинового эха с высоким временным разрешением (до 400 мс), в результате чего система сама информирует оператора, в какой момент следует начать сканирование после введения контраста [79]. Третья методика синхронизации СЕ MRA в реальном времени осуществляется с использованием флюороскопического триггера (Philips Medical Systems, Нидерланды) [80]. Метод МР-флюороскопии в реальном времени также объединяет фазу мониторинга и фазу визуализации в единую последовательность импульсов. Однако при использовании МР-флюороскопической методики контроль осуществляется оператором визуально с использованием непрерывной быстрой 2D-последовательности эхо-импульсов в режиме GRE, центрированной над сосудистым руслом. Оператор может видеть прибытие контрастного болюса и вручную инициировать начало фазы визуализации. Все эти три методики позволяют получать надежные и информативные данные [25].
Что касается непосредственного проведения CE MRA нижних конечностей, то необходимо отметить, что на сегодня данный метод окончательно вытеснил все ранее используемые методы бесконтрастного сканирования (TOF и РС), которые не смогли оказать существенного влияния на клиническую практику. Выше мы уже касались общих преимуществ CE MRA нижних конечностей. Здесь мы попытаемся сформулировать их более конкретно.
Данный метод не зависит от «потока», так как основывается на парамагнитном контрастном веществе, генерирующем внутрисосудистый сигнал с укорочением времени Т1-релаксации [81].
Использование самого непродолжительного времени повторения TR (5 мс) позволяет осуществлять сканирование в максимально быстром режиме.
Уникальная природа используемой в этих исследованиях матрицы (ķ-пространства) позволяет добиться получения периферических ангиограмм высшего качества по причине выстраивания оптимального соотношения сигнал/шум [81, 82].
Оптимизированная плоскость сбора информации в 3D-режиме обеспечивает наибольший анатомический охват при любой комбинации параметров: поля зрения, количества срезов и их толщины [52].
Не требуется запуск ЭКГ [52].
Технологии подвижного стола позволяют охватить при сканировании всю соответствующую анатомическую область или даже все тело [83].
Имеет ли метод CE MRA нижних конечностей недостатки? Безусловно. Основным недостатком является появление венозного усиления во время третьего сканирования даже при использовании нескольких инъекций [52, 84]. Однако этот недостаток, как мы покажем впоследствии, может с определенной пользой использоваться при проведении контрастно-усиленной МР-венографии [52, 85].
Заключение
В качестве заключения к проведенному нами анализу хотелось бы еще раз остановиться на тех задачах, которые мы преследовали.
На начальном этапе, имея уже накопленный опыт в проведении КТ-венографии [86], мы обратились к нашим специалистам по МРТ лишь с одним вопросом: почему MRA не используется сегодня активно в России не только в диагностике патологии артериального русла, но и в диагностике венозных нарушений? Ведь отсутствие лучевой нагрузки на пациента во время исследования делает этот метод визуализации венозной системы гораздо более привлекательным. Не получив удовлетворительного ответа, мы обратились к литературным источникам. И каково же было наше удивление, когда обнаружилось, что в мире такие исследования сегодня не только активно проводятся, но и вызывают гораздо больший интерес, чем КТ-ангиография. С чем связано повышенное внимание к MRA? В первую очередь с неудержимым прогрессом научной мысли и техническим совершенствованием сканирующих систем (уже проходит клиническая апробация MРТ-сканеров с магнитным полем до 10 Тл) и нового программного обеспечения. Сегодня рассматривается перспективность MRA центрального и периферического сосудистого русла на основе инновационных технологий. В первую очередь это относится к разработке новых методов постобработки изображения, которые значительно облегчают независимую друг от друга визуализацию артериальных и венозных структур от передачи изображения до автоматической количественной оценки морфологического повреждения сосудистых коллекторов различных структур (от коронарных артерий до сосудистой плантарной сети). Наиболее перспективны для использования в клинической практике следующие методы постобработки MRA-изображений: мультипланарное переформатирование (multiplantar reformatting, MPR); проекции максимальной интенсивности (maximum intensity projection, MIP); субволюмная максимальная интенсивность; поверхностный рендеринг (surface rendering, SR); объемный рендеринг (volume rendering, VR) (рис. 7B, 7C) и виртуальная внутрипросветная эндоскопия (virtual intraluminal endoscopy, VIE) (рис. 7D). Дальнейшая разработка этих методик позволит в 3D-режиме изображать артериальную и венозную систему в разном цвете и даже визуализировать внутрипросветные структуры, такие как венозные клапаны или атеросклеротические бляшки [62, 87–90]. Не вдаваясь в подробности, можно заключить, что в основе всех этих методов визуализации сосудистой системы лежит создание нового программного обеспечения считывания MРТ-сигналов, их постобработки и построения на этой основе качественно нового и даже цветного
3D-изображения.
Желание находиться со специалистами МРТ-диагностики в одном информационном поле, полностью понимать друг друга и общаться на одном языке заставило нас углубить свои познания в области физических явлений, происходящих при МРТ. Понимание в данном случае основ физики является столь же необходимым, как для хирурга знание анатомии.
Представленная вашему вниманию лекция посвящена общему анализу методов MRA и должна стать информационным базисом при дальнейшем анализе и оценке возможностей этого метода визуализации применительно к венозной системе. В последующих публикациях мы обсудим особенности MР- и КТ-венографии, попытаемся выработать определенные рекомендации по использованию этих методов в клинической практике.
Учитывая, что в отечественной литературе информация о возможностях использования как MРТ, так и КТ-исследований в изучении венозной патологии отсутствует или в лучшем случае носит характер краткого упоминания, полагаем, что данный материал актуален и вызовет определенный интерес со стороны различных специалистов.
.
Информация с rmj.ru





