Введение
В настоящее время многие исследователи сосредоточены на изучении синдрома обструктивного апноэ/гипопноэ сна (СОАГС) и его связи с различными заболеваниями. СОАГС представляет собой широко распространенную патологию, которая выявляется у 24% мужчин и 9% женщин в возрасте от 30 до 60 лет и более чем у 60% лиц старше 60 лет [1, 2].
Особый интерес представляет взаимосвязь СОАГС с риском развития онкологических заболеваний. Согласно данным последних эпидемиологических исследований, проведенных среди людей, и экспериментальных исследований на животных, при наличии СОАГС повышается риск развития рака пищевода, колоректального рака, рака легких, почек, молочной железы, меланомы [3–6].
Точные механизмы реализации такого эффекта хронической интермиттирующей гипоксии при СОАГС в настоящее время находятся на стадии изучения. Однако считается, что в основе таких механизмов может лежать активация процессов эпителиально-мезенхимальной трансформации (ЭМТ) [7, 8]. ЭМТ представляет собой переход от эпителиального фенотипа клеток к мезенхимальноподобному. При этом клетки теряют свою форму, апикобазальную ориентированность, разрушаются межклеточные контакты, происходит перестройка цитоскелета, нарушается экспрессия генов, сигнальных молекул, белков, факторов транскрипции и функционирование цепей сигнальных каскадов. В результате клетки становятся более подвижными, способными разрушать базальную мембрану и проникать через нее, противостоять апоптозу [9].
Ключевым звеном в процессах ЭМТ считается потеря клеткой функционирующего Е-кадгерина — трансмембранного белка, ответственного за формирование плотных запирательных контактов между клетками. Снижение экспрессии и ускоренная деградация Е-кадгерина приводят к потере связей между клетками и нарушению их апикобазальной ориентированности [10]. На основании вышесказанного актуальным представляется изучение влияния СОАГС на экспрессию Е-кадгерина в эпителии пищевода.
Цель исследования: оценить влияние СОАГС на экспрессию Е-кадгерина и гистоархитектонику эпителия нижней трети пищевода.
Материал и методы
На базе УЗ «ГКБ № 2 г. Гродно» проведено одномоментное кросс-секционное сравнительное исследование, в которое было включено 108 человек, медиана возраста обследованных составила 49 (43,5; 54) лет. Все пациенты дали письменное согласие на участие в исследовании. Протокол исследования был одобрен этическим комитетом учреждения.
Критерии включения в исследование: возраст от 30 до 60 лет, жалобы на храп и/или остановки дыхания во сне, наличие клинических маркеров СОАГС (абдоминальное ожирение, окружность шеи более 43 см у мужчин и более 37 см у женщин, микро- и/или ретрогнатия), письменное информированное согласие на участие в исследовании.
Критерии невключения: хроническая ишемическая болезнь сердца выше II функционального класса стенокардии; недостаточность кровообращения выше IIА; язва желудка и/или двенадцатиперстной кишки; медикаментозное поражение желудка и двенадцатиперстной кишки; пищевод Баррретта; аденокарцинома пищевода; хронические декомпенсированные заболевания печени, почек, легких; ЛОР-патология, требующая хирургической коррекции; прием препаратов, влияющих на тонус нижнего пищеводного сфинктера и функцию дыхания во сне [10].
Отбор пациентов с СОАГС был основан на анализе жалоб на храп, остановки дыхания во сне, дневную сонливость. Также использовали опросник Эпворта для оценки степени выраженности дневной сонливости [11]. Отобранным пациентам выполнено сомнологическое исследование с помощью аппарата SOMNOcheck micro (Weinmann); рассчитывались следующие параметры: количество и длительность эпизодов апноэ и гипопноэ, индекс апноэ/гипопноэ (ИАГ), индекс десатурации (ИД), средняя сатурация (СС) кислорода, минимальная сатурация (МС), индекс автономной активации (ИАА), а также ИАА, связанной с респираторными событиями, средняя продолжительность апноэ, максимальная продолжительность апноэ [10].
Степень тяжести СОАГС устанавливали по значению ИАГ: легкая степень тяжести СОАГС — при ИАГ, равном или более 5 в час и менее 15 в час, средняя степень — равном или более 15 в час и менее 30 в час, тяжелая степень — равном или более 30 в час [12]. Пациентов с тяжелой степенью СОАГС из исследования исключали по причине выявленной в процессе детального обследования сопутствующей патологии, относящейся к критериям невключения.
Пациенты были разделены на 3 группы. Первую группу (n=49) составили пациенты с СОАГС легкой степени тяжести, 2-ю группу (n=29) — пациенты с СОАГС средней степени тяжести, 3-ю группу (группа сравнения, n=30) — пациенты без СОАГС. Группы были сопоставимы по возрасту и полу пациентов.
Всем пациентам была выполнена эзофагогастродуоденоскопия с визуальной оценкой состояния слизистой оболочки. Далее выполняли биопсию слизистой пищевода на 3 см выше Z-линии, при наличии измененной слизистой оболочки — из этой области.
Биопсийный материал использовали для изготовления микропрепаратов слизистой оболочки пищевода с окраской гематоксилином и эозином для последующей морфологической оценки изменений в эпителии. Подготовку гистологических срезов проводили по стандартной методике, после чего срезы подвергали световой микроскопии. Затем выполняли морфометрическое исследование с помощью компьютерного анализатора изображения при разных увеличениях микроскопа Axioscop 2 plus (Carl Zeiss, Германия) и цифровой видеокамеры Leica DFC 320 (Германия), используя программу Image Warp (Bit Flow, США). Измеряли толщину эпителия, длину соединительнотканных сосочков, межъядерные расстояния в различных слоях эпителия.
Экспрессию Е-кадгерина оценивали по результатам иммуногистохимического окрашивания препаратов эпителия пищевода моноклональными антителами к Е-кадгерину (Novus Biologicals, США). Для количественной оценки результатов окрашивания были сделаны фотографии микропрепаратов в максимально возможном количестве неперекрывающихся полей зрения с использованием объектива ×10 с разрешением 1600×1200 пикселей при помощи микроскопа Leica и цифровой камеры Leica 425 C. Оценку экспрессии Е-кадгерина проводили с помощью компьютерной программы для обработки цифровых изображений Aperio Image Scope v9.1.19.1567 с вычислением позитивности
(в интерфейсе программы positivity), определяемой программой по стандартному алгоритму подсчета позитивных пикселей Positive Pixel Count v9. Показатель позитивности представляет собой отношение числа позитивно окрашенных пикселей к общему числу пикселей на участках, подлежащих оценке [13]. Иммуногистохимический анализ был выполнен у 58 пациентов, из них 26, 15 и 17 из 1-й, 2-й и 3-й группы соответственно.
Данные обрабатывали непараметрическими методами пакета прикладных программ Statistica 10.0 для Windows. Сравнение между тремя группами осуществляли с помощью критерия Краскела — Уоллиса с апостериорным сравнением по методу Данна — Бонферрони. Оценку корреляционных связей проводили с применением коэффициента корреляции Спирмена (r). Различия признавали статистически значимыми при р<0,05. Данные приведены в виде медианы, 25-го и 75-го квартилей [10].
Результаты
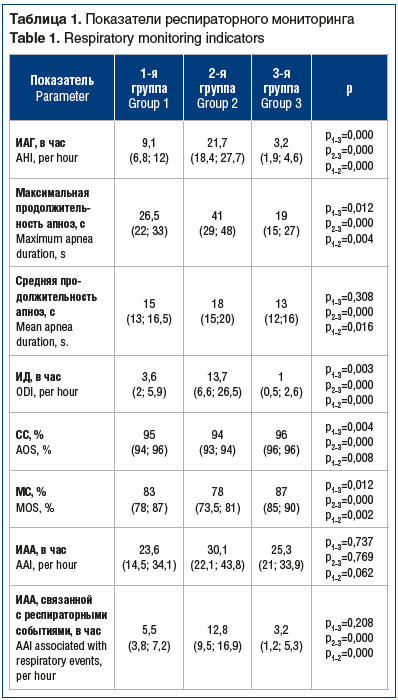
В таблице 1 представлены показатели респираторного мониторинга, демонстрирующие различия между группами.
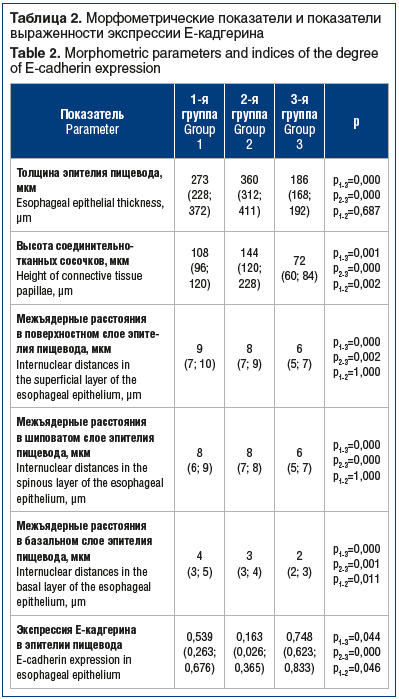
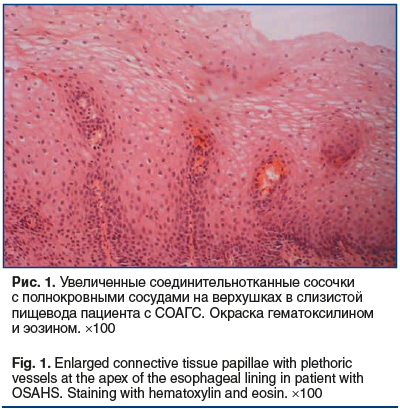
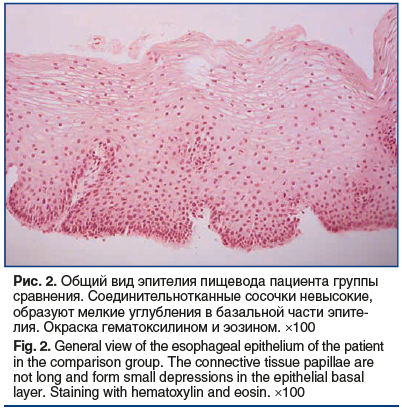
Сравнение морфометрических показателей и экспрессии Е-кадгерина в эпителии пищевода показало, что пациенты с СОАГС в отличие от группы сравнения имели некоторые признаки дезорганизации эпителиальной ткани пищевода, а именно: более выраженную толщину эпителия, более высокие соединительнотканные сосочки, расширенные межъядерные пространства во всех слоях эпителия (табл. 2). В ряде случаев у пациентов с СОАГС определялись признаки микроангиопатии с расширенными капиллярами на верхушках соединительнотканных сосочков (рис. 1), чего не наблюдалось в группе сравнения (рис. 2).
При изучении экспрессии Е-кадгерина было установлено, что пациенты как с легкой, так и со средней степенью тяжести СОАГС характеризовались более низкой экспрессией Е-кадгерина в отличие от пациентов группы сравнения. Кроме того, были обнаружены статистически значимые различия между пациентами с легкой и средней степенью тяжести СОАГС. Анализ данных иммуногистохимического анализа показал, что при возрастании степени тяжести СОАГС экспрессия Е-кадгерина в слизистой оболочке пищевода снижается. На изображениях, полученных при обработке микрофотографий компьютерной программой, можно оценить уровень экспрессии Е-кадгерина (рис. 3).

Корреляционный анализ позволил выявить связь между экспрессией Е-кадгерина в эпителии пищевода и показателями респираторного мониторинга: ИАГ (r=-0,5, p<0,05); ИАА, связанной с респираторными событиями (r=-0,42, p<0,05); максимальной продолжительностью апноэ (r=-0,33, p<0,05); ИД (r=-0,32, p<0,05);
СС (r=0,33, p<0,05).
Обсуждение
Установленные различия между группами и обнаруженные корреляционные связи свидетельствуют о негативном влиянии СОАГС на состояние слизистой оболочки пищевода и дополняют ранее опубликованные данные [14]. Снижение в эпителии экспрессии Е-кадгерина, молекулы клеточной адгезии, у пациентов с СОАГС подтверждает выявленные гистологические признаки дезорганизации эпителиального пласта.
Основываясь на данных литературы, можно предположить следующие механизмы реализации негативного влияния хронической интермиттирующей гипоксии при СОАГС на состояние эпителия пищевода. В экспериментальном исследовании при моделировании карциномы пищевода в условиях гипоксии было обнаружено, что снижение экспрессии Е-кадгерина происходит за счет активации гипоксия-индуцибельного фактора 1α (HIF-1α) [15, 16]. Установлено, что при СОАГС в связи с развитием хронической интермиттирующей гипоксии также происходит повышение содержания HIF-1α [17]. HIF-1α участвует в регуляции клеточного метаболизма в условиях гипоксии и стимулирует ангиогенез. Однако при развитии хронической интермиттирующей гипоксии биологический эффект HIF-1α носит дезадаптационный характер, тормозит процессы апоптоза [18]. Увеличение экспрессии данного фактора отмечается при некоторых злокачественных новообразованиях [19–21]. Кроме уже перечисленного, имеются указания на то, что СОАГС может способствовать метастазированию карциномы in situ, поскольку сопровождается гиперпродукцией матриксной металлопротеиназы 2-го типа, способной разрушать базальную мембрану за счет расщепления коллагена IV типа, участвующего в ее формировании [15, 16].
Заключение
Таким образом, по результатам исследования установлено, что у пациентов с СОАГС отмечается снижение экспрессии Е-кадгерина в эпителии пищевода и создаются условия для дезорганизации эпителиальной ткани, что подтверждено гистологически. При воздействии ряда неблагоприятных факторов на эпителий пищевода (например, воспалительных процессов, рецидивирующей нелеченой гастроэзофагеальной рефлюксной болезни, тонкокишечной метаплазии и пищевода Барретта) интермиттирующая гипоксия у пациентов с СОАГС может усугублять нарушения гистоархитектоники эпителия пищевода, затруднять процессы репарации и тормозить процессы апоптоза, повышая риск ЭМТ и аденокарциномы пищевода. Необходимы проведение проспективных исследований с анализом конечных точек для подтверждения выдвинутой гипотезы, а также более углубленное изучение механизмов канцерогенеза при
СОАГС с целью разработки лекарственных препаратов направленного действия.
Сведения об авторе:
Шелкович Юлия Яновна — ассистент 2-й кафедры внутренних болезней, ГрГМУ, 230009, Республика Беларусь, г. Гродно, ул. Горького, д. 80, ORCID 0000-0001-5942-3778.
Контактная информация: Шелкович Юлия Яновна, e-mail: lazarilin@mail.ru. Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 28.08.2020, поступила после рецензирования 11.09.2020, принята в печать 25.09.2020.
About the author:
Yulia Ya. Shelkovich — Assistant Professor of the 2nd Department of Internal Medicine, Grodno State Medical University: 80, Gorkogo str., Grodno, 230009, Republic of Belarus, ORCID iD 0000-0001-5942-3778.
Contact information: Yulia Ya. Shelkovich, e-mail: lazarilin@mail.ru. Financial Disclosure: the author has not a financial or property interest in any material or method mentioned. There is no conflict of interest. Received 28.08.2020, revised 11.09.2020, accepted 25.09.2020.
.
Информация с rmj.ru






