Введение
Ожирение сегодня является одним из наиболее распространенных заболеваний. В результате ассоциированных с ожирением состояний, в т. ч. артериальной гипертензии (АГ) и синдрома обструктивного апноэ сна (СОАС), в год погибают 2,8 млн людей [1]. Известно, что АГ, возникающая при морбидном ожирении, не зависит от возраста и вызывается множеством факторов. У большей части пациентов с ожирением II и III степени выявляются гиперинсулинемия и инсулинорезистентность. Инсулин способен оказывать прямое воздействие на тонус миоцитов стенки сосудов и изменять активность β-адренорецепторов сосудистой стенки. Помимо этого, гиперинсулинемия способствует повышению активности симпатоадреналовой и ренин-ангиотензиновой систем, усиливает реабсорбцию натрия и воды в почках. В случае хронического избытка инсулина содержание натрия в крови и непосредственно в сосудистой стенке возрастает, что повышает ее чувствительность к прессорным агентам [2, 3].
У пациентов с ожирением, особенно абдоминальным, увеличена секреция 17-гидроксикортикостероидов (метаболитов кортизола), а также, в отличие от лиц без ожирения, не происходит подавления секреции кортизола в ответ на введение 0,5 мг дексаметазона [3]. Кроме того, у больных с абдоминальным ожирением в адипоцитах увеличена экспрессия 11β-гидроксистероид-дегидрогеназы 1 типа, которая усиливает тканевые эффекты кортизола [4]. Обладая минералокортикоидным эффектом, кортизол способствует задержке натрия и воды, а также фиксации натрия в сосудистой стенке, что усиливает вазопрессорные влияния. Помимо этого, кортизол косвенно потенцирует действие адреналина и норадреналина.
Также у пациентов с тяжелым ожирением часто встречается СОАС, что способствует развитию и поддержанию АГ [5]. Период апноэ и связанные с ним неполные пробуждения ведут к повышению активности симпатической нервной системы, что сопровождается повышением уровня катехоламинов в плазме крови и выраженной периферической вазоконстрикцией. Постоянная чрезмерная стимуляция симпатической нервной системы ведет к снижению чувствительности барорецепторов и к активации ренин-ангиотензин-альдостероновой системы, что поддерживает АГ [6, 7].
Как известно, снижение массы тела приводит к уменьшению выраженности коморбидных состояний, в т. ч. АГ и СОАС.
Наибольшую эффективность в лечении морбидного ожирения доказали методы бариатрической (метаболической) хирургии, однако вне зависимости от избранного типа оперативного вмешательства у части пациентов в послеоперационном периоде развивается повторный набор массы тела (ПНМТ) [8–10]. Клиническая значимость ПНМТ изучена недостаточно; во многих работах за клинически значимый ПНМТ принимают 10–25% от потерянной массы тела [11, 12].
В связи с этим представляется актуальным определение клинически значимого ПНМТ и изучение его связи с АГ и СОАС.
Цель: определить величину клинически значимого ПНМТ у пациентов молодого возраста с ожирением после перенесенных бариатрических вмешательств на основании динамики ассоциированных с ожирением состояний.
Материал и методы
В исследование включили 98 пациентов (67 женщин, 31 мужчина) с ожирением II и III степени, перенесших бариатрическое вмешательство (рукавная гастропластика, n=68, гастрошунтирование, n=30). Средний возраст их составил 35,5±6,1 года (23–45 лет), значимых различий по возрасту между мужчинами и женщинами не было.
Набор пациентов и формирование групп осуществляли с мая 2014 г. по июнь 2016 г. Время послеоперационного наблюдения составило от 3,1 до 4,1 года, в среднем 3,6 года. Исходно определяли массу тела, индекс массы тела (ИМТ), систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД), диагностические критерии СОАС.
Динамику массы тела, артериального давления (АД) и симптомов СОАС оценивали через 6, 12, 18, 24, 30 и 36 мес. после выполнения бариатрической операции. Помимо этого, для каждого пациента ретроспективно оценивали время наступления точки надир (минимальной послеоперационной массы тела). Для оценки динамики массы тела в послеоперационном периоде использовались следующие параметры, рекомендованные Международной федерацией хирургии ожирения и метаболических заболеваний (The International Federation for the Surgery of obesity and metabolic disorders, IFSO) в 2015 г.: ИМТ, ПНМТ, САД и ДАД.
ИМТ определялся по формуле: масса тела (кг) / рост (м)2; массой тела в точке надир считалась минимальная масса тела, достигнутая в послеоперационном периоде. ПНМТ рассчитывался по следующей формуле:
ПНМТ (%) = 100 ×
(МТ текущая – МТ в точке надир)
ПНМТ (МТ исходно — МТ в точке надир)
где МТ — масса тела.
Клинически значимым считали ПНМТ, приводящий к значимому ухудшению ассоциированных с ожирением состояний.
Измерение АД выполнялось по методу Короткова с соблюдением правил измерения (Рекомендации по профилактике, диагностике и лечению артериальной гипертензии экспертов ВНОК 2010 г. [13]). За АГ принималось повышение САД до 140 мм рт. ст. и более и/или повышение ДАД до 90 мм рт. ст. и более.
Диагноз СОАС устанавливался в соответствии с рекомендациями по диагностике и лечению СОАС у взрослых Российского общества сомнологов 2018 г. [14].
Статистический анализ: статистическая обработка результатов исследования проведена с использованием программной системы Statistica for Windows (версия 10). При проведении статистической обработки данных использовали методы описательной, а также непараметрической статистики: достоверность различий средних значений определялась с помощью критерия Манна — Уитни, для зависимых выборок использовался критерий Вилкоксона. Значимыми считались различия при р <0,05.
Результаты
Исходно ИМТ у пациентов в среднем составил 44,3±9,7 кг/м2; у мужчин ИМТ был статистически значимо выше, чем у женщин (51,3±11,5 против 41,4±7,1 кг/м2 соответственно, р=0,000). В то же время ИМТ у пациентов из групп рукавной гастропластики и гастрошунтирования статистически значимо не различался (р>0,05).
Исходно АГ была зарегистрирована у 61 (62,8%) пациента, при этом доля мужчин с АГ была значимо выше, чем доля женщин (90,3% и 53,7% соответственно, р<0,05). Среди пациентов с выявленной АГ 27 (44,3%) пациентов не получали регулярной антигипертензивной терапии; 20 (32,8%) пациентов получали монотерапию ингибиторами АПФ / антагонистами рецепторов к ангиотензину II типа; 14 пациентов (22,9%) получали терапию ингибиторами АПФ / антагонистами рецепторов к ангиотензину II типа в комбинации с тиазидными диуретиками и/или блокаторами кальциевых каналов. Исходно не было выявлено значимых различий в уровнях САД и ДАД между мужчинами и женщинами с АГ (р>0,05); среднее САД составило 156,8±17,6 мм рт. ст., среднее ДАД — 99,4±10,7 мм рт. ст.
Диагноз СОАС был установлен у 36% пациентов, при этом у мужчин данный синдром встречался статистически значимо чаще, чем у женщин (87,0% против 14,9% соответственно, р<0,05). Двое пациентов получали CPAP-терапию (режим искусственной вентиляции легких постоянным положительным давлением — continuous positive airway pressure) с положительным клиническим эффектом. Данные представлены в таблице 1.
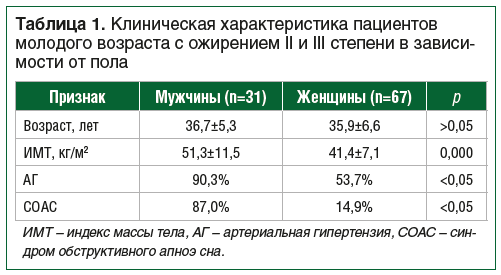
Как видно из представленных данных, среди пациентов
молодого возраста с ожирением у мужчин выявлен более высокий индекс массы тела и чаще встречались АГ и СОАС.
Время достижения минимальной массы тела после бариатрического вмешательства (точка надир) составляло в среднем 12,8 мес.; статистически значимых различий по времени достижении точки надир и ИМТ в точке надир (в среднем 31,8±8,3 кг/м2) в зависимости от типа операции не выявлено (р>0,05).
Через 1 год после перенесенного оперативного вмешательства у пациентов с исходной АГ уровень САД и ДАД статистически значимо снизился и составил в среднем 134,6±11,7 мм рт. ст. и 84,5±10,9 мм рт. ст. соответственно (р=0,000, р=0,000 соответственно). Целевых значений САД и ДАД (менее 140 и 90 мм рт. ст. соответственно) достигли 49,2% пациентов с исходной АГ, при этом доли мужчин и женщин, достигших целевых значений АД, были сопоставимы (50,0% и 41,8% соответственно). Статистически значимых различий по уровню САД и ДАД между мужчинами и женщинами не выявлено (р>0,05). У пациентов, исходно не имевших АГ, через 1 год после бариатрического вмешательства значимого снижения САД и ДАД не выявлено. Клинические проявления СОАС, по данным опроса через 1 год после перенесенного бариатрического вмешательства, сохранились у 13 (48,1%) из 27 мужчин и у 7 (70,0%) из 10 женщин, что позволяет предположить меньший вклад ожирения в клиническую картину СОАС у женщин.
Через 3 года после перенесенного оперативного вмешательства было обследовано 77 пациентов (женщин — 53). У части пациентов развился ПНМТ. При этом ПНМТ менее 10% расценивался как фаза плато (поддержание достигнутой массы тела). По ПНМТ пациенты распределились следующим образом: ПНМТ 10–14,9% — 14 (18,2%) пациентов, ПНМТ 15–24,9% — 20 (26,0%) пациентов, ПНМТ 25% и более – 28 (36,4%) пациентов. Оставшиеся (19,4%) 15 пациентов продемонстрировали ПНМТ менее 10% или продолжали снижать массу тела к 3-му году послеоперационного периода. Средний ПНМТ составил 25,6±18,02%.
В группах с ПНМТ менее 15% к 3-му году после операции не было выявлено статистически значимого изменения показателей САД и ДАД по сравнению с 1-м годом после операции (р>0,05). Группы, продемонстрировавшие ПНМТ 15–24,9% и ПНМТ более 25% к 3-му году после вмешательства, имели более высокие значения САД (р=0,036; р=0,022 соответственно) и ДАД (р=0,025; р=0,019 соответственно) (табл. 2).
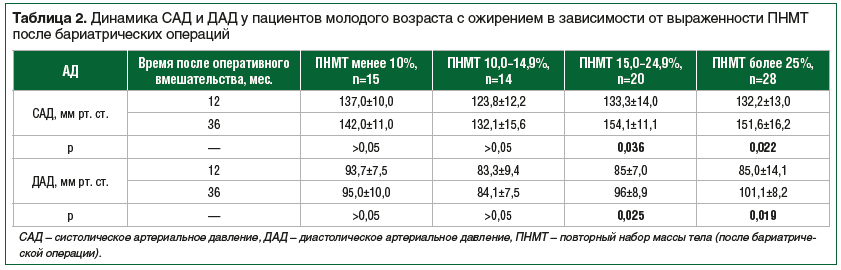
Через 3 года после бариатрического вмешательства СОАС значимо чаще выявлялся у пациентов с ПНМТ более 25%, чем у пациентов в фазе плато (ПНМТ менее 10%) (р<0,05).
У пациентов с ПНМТ более 15% выявлены статистически значимые различия по уровню САД и ДАД через 12 и через 36 мес. послеоперационного периода по сравнению с данными показателями у пациентов с ПНМТ менее 15%.
Таким образом, ПНМТ более 15% был ассоциирован со статистически значимым увеличением САД и ДАД, что позволяет считать ПНМТ более 15% наиболее клинически значимым. Клинически значимый ПНМТ был выявлен у 62,4% пациентов. Статистически значимых различий по частоте клинически значимого ПНМТ между женщинами и мужчинами не зарегистрировали (р>0,05).
Обсуждение
В представленном исследовании АГ выявлена у 62,8% пациентов молодого возраста. В исследовании участвовали пациенты моложе 45 лет, чтобы минимизировать влияние возраста на АД, а также исключить вклад климактерического синдрома (68,3% пациентов — женщины). Среди обследованных пациентов у мужчин значимо чаще встречались и АГ, и СОАС, что может быть связано со значимо бóльшим исходным ИМТ у мужчин.
Влияние снижения массы тела на течение АГ и СОАС было доказано во множестве исследований. Бариатрические вмешательства, как и другие методы лечения ожирения, способствуют уменьшению выраженности ассоциированных с ожирением состояний. Так, в работе Noel et al. (2017) после проведенной рукавной гастропластики среди пациентов с исходной АГ целевые значения АД были у 59,4% [15]. В представленном исследовании значимое снижение АД произошло у 49,2% пациентов. Таким образом, полученные в текущем исследовании результаты соответствуют литературным данным.
Вне зависимости от метода лечения ожирения у части пациентов развивается ПНМТ. Активно обсуждается клиническая значимость ПНМТ после предпринятых попыток лечения ожирения, в т. ч. после бариатрических операций. Во многих работах за клинически значимый ПНМТ принимают 10–25% от потерянной массы тела [11, 12]. В приведенном исследовании клинически значимым считали ПНМТ более 15%, поскольку такие значения ПНМТ ассоциированы со значимым повышением САД и/или ДАД по сравнению с показателями, наблюдаемыми через 12 мес. после оперативного вмешательства (в среднем именно в этот период пациенты достигали минимальной послеоперационной массы тела).
Согласно литературным данным после бариатрических вмешательств ПНМТ встречается у 15–40% пациентов в зависимости от срока послеоперационного наблюдения и типа выполняемой бариатрической операции [8, 10]. В текущем исследовании клинически значимый ПНМТ был выявлен у 62,4% пациентов, что превышает литературные данные. Подобные результаты могут быть связаны с тем, что в исследование были включены пациенты молодого возраста. Процессы активного набора массы тела, как правило, происходят именно в молодом возрасте. В исследовании Shantavasinkul et al. (2016), посвященном наблюдению 1426 пациентов (15,8% — мужчины) после гастрошунтирования, возраст пациентов с ПНМТ был статистически меньше, чем возраст пациентов без ПНМТ, — 42,3±9,8 года и 45,7±10,8 года соответственно (р=0,001). Согласно результатам, полученным в данном исследовании, более молодой возраст на момент бариатрической операции сам по себе является предиктором ПНМТ [9]. Помимо этого, необходимо учитывать, что пожилые пациенты, как правило, более мотивированы на удержание достигнутой массы тела в связи с выраженностью коморбидной патологии.
Выводы
У 62,8% пациентов до 45 лет с ожирением II и III степени выявлена АГ различной степени выраженности Среди пациентов с ожирением, перенесших бариатрическую операцию, мужчины имели значимо больший ИМТ, а также чаще страдали АГ и СОАС.
У 49,2% пациентов через 12 мес. после бариатрической операции достигнуты целевые значения АД; ассоциации между полом пациентов и снижением САД и ДАД не выявлено.
Клинически значимый ПНМТ более 15% через 36 мес. после бариатрической операции выявлялся у 62,4% пациентов моложе 45 лет. ПНМТ более 15% ассоциирован со значимым повышением САД и ДАД.
Заключение
Таким образом, применение методов бариатрической хирургии в лечении тяжелого ожирения представляется непростой задачей. Важной клинической проблемой является ПНМТ, препятствующий достижению ремиссии ожирения и ассоциированных с ожирением состояний, таких как АГ и СОАС. Поиск предикторов ПНМТ и прогнозирование исходов бариатрических вмешательств у больных с тяжелым ожирением представляется перспективной задачей современной медицины.
Информация с rmj.ru