Рак мочевого пузыря (РМП) является одним из наиболее распространенных видов злокачественных опухолей во всем мире, ежегодно диагностируется около 400 тыс. новых случаев заболевания [1]. Частота заболеваемости у мужчин в 3–4 раза выше, чем у женщин. На момент постановки диагноза пациенты обычно находятся в возрасте от 65 до 70 лет. Основными факторами риска РМП являются воздействие окружающей среды, профессиональное влияние канцерогенов, курение [1, 2]. Приблизительно у 70–80% пациентов с впервые диагностированным РМП выявляются немышечно-инвазивные формы рака мочевого пузыря (НМИРМП), такие как неинвазивная папиллярная опухоль (pTa) (рис. 1A), карцинома in situ (CIS; pTis) (рис. 1B) или ранняя инвазивная опухоль (без мышечной инвазии, pT1). Эти опухоли рецидивируют в 50–70% случаев, причем только в 10–20% случаев прогрессируют до мышечно-инвазивного рака мочевого пузыря МИРМП) [3–5]. Накопленные к настоящему моменту данные свидетельствуют о том, что РМП представляет собой группу молекулярно-гетерогенных заболеваний [6–23]. Более глубокое понимание молекулярной патологии РМП привело к идентификации его специфических молекулярных подтипов. В этой статье содержится краткий обзор современного понимания молекулярной патологии РМП, обсуждаются вопросы потенциальной терапии пациентов с определенными молекулярными подтипами РМП.
Данные о молекулярных биомаркерах и путях, связанных с РМП, позволяют получить представление о его биологической гетерогенности и выявить конкретные подтипы, которые могут быть использованы для прогнозирования клинических исходов, и реакции на персонифицированную терапию.
Согласно Атласу ракового генома (TCGA) для МИРМП характерна высокая общая мутационная нагрузка, которая аналогична таковой при меланоме и немелкоклеточном раке легкого. Большинство мутаций, по-видимому, являются «пассажирскими» мутациями, без каких-либо функциональных последствий [13]. В большом количестве соматических мутаций преобладает переход C:G → T:A в контексте TpC-динуклеотидов, характерных для мутаций, вызванных семейством цитидиновых дезаминаз APOBEC [28], которые обычно подавляют распространение вирусов [6]. Повторяющиеся генетические перестройки включают в себя мутации в генах TP53, FGFR3, PIK3CA и RB1 [13]. Клетки РМП также часто содержат соматические промоторы (TERT-промотор), присутствие которых характерно для ранних стадий процесса канцерогенеза [5, 29, 30]. Удержание теломер действует как митотические часы, поэтому активация теломеразы, которая удлиняет теломеры на концах хромосом, имеет решающее значение для дальнейшего роста раковых клеток [31]. Когортное исследование генома МИРМП (TCGA) продемонстрировало взаимную исключительность изменений между парами CDKN2A и TP53, CDKN2A и RB1, TP53 и MDM2 и FGFR3 и RB1. Подобный анализ показал совпадение мутаций в генах TP53 и RB1 и генах FGFR3 и CDKN2A [13].
В Атласе ракового генома представлена всесторонняя молекулярная характеристика МИРМП [13]. Однако полученные результаты необходимо тщательно оценивать. По данным TCGA, достоверно показаны 58 мутированных генов и высокая частота появления нескольких генетических путей. Но с учетом гетерогенного характера МИРМП для получения полного каталога мутаций или путей, в т. ч. с низкой частотой встречаемости, необходимо изучение еще большего количества образцов [32]. Создание полного каталога потенциальных генов-кандидатов, мутировавших у ≥2% пациентов с МИРМП, потребует тысячи новых образцов, учитывая общую частоту мутаций этих видов рака [33]. Скорее всего, в ближайшем будущем, с учетом сокращения затрат на секвенирование, будет создан более полный каталог МИРМП [32]. Кроме того, почти ни одно из исследований не повторило данные TCGA [13]. Поэтому важно, чтобы эти результаты были подтверждены в исследованиях на других когортах. Более того, поскольку в исследовании TCGA [13] изучались образцы без проведенной химиотерапии, полученные результаты дают ограниченное представление об эволюции опухоли и механизмах приобретенной терапевтической резистентности, которую еще предстоит выяснить [34]. Дальнейшие исследования необходимы для создания более полного и точного молекулярного каталога МИРМП с целью разработки терапевтических стратегий.
Содержание статьи
FGFR3/RAS путь
Путь FGFR3/RAS может быть активирован в опухолях мочевого пузыря при любой стадии, но преимущественно активен при низкой стадии НМИРПМ. До 80% случаев НМИРМП активируется точечными мутациями в гене FGFR3. Это связано как с более высоким риском рецидива при неинвазивной папиллярной опухоли, так и с благоприятными клиническими исходами при опухолях pT1 [5, 6, 35–37]. Мутации в гене FGFR3 были идентифицированы только в 10–20% случаев при МИРМП. Мутированный FGFR3 активирует путь RAS-MAPK, что приводит к пролиферации клеток. Приблизительно в 10% случаев РМП содержатся мутации в генах RAS, такие как HRAS, KRAS и NRAS [38], которые не встречаются с мутациями FGFR3 [39]. Новые данные свидетельствуют о том, что определенный подтип опухолевых образований мочевого пузыря содержит повторяющиеся внутриклеточные слияния FGFR3-TACC3 [12, 40].
PIK3/AKT/MTOR путь
Путь PIK3/AKT/MTOR регулирует важные этапы опухолевого генеза и прогрессирования опухоли. Этот путь активируется рецепторными тирозинкиназами, в т. ч. ERBB2, ERBB3 и FGFR3. Мутации PIK3CA, которые были идентифицированы в 22% случаев при МИРМП, чаще расположены в спиральном домене, чем в киназном домене, вероятно, из-за мутагенной активности APOBEC. Мутации PIK3CA также, по-видимому, связаны с благоприятными исходами у пациентов, которые подвергаются радикальной цистэктомии [41]. Известно, что ген ERBB2 мутируется или сверхэкспрессируется в подмножестве случаев при МИРМП [2, 12]. Мутации ERBB2 (12% случаев МИРМП) обычно встречаются во внеклеточном домене, вероятнее всего, из-за мутационной сигнатуры APOBEC [13]. Выделение или снижение экспрессии PTEN, который является отрицательным регулятором пути PIK3/AKT/MTOR, наблюдалось во многих случаях МИРМП, тогда как AKT1 и TSC1, которые также регулируют этот путь, не так часто подвержены мутациям [5].
TP53/RB1 путь
Путь TP53/RB1 играет важную роль в регуляции клеточного цикла. Мутация или делеция TP53 наблюдалась преимущественно в случаях CIS и МИРМП [5, 26, 42]. Инактивация RB1 также наблюдалась преимущественно при МИРМП, часто с одновременными мутациями TP53 [7]. Согласно данным когорты TCGA [13] в 89% случаев МИРМП отмечается инактивированный путь клеточного цикла TP53, с мутациями TP53 — в 48%, усилением MDM2 — в 6%, избыточной экспрессией MDM2 — в 19% случаев. С другой стороны, в 17% случаев МИРМП выявляются мутации RB1. Также было обнаружено, что в CDKN2A (p16), который функционирует как отрицательный регулятор RB1-пути, мутация отмечается в 7%, а делеция — в 22% случаев.
Молекулярный патогенез рака мочевого пузыря
Считается, что при РМП происходит быстрое распространение опухолевых клеток по слизистой оболочке, что приводит к мультифокальному и метахронному онкогенезу [5, 43, 44]. Эпителиальные клетки мочевого пузыря в пораженной зоне становятся злокачественными, подвергаются генетическим изменениям, которые приводят к канцерогенезу путем клональной эволюции [45]. РМП развивается либо через путь FGFR3/RAS, либо через путь TP53/RB1 [5, 25]. Делеция в 9-й хромосоме характерна для уротелиальной гиперплазии и дисплазии [26, 27, 46],
и она развивается по обоим путям. Путь FGFR3/RAS позволяет опухолям прогрессировать от уротелиальной гиперплазии до неинвазивной папиллярной опухоли с высокой частотой рецидивов. Мутация FGFR3/HRAS часто возникает во время развития уротелиальной гиперплазии [2, 6, 25, 30, 47, 48]. При неинвазивной карциноме Ta часто выявляется мутация PIK3CA/STAG2 [2, 6, 25, 49], при этом происходит переход в инвазивную карциному Та, которая может прогрессировать, чтобы перейти в стадию T1 после инактивации CDKN2A [2, 6, 13, 25, 50]. Путь TP53/RB1 позволяет опухолям прогрессировать от дисплазии до инвазивных опухолей через TIS [25]. Мутация TP53 часто возникает во время развития уротелиальной дисплазии [26], а потеря RB1 позволяет прогрессировать от уротелиальной гиперплазии в CIS [2, 6, 25, 51]. В повреждении слизистой мочевого пузыря с гиперплазией и дисплазией (гиперпластическое поражение с цитологической атипией) может также играть роль взаимодействие между двумя путями регуляции [2, 5, 6, 25].
Молекулярные подтипы рака мочевого пузыря
РМП является молекулярно- и клинико-патологически гетерогенным заболеванием. Вследствие его гетерогенности применение молекулярно-целевых методов лечения и основанного на этом персонализированного подхода затруднительно. В последние годы было проведено исследование экспрессии всего генома и молекулярного профилирования с целью классификации РМП на внутренние подгруппы, которые связаны со специфическими молекулярными признаками, прогнозами и ответами на определенные методы лечения [7–14].
Немышечно-инвазивный рак мочевого пузыря
Комплексный транскрипционный анализ 460 случаев НМИРМП показал, что эти опухоли можно классифицировать на три геномных подтипа (классы 1–3), которые существенно отличаются по своим клинико-патологическим особенностям, включая длительность безрецидивной выживаемости [14]. Из 460 проанализированных опухолевых материалов 345 представляли собой pTa, 112 — pT1, 3 — CIS, 16 — МИРМП. У опухолей класса 1 (n=96) и класса 2 (n=235) была показана сигнатура экспрессии люминального гена, который включал экспрессию уроплакинов. Опухоли класса 1 в основном были неинвазивными папиллярными, прогноз — лучший среди трех классов. У опухолей класса 1 были самые высокие уровни экспрессии генов раннего клеточного цикла. Опухоли класса 2 содержали большее количество pT1 и имели худший прогноз среди трех классов. Опухоли класса 2, как было обнаружено, разделяли степень экспрессии генов с большинством одновременно исследованных тканей МИРМП. Они также имели высокий уровень экспрессии KRT20, который в значительной степени связан с CIS [52]. Кроме того, опухоли класса 2 характеризовались эпителиально-мезенхимальным переходом (ЕМТ), который связан со стволовыми клетками и мутационными сигналами APOBEC и, как было установлено, содержит мутации в TP53 и ERCC2. При НМИРМП присутствие мутационной сигнатуры, связанной с APOBEC, характеризовалось плохим прогнозом. Опухоли класса 3 (n=129) проявляли экспрессию базальноподобного гена, которая включает экспрессию KRT5, KRT15 и CD44 [2, 4, 14].
Мышечно-инвазивный рак мочевого пузыря
Всесторонняя молекулярная характеристика МИРМП позволила классифицировать его на подтипы, связанные с конкретными клинико-патологическими особенностями [6–13]. РМП подразделяется на два основных подтипа — люминальный и базальный, которые имеют сходство с внутренними подтипами рака молочной железы [53]. Исследования молекулярного профилирования дополнительно классифицировали РМП в зависимости от риска
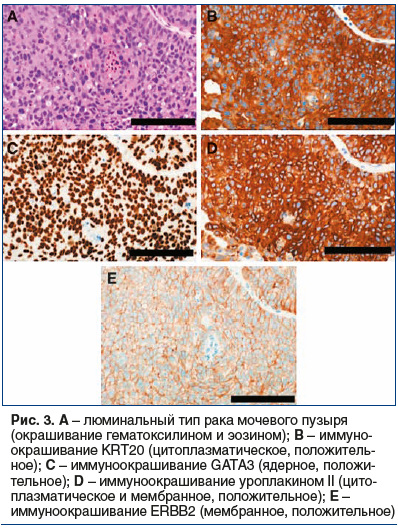
рецидива и прогрессирования, а также от ответа на лечение [7–13]. Lindgren et al. [10, 11] впервые выявили кератинизированный/базальный тип МИРМП, который был связан с плохим клиническим исходом. Choi et al. [9] продемонстрировали, что базальный тип МИРМП (рис. 2A) является агрессивным и реагирует на неоадъювантную химиотерапию. Он также характеризуется экспрессией белков CK5/6 (рис. 2B), CD44 (рис. 2C), TP63 (рис. 2D) и EGFR (рис. 2E), но не KRT20 или маркеров уротелиальной дифференцировки. Эти авторы также продемонстрировали, что люминальный тип МИРМП (рис. 3A) характеризуется мутациями FGFR3, экспрессией белка KRT20 (рис. 3B), маркерами уротелиальной дифференцировки (например, GATA3 (рис. 3C) и уроплакином (рис. 3D) и ERBB2 (рис. 3Е)), но не белками CK5/6, CD44, TP63 или EGFR. Кроме того, они идентифицировали подтип МИРМП, ассоциированный с TP53, который устойчив к неоадъювантной химиотерапии [9]. В 2014 г. данные TCGA из 131 случая МИРМП были использованы для классификации РМП на четыре подтипа экспрессии (кластеры I–IV). Кластеры I и II обладают характеристиками люминального типа МИРМП, включая дифференцировку уротелиальной клетки и экспрессию GATA3 и FOXA1. Высокие уровни экспрессии белка семейства E-cadherin (CDH1) и miR-200 (ингибируют ЕМТ) [54] также обнаружены в кластерах I и II. Кластер I (папиллярный подтип) характеризуется папиллярной морфологией, изменением FGFR3 и низкими уровнями экспрессии miR-99a-5p и miR-100–5p, которые снижают экспрессию FGFR3. Кластер III (базально-плоскоклеточный подтип) показывает особенности базального типа МИРМП, включая плоскоклеточную дифференцировку и обогащение функций экспрессии стволовых клеток. Класс IV, соответствующий подтипу ЕМТ, характеризуется низкими уровнями E-cadherin и белков семейства miR-200. С точки зрения ответа на лечение TCGA-кластер II/TP53-подобный люминальный подтип очень чувствителен к ингибитору PD-L1 (CD274) атезолизумабу, но не к неоадъювантной химиотерапии [9, 12, 55]. Таким образом, пациентам с опухолями типа TCGA-кластера II/TP53 не нужно проводить неоадъювантную химиотерапию, вместо этого без промедления им проводится цистэктомия или иммунотерапия [9, 12].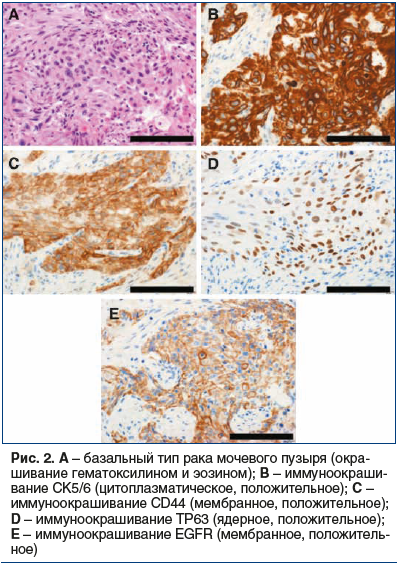
В 2017 г. по данным TCGA была проведена каталогизация молекулярных и клинико-патологических особенностей на основании 412 случаев МИРМП [13]. С использованием полногеномного секвенирования было идентифицировано пять мутационных сигнатур. Две из них были вариантами мутаций APOBEC и составляли 67% всех однонуклеотидных вариантов. Кроме того, уровни мутаций APOBEC были связаны с уровнями экспрессии APOBEC3A и APOBEC3B, как сообщалось ранее [56]. Большинство выявленных мутаций РМП были клонированными, что указывает на то, что мутационная разновидность APOBEC встречается на ранней стадии канцерогенеза. Выяснение механизма, с помощью которого эта мутация влияет на прогрессирование опухоли, может помочь предотвратить распространение таких опухолей [13]. Кластерный анализ выявил четыре кластера мутационных сигнатур, которые были связаны с длительностью общей выживаемости. Пациенты с высоким уровнем мутаций в APOBEC и высоким мутационным бременем имели большую 5-летнюю выживаемость (75%) по сравнению с таковой у пациентов с кластером с самым низким мутационным бременем (5-летняя выживаемость — 22%). Такая высокая выживаемость у этой группы пациентов может быть результатом более эффективных противоопухолевых иммунных реакций хозяина на опухоль с высоким мутационным бременем. Кластеризация уровней экспрессии матричной РНК позволила идентифицировать 5 молекулярных подтипов МИРМП (люминально-папиллярный, люминально-инфильтративный, люминальный, базально-плоскоклеточный и нейрональный), которые могут быть использованы для стратификации пациентов в соответствии с прогнозируемой биологической реакцией и ответом опухоли на лечение. Например, люминально-папиллярные, люминально-инфильтративный и люминальный подтипы экспрессируют люминальные маркеры, включая GATA3, FOXA1, уроплакины и KRT20.
Люминально-папиллярный подтип РМП (35%) характеризуется папиллярной морфологией и обеспечивает наилучшую общую выживаемость. Он отличается изменениями FGFR3, включая слияния FGFR3-TRCC3 и активацию сигнального пути SHH. Этот подтип часто имеет низкодифференцированный CIS, низкий уровень взаимосвязи опухоли внеклеточного матрикса и гладких мышц, низкую мутационную нагрузку, низкие уровни гиперметилирования и высокую частоту делеций CDKN2A. При этих опухолях отмечаются высокие уровни белков семейства miR-200, CDH1 и ERBB2, но низкие уровни miR-99a-5p и miR-100–5p [32]. Люминально-инфильтративный подтип РМП (19%) характеризуется низкой дифференцировкой опухоли и подписью мезенхимальной экспрессии. Эти опухоли высоко экспрессируют маркеры ЕМТ и умеренно экспрессируют иммунные маркеры (PD-L1 и CTLA4). Люминальный подтип РМП (6%) характеризуется высокими уровнями уроплакинов (UPK1A и UPK2), KRT20 и SNX31 и отображает фенотип иммунных клеток. Базально-плоскоклеточный подтип РМП (35%) соответствует ранее определенному базальному подтипу, который связан с плоскоклеточной дифференцировкой и экспрессией базального кератина. Этот подтип преимущественно обнаружен у женщин и выражает высокие уровни базальных маркеров (CD44, KRT5, KRT6A и KRT14), маркеров плоскоклеточной дифференцировки (TGM1, DSC3 и PI3) и иммунных маркеров (PD-L1 и CTLA4). Этот подтип часто отличается высокодифференцированным CIS, потерей передачи SHH сигнала и наличием мутаций TP53. Нейрональный подтип РМП (5%) в большинстве случаев не содержит нейроэндокринной дифференцировки, у пациентов с таким подтипом наблюдаются худшие клинические результаты. При этом подтипе отмечаются высокие уровни нейроэндокринных и нейронных генов, высокая сигнатура пролиферации и большое количество мутаций TP53 и RB1.
Молекулярные изменения и их терапевтическая значимость
Последние два десятилетия характеризовались малым количеством успехов в лекарственном лечении МИРМП. Цитотоксическая химиотерапия на основе цисплатина по-прежнему является первой линией при прогрессирующем или метастатическом РМП. Этот термин объединяет группу молекулярно-гетерогенных заболеваний, при которых проводятся различные курсы лечения, характеризующиеся разнообразными терапевтическими ответами [57]. Хотя увеличение показателей выживаемости может наблюдаться у 5–10% пациентов в ответ на неоадъювантную химиотерапию [58, 59], реакцию пациента на это лечение предсказать невозможно. В эпоху прецизионной медицины необходимы молекулярно-подгрупповые терапевтические стратегии.
В дополнение к распределению молекулярных подтипов РМП [7, 12, 41] 412 случаев МИРМП (по данным TCGA) были использованы для изучения вероятного ответа на доступные методы лечения [13, 34]. Предполагается, что люминально-папиллярный подтип мало реагирует на неоадъювантную химиотерапию. При этом подтипе целесообразно использование ингибиторов FGFR или ранняя цистэктомия без предоперационной химиотерапии [9, 60]. Наличие люминально-инфильтративного подтипа является предиктором плохого ответа на неоадъювантную химиотерапию. Согласно проведенному клиническому исследованию [55] и данным TCGA-кластера II [12] наличие люминально-
инфильтративного подтипа вызывает хороший ответ на блокаду иммунных контрольных точек атезолизумабом. Таким образом, при данном подтипе целесообразна терапия ингибиторами иммунных контрольных точек. В настоящее время нет обоснованных рекомендаций относительно методов лечения при новом люминальном подтипе. Исследования его чувствительности к неоадъювантной химиотерапии, таргетной терапии и терапии ингибиторами иммунных контрольных точек продолжаются. При базально-плоскоклеточном подтипе отмечается относительно высокая чувствительность к неоадъювантной химиотерапии. И предоперационная химиотерапия, и ингибиторы иммунных контрольных точек могут быть подходящими терапевтическими вариантами для этого подтипа. При нейрональном подтипе целесообразна комбинация этопозида с цисплатином, что аналогично лечению нейроэндокринных опухолей других локализаций.
Иммунотерапия стала многообещающей стратегией лечения различных злокачественных новообразований, включая РМП [34, 55, 61–64]. Экспериментальные данные продемонстрировали, что механизмы ингибирования иммунных контрольных точек играют решающую роль в подавлении противоопухолевого иммунного ответа, опосредуемого Т-клетками. В клиническом исследовании III фазы KEYNOTE-045 использование пембролизумаба (анти-PD-1) было связано со значимым увеличением общей выживаемости и более низкой частотой побочных эффектов, связанных с лечением, чем химиотерапия в качестве второй линии лечения при прогрессии после химиотерапии на основе платиновых режимов при метастатическом или местно-распространенном уротелиальном раке [62]. В этом исследовании эффективность пембролизумаба не зависела от экспрессии PD-L1 в опухолевых и иммунокомпетентных клетках. Кроме того, применение пембролизумаба в исследовании KEYNOTE-052 [63] и атезолизумаба в исследовании IMvigor 210 [64] приводило к увеличению общей выживаемости в подгруппе пациентов с метастатическим уротелиальным раком, у которых имелись противопоказания к применению химиотерапии на основе цисплатина [34]. Клинические исследования ингибиторов иммунных контрольных точек продемонстрировали многообещающие результаты. Ожидается получение данных о взаимосвязи между выгодой от ингибиторов иммунных контрольных точек и недавно идентифицированных молекулярных подтипов МИРМП.
Заключение
В этом обзоре обобщаются текущие знания о молекулярной патологии РМП, включая молекулярные биомаркеры, сигнальные пути и недавно идентифицированные молекулярные подтипы. Существенный прогресс в лечении РМП пока отсутствует. Благодаря недавним достижениям, касающимся молекулярных характеристик РМП, стало возможно выделить специфические и молекулярно-характеризованные подтипы этой гетерогенной группы заболеваний с разнообразным клиническим течением и терапевтическими ответами. Идентификация молекулярно-биологических подтипов может улучшить управление болезнью пациента путем применения персонифицированных методов лечения. Выявленные ассоциации конкретных молекулярных подтипов с терапевтическими стратегиями еще не подтверждены, но могут стать основой для разработки направлений текущих и запланированных клинических исследований. Учитывание молекулярной характеристики РМП при разработке стратегии лечения пациентов с РМП предоставит клиницистам лучшие терапевтические возможности.
Информация с rmj.ru
