Систематический анализ исследований противоопухолевых эффектов хондропротекторов глюкозамина сульфата и хондроитина сульфата
Содержание статьи
- 1 Введение
- 2 Молекулярные механизмы противоопухолевого действия ГС: воздействие на провоспалительные цитокины
- 3 Молекулярные механизмы противоопухолевого действия ГС: другие механизмы
- 4 Молекулярные механизмы противоопухолевого действия ХС
- 5 Паттерны сульфатирования и противоопухолевое действие ХС
- 6 Клинико-эпидемиологические исследования противоопухолевых эффектов ХС/ГС
- 7 Заключение
Введение
Стандартизированные фармацевтические формы хондроитина сульфата (ХС) и глюкозамина сульфата (ГС) являются эффективными и безопасными хондропротекторами, позволяющими осуществлять долговременную терапию остеоартрита и других патологий суставов. ХС и ГС способствуют реконструкции соединительнотканной основы хряща и обладают анальгетическим и противовоспалительным действием. Взаимодействуя с рецепторами CD44, TLR4 и ICAM1 на поверхности различных клеток, ХС и ГС ингибируют провоспалительный транскрипционный фактор NF-kB и цитокиновый сигнальный путь JAK/STAT. Поэтому стандартизированные формы ХС/ГС наряду нестероидными противовоспалительными препаратами (НПВП) могут использоваться в терапии не только патологии суставов [1], но и других заболеваний, в патогенезе которых имеется компонент хронического воспаления.
Важными перспективными направлениями применения ХС/ГС являются долговременная профилактика и адъювантная терапия опухолевых заболеваний. Эти фармакологические эффекты ХС/ГС известны достаточно давно: первые работы, посвященные ингибированию роста опухолей глюкозамином, были опубликованы еще в начале 1950-х гг. [2–4]. Противоопухолевое действие ХС/ГС обусловлено, в частности, тем, что ХС и ГС способствуют снижению хронического воспаления, в т. ч. опосредованного фактором некроза опухолей (ФНО).
Хемореактомный анализ молекулы показал, что ГС и самостоятельно, и в сочетании с НПВП проявляет следующие биологически активные свойства: 1) ингибирует белки метаболизма простагландинов и лейкотриенов,
2) ингибирует провоспалительный эффект транскрипционного фактора NF-kB, участвующего в осуществлении действия ФНО-α, 3) снижает экспрессию провоспалительных цитокинов в культуре клеток, 4) ингибирует различные матриксные металлопротеиназы, 5) обладает вазодинамическими и антидиабетическими эффектами в отношении культуры клеток [5]. Эти эффекты важны для профилактики и терапии опухолевых заболеваний.
Хемотранскриптомный анализ молекулы ГС при воздействии на фибробласты линии FIBRNPC показал, что ГС не только ингибирует активность NF-kB и других провоспалительных белков, но и способствует снижению транскрипции генов, вовлеченных в провоспалительный сигнальный каскад NF-kB (NFKB2, TNFRSF1B, PYCARD, TRAF2, TNFSF12 и др.) и генов белков, осуществляющих передачу сигнала на разных уровнях каскада NF-kB (CD44, TLR4, ICAM1, NF-kB, JAK/STAT и др.). ГС может в существенной мере снижать экспрессию генов, вовлеченных в процесс деления клетки и транскрипцию генов [6]. Комплексное противовоспалительное и цитостатическое действие ГС является патогенетическим при лечении не только остеоартрита, но и коморбидных заболеваний, сопровождающихся хроническим воспалением, в т. ч. опухолевых заболеваний.
В настоящей работе представлен систематический анализ противоопухолевых эффектов ХС/ГС. Количество публикаций по данному вопросу достаточно велико: например, только по запросу «(Cancer OR cancers OR tumor OR tumors OR tumour OR tumours) AND (glucosamine OR chondroitin)» в базе данных биомедицинских публикаций PUBMED найдено 5129 ссылок, из них по эффектам ГС — 2659 ссылок. В рамках настоящей работы мы осуществили компьютеризованный анализ данного массива публикаций с использованием современных методов анализа больших данных [7, 8], развиваемых в рамках топологического [9] и метрического [10, 11] подходов к задачам распознавания/классификации [12, 13]. В качестве контрольной выборки публикаций использовались 5129 случайно выбранных статей из 4 226 339 найденных по запросу «(Cancer OR cancers OR tumor OR tumors OR tumour OR tumours) NOT glucosamine NOT chondroitin» в базе данных PUBMED. В результате проведенного анализа текстов были отобраны наиболее информативные ключевые слова, описывающие взаимосвязь ХС/ГС с патофизиологий и клиникой опухолевых патологий (табл. 1).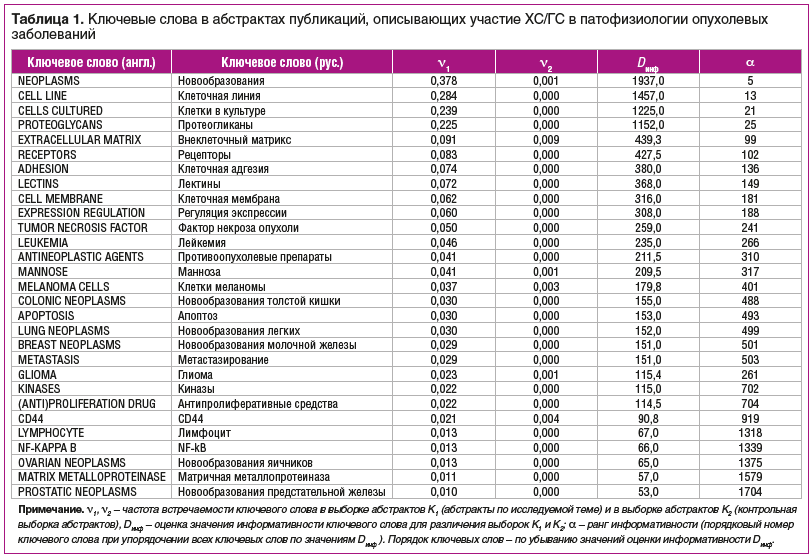
Анализ полученного списка наиболее информативных ключевых слов (табл. 1), составленного на основе анализа всего массива публикаций результатов клинических, биохимических, экспериментальных исследований ХС/ГС, позволяет утверждать, что ХС/ГС, участвуя в формировании протеогликанов внеклеточного матрикса, лектинов и в клеточной адгезии, также влияют на формирование новообразований и метастазирование опухолей различных типов (лейкемия, меланома, глиома, новообразования толстой кишки, легких, молочной железы, яичников, предстательной железы).
Важными молекулярными механизмами противоопухолевого действия ХС/ГС, приводящими к апоптозу линий опухолевых клеток, являются активация рецептора CD44 (приводящая к ингибированию эффектов NF-kB, фактора некроза опухоли, матричных металлопротеиназ), гликозилирование рецепторов, регуляция экспрессии генов. Поэтому ХС/ГС могут являться ценным дополнением к адъювантной терапии с использованием противоопухолевых препаратов, в т. ч. антипролиферативных средств и ингибиторов различных киназ.
Дальнейший анализ информативных ключевых слов с последующей рубрикацией текстов исследований по диагнозам МКБ-10 позволил охарактеризовать опухолевые патологии, ассоциированные с нарушениями обмена ХС/ГС и описанные в исследуемый выборке из 5129 публикаций (рис. 1).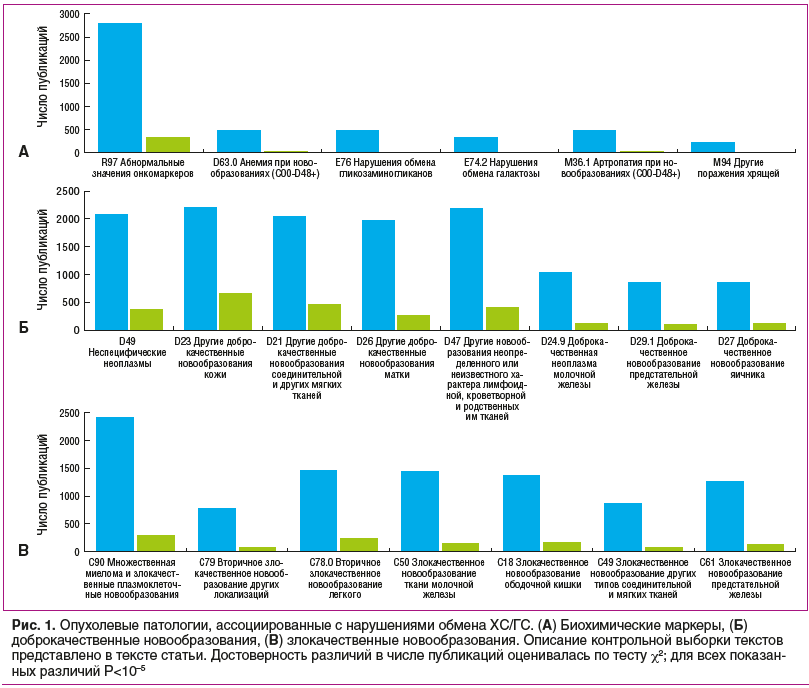
Далее мы последовательно рассмотрим молекулярные механизмы противоопухолевого действия ГС, механизмы противоопухолевого действия ХС (в частности, роли паттернов сульфатирования ХС) и результаты нескольких крупномасштабных клинико-эпидемиологических исследований противоопухолевых эффектов ХС/ГС.
Молекулярные механизмы противоопухолевого действия ГС: воздействие на провоспалительные цитокины
В эксперименте пероральный прием олигомеров ГС и N-ацетил-D-глюкозамина приводил к торможению развития опухолей. По сравнению с контролем олигомеры ГС значительно подавляли рост опухоли у мышей и стимулировали выраженный апоптоз опухолевых клеток на фоне более высоких уровней интерлейкина-12 и интерферона-гамма, что указывает на активацию врожденного противоопухолевого иммунитета [14].
ГС ингибирует экспрессию ЦОГ-2 и провоспалительного интерлейкина ИЛ-8 в клетках линии MCF-7 рака молочной железы человека. ГС эффективно подавляет активацию экспрессии генов ЦОГ-2 и ИЛ-8, вызываемую протеинкиназой С (РКС), синтез простагландина Е2 и ИЛ-8. ГС также способствовал деградации белков ЦОГ-2 и ИЛ-8 кальпаин-зависимым и протеасом-зависимым образом при участии сигнального пути NF-kB. ГС ослаблял PKC-опосредованное фосфорилирование, снижая активацию NF-kB через рецептор CD44, что значительно ингибировало рост трансплантатов рака молочной железы в эксперименте [15]. ГС также ингибирует опосредованную IL-1-бета продукцию IL-8 в клеточных линиях DU-145 и PC-3 рака предстательной железы [16].
Противоопухолевая активность ГС проявляется посредством ингибирования глобального N-связанного гликозилирования — посттрансляционной модификации, которая важна для стабильности и функции внутриклеточных белков. Клетки линии DU145 (карцинома предстательной железы человека) экспрессируют IL-6, что активирует передачу сигналов по каскаду IL-6/STAT3. Субъединицы рецептора IL-6 (белок gp130) подвергаются N-гликозилированию. ГС уменьшал N-гликозилирование рецепторов gp130, связывание IL-6 с клетками и фосфорилирование сигнальных белков JAK2, SHP2 и STAT3 [17], что способствовало снижению популяции опухолевых клеток 3 исследованных линий (рис. 2). Инактивируя белок STAT3, ГС также снижает жизнеспособность клеток — предшественников рака молочной железы человека [18].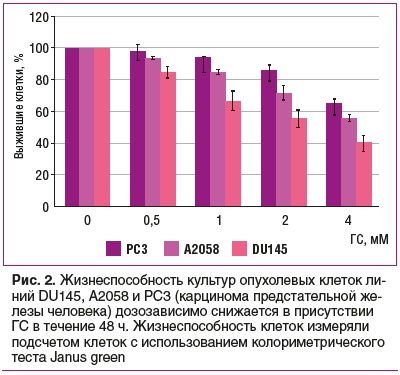
Противораковое действие ГС также проявляется посредством индуцированной глюкозамином модификации O-гликозилирования, что приводит к ингибированию фосфорилирования сигнальным белком FOXO и, как результат, ингибированию активности сигнальных путей PI3K/AKT и MAPK/ERK [19].
Молекулярные механизмы противоопухолевого действия ГС: другие механизмы
Помимо воздействия на гликозилирование и ингибирования NF-kB, приводящего к ослаблению эффектов ФНО-α и других провоспалительных цитокинов, противоопухолевые эффекты ГС могут осуществляться и посредством других молекулярных механизмов.
Например, ГС ингибирует метаболизм тимидина в опухолевых клетках. Глюкозамин ингибирует поглощение тимидина, фосфорилирование тимидина и увеличивает утечку тимидина во внеклеточное пространство. Глюкозамин также напрямую ингибирует фермент тимидинкиназу [20]. Уменьшая доступный для опухоли пул уридиновых нуклеотидов, эти эффекты ГС способствуют гибели опухолевых клеток [21].
Антипролиферативное действие ГС в опухолевых клетках связано с остановкой цикла клеточного деления в фазе G0/G1. ГС дозозависимо ингибировал пролиферацию опухолевых клеток линий 786-O и Caki-1 рака почки (рис. 3) и стимулировал апоптоз опухолевых клеток. Экспрессия регуляторных белков Cyclin D1, CDK4 и CDK6, которые способствуют фазовому переходу G1/S во время пролиферации, была значительно подавлена на фоне повышения уровней ингибиторов клеточного цикла p21 и p53 [22].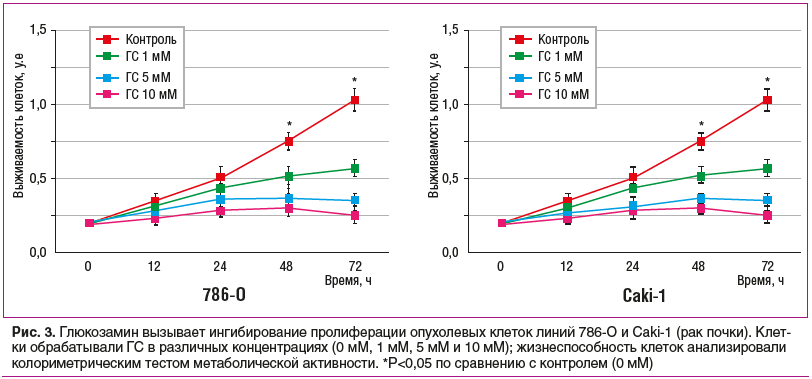
Производное глюкозамина (молекула NCPA) индуцирует экспрессию ингибитора сериновой протеазы Maspin — белка-супрессора опухолей при различных типах рака, в т. ч. при раке простаты. Производное глюкозамина блокирует пролиферацию клеток линии PC3, не чувствительных к андрогенам, ингибируя продукцию циклина-D1 и индуцируя апоптоз опухолевых клеток [23].
ГС стимулирует гибель опухолевых клеток посредством ингибирования протеасом. В клетках рака предстательной железы человека линии ALVA41 ингибирование протеасомной активности приводило к накоплению убиквитинированных белков с последующей индукцией апоптоза. ГС снижал активность PA28 — белка — активатора протеасом через O-гликозилирование белков [24].
ГС вызывает аутофагическую гибель опухолевых клеток посредством стимуляции стресса в эндоплазматическом ретикулуме (ЭР-стресс) опухолевых клеток. В экспериментах на культуре клеток глиомы человека линии U87MG ЭР-стресс, вызванный ГС, проявлялся в индукции экспрессии генов BiP, IRE1-альфа и фосфо-eIF2-альфа, что соответствует торможению пролиферации и инициации апоптоза опухолевых клеток [25].
Производное ГС, фенилглюкозамин, инактивирует рецептор андрогенов в опухолевых клетках мочевого пузыря при участии микроРНК mir-449a, что снижает пролиферацию андроген-зависимых клеток карциномы мочевого пузыря [26].
В клетках линий DU145 (рак предстательной железы) и MDA-MB-231 (рак молочной железы) ГС тормозит пролиферацию посредством ингибирования p70S6K —
сигнального белка, участвующего в трансляции всех белков. Глюкозамин уменьшал фосфорилирование белка p70S6K и его субстратов RPS6 и eIF-4B. Кроме того, глюкозамин усиливал эффекты ингибирования пролиферации рапамицином, специфическим ингибитором белка mTOR [27].
N-ацетилглюкозамин стимулирует апоптоз клеток опухолей легкого посредством фактора TRAIL и активации белка DR-5. Белок TRAIL является потенциальным противораковым агентом. Однако многие клетки немелкоклеточного рака легких (NSCLC) частично устойчивы к TRAIL, что ограничивает его клиническое применение. В эксперименте совместное применение белка TRAIL и N-ацетилглюкозамина увеличивало накопление и кластеризацию DR5, что, в свою очередь, активировало проапоптотическую каспазу-8. N-ацетилглюкозамин способствовал кластеризации рецептора DR5 путем улучшения его O-гликозилирования [28].
Молекулярные механизмы противоопухолевого действия ХС
ХС ингибирует пролиферацию клеток посредством (1) увеличения экспрессии ингибитора циклин-зависимой киназы (CDKN1, белок p21), (2) увеличения апоптоза за счет активации каспазы-3, (3) подавления экспрессии фактора роста эндотелия сосудов (VEGF), (4) увеличения экспрессии тканевого ингибитора металлопротеиназы-1 (TIMP-1) и подавления матриксных металлопротеиназ. Эти эффекты, сопровождающиеся значительным ингибированием сигнального пути NF-kB [29], характерны и для ГС, и для ХС.
Одним из важных аспектов противоопухолевого действия ХС является инкапсуляция опухолей. Микроокружение опухоли является привлекательной терапевтической мишенью для лечения рака. Эндогенный ХС как часть клеточной микросреды состоит из длинных линейных цепочек повторяющихся дисахаридных звеньев, ковалентно связанных с белками с образованием ХС-протеогликанов [30].
Резко повышенные уровни ХС наблюдаются в стромальном компартменте многих солидных опухолей, включая рак молочной железы. Это обусловлено, по всей видимости, тем, что ХС ингибирует инвазию опухоли и защищает окружающие ткани от метастазирования. Например, в моделях опухолей мозга ХС-протеогликаны вызывают выход реактивных астроцитов из опухолевой массы, что приводит к инкапсуляции опухолевых поражений. Формирующаяся астроглиотическая капсула ингибирует инвазию опухоли [31].
В эксперименте было показано, что разрушение капсулы, сформированной из ХС вокруг новообразований, ускоряет рост опухолей и способствует метастазированию. Например, ферментативная элиминация эндогенного ХС, проводимая посредством внутриопухолевых инъекций хондроитиназы ABC, приводила к увеличению метастазирования и ускоренному росту вторичных опухолей [30].
Эксперименты на культуре клеток также подтверждают противоопухолевые эффекты ХС. Дисахариды ХС показали противоопухолевый потенциал по отношению к клеткам рака толстой кишки человека [32]. В экспериментах на клетках линии HT-1376 (опухоли мочевого пузыря) ХС усиливает противоопухолевую активность гемцитабина и митомицина-С. ХС приводил к ингибированию роста опухолевых клеток на 50% через 72 ч. Комбинация ХС + гемцитабин в соотношении 1:1 индуцировала апоптоз опухолевых клеток посредством активации каспазы-9 и каспазы-3 [33].
Паттерны сульфатирования и противоопухолевое действие ХС
Противоопухолевые эффекты эндогенных и экзогенных ХС могут зависеть от паттернов сульфатирования ХС. Начальная стадия инвазии состоит в прикреплении опухолевой клетки к внеклеточному матриксу через эндогенные молекулы ХС. При этом образуется С-концевой внутриклеточный фрагмент N-кадгерина, взаимодействующий с бета-катенином. Эти эффекты существенно зависят от длины цепи и характера сульфатирования молекулы ХС. Делеция гена хондроитин-4-O-сульфотрансферазы-1 (C4ST-1), который увеличивает 4-O-сульфатирование ХС и длину цепи ХС, подавляет активацию пути N-кадгерин /бета-катенин посредством эндоцитоза N-кадгерина и значительно уменьшает инвазию клеток BT-549 [34].
Следует отметить, что во время прогрессирования и метастазирования рака эндогенные ХС в строме опухолей претерпевают аномальные изменения в составе и в структуре: уменьшается соотношение между дерматансульфатом и ХС, изменяется паттерн сульфатирования ХС [35]. В опухолевых клетках наблюдаются нарушения экспрессии различных ферментов, синтезирующих эндогенные ХС и дерматан сульфаты. В частности, повышается экспрессия дерматансульфат-эпимеразы, хондроитин-синтазы I, хондроитин-4-сульфотрансфераз CHST11, CHST12 и CHST15 [36], фактора полимеризации хондроитина в опухолях и снижается экспрессия хондроитин-6-сульфотрансферазы 3 [37].
Клинические исследования показали, что пациенты с опухолями шеи выделяют с мочой ХС низкой степени сульфатирования [38]. Отмечена корреляция между содержанием несульфатированных дисахаридов и стадией прогрессирования опухолей [39]. Повышенная экспрессия несульфатированного хондроитина коррелирует с неблагоприятными клинико-патологическими параметрами при раке предстательной железы, включая более тяжелую стадию заболевания, более высокий балл по шкале Глисона и более высокий уровень простатспецифического антигена (ПСА) [40].
Таким образом, особенности сульфатирования ХС связаны с состоянием пациентов с опухолевыми заболеваниями. Систематический экспериментальный анализ дисахаридов ХС, проведенный в исследовании [41], позволил выявить паттерны сульфатирования ХС, которые способствуют ингибированию опухолей молочной железы. Для этого были синтезированы молекулы дисахаридов ХС, соответствующие 16 возможным паттернам сульфатирования, затем было изучено их влияние на опухолевые клетки [41]. Результаты показали достоверное увеличение активности каспазы-3 и каспазы-7 при обработке клеток линии MDA-MB-231 (рак молочной железы) ди- и трисульфатированными дисахаридами ХС.
Первичные карциномы яичников и их метастазы содержат 4,6-дисульфатированные ХС, которые способствуют адгезии опухолевых клеток [42]. В то же время эксперименты на культуре клеток показали, что хондроитин-4,6-сульфат (известен также как ХС-Е, ХС-4,6) снижает подвижность опухолевых клеток (рис. 4) и ингибирует проонкогенную передачу сигналов по каскаду Wnt/бета-катенин [43].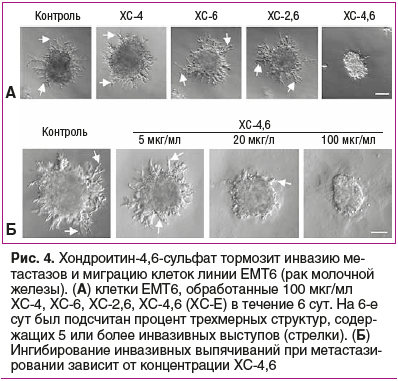
Торможение активности каскада Wnt — важный механизм противоопухолевого действия дисульфатированного ХС-4,6. В отсутствие стимуляции Wnt3a уровни бета-катенина были низкими и наблюдались в основном в мембране опухолевых клеток линий EMT6 и 4T1 (рак молочной железы, рис. 5). Активация каскада Wnt3a приводила к резкому увеличению уровня бета-катенина в клеточном ядре. Добавление ХС-4,6 к среде значительно снижает уровни бета-катенина, подтверждая, что ХС-4,6 является мощным ингибитором передачи сигналов Wnt/бета-катенин в клетках рака молочной железы [43].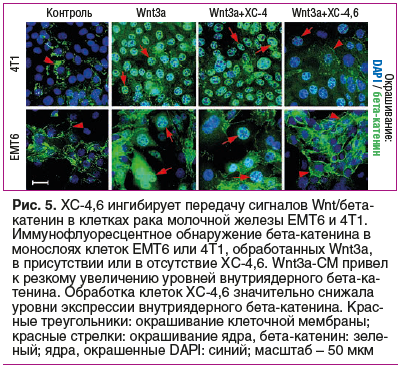
В целом различия в длине цепи и паттерне сульфатирования ХС оказывают влияние на проявление противоопухолевых свойств ХС. Оптимальная длина цепей ХС в высокоочищенной фармацевтической субстанции CS Bioactive© (Биоиберика, С.А.У., Испания) обеспечивает медленное высвобождение коротких олигосахаридов. Соотношение различных форм сульфатирования ХС в фармацевтической субстанции CS Bioactive© (Биоиберика, С.А.У., Испания) (60% ХС-4, 30% ХС-6) [44] обеспечивает эффективную работу хондроитиназы, карбогидрат сульфотрансферазы и других ферментов, которые диверсифицируют паттерн сульфатирования синтезируемых из ХС олигосахаридов (способствуя в т. ч. синтезу ХС-4,6). Синтезируемые таким образом дисахариды ХС избирательно накапливаются в опухолевой ткани, проявляя описанные выше эффекты.
Клинико-эпидемиологические исследования противоопухолевых эффектов ХС/ГС
Разносторонние молекулярные механизмы противоопухолевого действия ГС, установленные в ходе фундаментальных исследований, указывают на перспективность использования ХС и ГС в профилактике и терапии опухолевых заболеваний. Очень важной характеристикой молекул ГС и ХС является их таргетное накопление в опухолевой ткани. Например, наногели ХС-метотрексат значительно повышают растворимость и улучшают эффективность доставки метотрексата к опухоли благодаря связыванию ХС с рецептором CD44 [45]. ГС и N-ацетилглюкозамин являются перспективными контрастными веществами для проведения МРТ при визуализации опухолей, т. к. оба вещества нетоксичны и имеют тенденцию дозозависимо накапливаться и удерживаться в области опухоли [46].
Результаты крупномасштабного клинического эпидемиологического «Исследования по профилактике рака II» (Cancer Prevention Study II Nutrition Cohort, n=113 067) показали, что регулярное употребление ГС снижает риск развития колоректального рака. За группой наблюдали в течение 10 лет, за этот период было зарегистрировано 1440 случаев заболевания. Прием ГС был ассоциирован с более низким риском заболевания (ОР 0,83; 95% ДИ 0,71–0,97), чем в контрольной группе [47].
Регулярное использование ГС/ХС в крупномасштабном исследовании здоровья медсестер (n=65 000) было ассоциировано с более низким риском заболеваемости колоректальным раком. За 8 лет наблюдений было зарегистрировано 672 случая заболевания. Регулярное потребление ГС было связано с 21% снижением риска (ОР 0,79; 95% ДИ: 0,63–1,00), ХС — с 23% снижением риска (ОР 0,77; 95% ДИ: 0,59–1,01). Ассоциации сохранялись после поправок на пол, использование аспирина, ИМТ, физическую активность, что указывает на антипролиферативный и онкопрофилактический потенциал ХС/ГС [48].
Все описанные выше противоопухолевые эффекты ХС и ГС подразумевают, что используются высокоочищенные формы ХС/ГС. Кроме того, препараты ХС должны быть стандартизированы по молекулярной массе и по паттернам сульфатирования. Наличие в препаратах ХС/ГС посторонних примесей (особенно белкового происхождения) будет провоцировать развитие аутоиммунных реакций, препятствующих развитию противовоспалительного и противоопухолевого эффектов ХС и ГС [49], приводить к вторичному синовиту [50] и др.
Посторонние белковые примеси в составе нестандартизированных экстрактов ХС природного происхождения будут провоцировать развитие провоспалительных реакций. Воспалительные клетки и медиаторы воспаления являются ключевым компонентом микроокружения опухоли и способствуют ее развитию [51]. Собственно, именно поэтому ингибиторы провоспалительных киназ и используются как противоопухолевые средства [52].
Наглядной иллюстрацией опасности использования нестандартизированных препаратов ХС, содержащих посторонние белковые примеси, является опубликованный в литературе случай из практики. Инъекции гликозамингликан-пептидного комплекса (Арумалон) пациентке 62 лет с дегенеративными изменениями тазобедренного сустава привели к тяжелым осложнениям: температура до 39 °С, отеки пальцев, суставов рук и колен, сыпь на коже, повышение уровней лейкоцитов и 2–3-кратное повышение уровней печеночных ферментов в крови. Эффект нестандартизированного препарата ХС был подтвержден положительным тестом на трансформацию лимфоцитов в культуре и наличием специфических антител в культивируемой жидкости лимфоцитов, в то время как сыворотка была отрицательной для антител. Только через 1 год после приема поддерживающей дозы преднизона (15 мг/сут) пациентка полностью избавилась от описанной симптоматики. Таким образом, нестандартизированные препараты ХС, особенно с нестандартизированными белковыми примесями животного происхождения, имеют повышенный риск системных побочных эффектов [53].
Заключение
Такие микронутриенты, как ХС и ГС, оказывают многогранное воздействие на организм. Молекулы ХС и ГС вырабатываются хондроцитами и являются одними из основных структурных компонентов хряща и синовиальной жидкости. Кроме восстановления соединительной ткани ХС и ГС проявляют противоболевой, противовоспалительный, иммуномодулирующий, антипролиферативный и другие эффекты. Противоопухолевое действие ХС/ГС распространяется на различные типы опухолей (глиома, рак толстой кишки, легких, молочной железы, яичников, предстательной железы, почек, мочевого пузыря и др.). И ХС, и ГС взаимодействуют с рецептором CD44, способствуя снижению хронического воспаления, торможению пролиферации и стимулированию апоптоза опухолевых клеток.
Кроме того, молекула ГС ингибирует метаболизм тимидина в опухолевых клетках, модулирует процессы гликозилирования белков, тормозит цикл клеточного деления, ингибирует протеасомы, вызывает аутофагическую гибель опухолевых клеток посредством стимуляции стресса в эндоплазматическом ретикулуме, инактивирует рецептор андрогенов, что также способствует специфической противоопухолевой активности.
Молекулы ХС стимулируют апоптоз опухолевых клеток, подавляют экспрессию фактора роста эндотелия сосудов фактор (VEGF) и активность матриксных металлопротеиназ, ингибируют активность каскада Wnt/бета-катенин. Способствуя инкапсуляции опухолевых образований, молекулы ХС тормозят процесс метастазирования. Имеющиеся данные крупномасштабных клинических исследований указывают на перспективность использования ХС/ГС для долговременной профилактики опухолевых заболеваний.
Перспективными направлениями дальнейших исследований являются (1) хемокиномный анализ свойств молекулы ГС, который позволит соотнести эффекты ГС с эффектами известных противоопухолевых препаратов — ингибиторов киназ, (2) хемотранскриптомное исследование эффектов ГС в отношении опухолевых клеток (например, клеток линии MCF7 рака молочной железы), которое позволяет рассмотреть противоопухолевое воздействие ГС на транскриптом опухолевых клеток человека, (3) хемореактомное моделирование эффектов воздействия ГС и молекул сравнения на различные линии опухолевых клеток в культуре.
Работа выполнена при поддержке грантов РФФИ 18–07–01022, 18–07–00944, 16–29–12936.
Информация с rmj.ru

