Хемотранскриптомный анализ молекулы глюкозамина сульфата в контексте постгеномной фармакологии
Содержание статьи
Введение
Для получения полной информации о механизме действия изучаемой молекулы важно рассматривать влияние этой молекулы на геном, транскриптом, протеом, метаболом и реактом [1–3].
Воздействия лекарственных средств на геном, транскриптом, протеом и метаболом изучаются постгеномной фармакологией. Большинство лекарств, как правило, воздействуют на активность тех или иных белков протеома, что, в свою очередь, оказывает воздействие на метаболом, реактом и, наконец, состояние генома.
Поиск в базе данных транскриптомных исследований GEO [4] показал, что всего представлено 2721 исследование эффектов 725 лекарств и потенциальных лекарств для тех или иных видов клеток. В то же время известно более 9335 лекарств [5], а число видов клеток в организме человека превышает 200. Таким образом, данные о транскриптоме доступны менее чем для 10% лекарств.
В наших предыдущих работах был проведен протеомный [1] и хемореактомный [2] анализ эффектов молекулы кристаллической субстанции глюкозамина сульфата (ГС), препарата Сустагард® Артро (производства компании «Биоиберика, С.А.У.», Испания). Протеомный анализ молекулярных механизмов действия ГС — действующего вещества препарата Сустагард® Артро — показал, что ГС взаимодействует с рецепторами CD44, TLR4 и ICAM1 на поверхности хондроцитов, ингибирует провоспалительный транскрипционный ядерный фактор «каппа-би» (nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κВ), цитокиновый сигнальный путь JAK/STAT, регулирует синтез иммуноглобулина A в кишечнике, миграцию лейкоцитов, активность рецепторов гематопоэтина и интерферонов. Дифференциальный хемореактомный анализ ГС и ряда нестероидных противовоспалительных препаратов (НПВП) показал, что декскетопрофен и, в меньшей степени, кеторолак наиболее эффективно дополняют противовоспалительные свойства ГС [1, 2].
В постгеномной парадигме большинство лекарств являются ингибиторами белков и оказывают непосредственное (как правило, достаточно быстрое), «тактическое» действие (минуты-часы) именно за счет модуляции активности тех или иных конкретных белков протеома. Например, ацетилсалициловая кислота и НПВП ингибируют фермент циклооксигеназу-2 (ЦОГ-2), что снижает синтез провоспалительных простагландинов. В то же время белки синтезируются на основе информации, закодированной в геномной ДНК. Первым шагом в синтезе любого белка является транскрипция соответствующего гена, т. е. синтез матричной РНК, соответствующей гену. После транскрипции гена образованная матричная РНК транслируется рибосомами, т. е. осуществляется собственно синтез белка. Таким образом, воздействие лекарства на транскрипцию генов обусловливает более долговременные эффекты этого лекарства (часы-дни). Соответственно, воздействие лекарств на транскрипцию как бы подготавливает клетку к последующей активности посредством привнесения определенных «стратегических» изменений в транскрипции всего генома [6, 7].
Накопленный фармакологический опыт показывает, что далеко не для всякого лекарства характерна синергия в том смысле, что молекула этого лекарства оказывает надлежащее «тактическое» воздействие на протеом и соответствующее «стратегическое» действие на транскриптом. Например, некоторые противоопухолевые средства ингибируют транскрипцию генов, ассоциированных с ростом опухолей (что и обусловливает основное фармакологическое действие молекул). Вместе с тем те же самые молекулы ингибируют многочисленные белки протеома (что приводит к тяжелым побочным эффектам). Поэтому в современной биомедицине важно учитывать воздействие исследуемого лекарства и на протеом, и на транскриптом.
В базе данных GEO [4] накоплены результаты более чем 160 тыс. транскриптомных исследований (всего более 50 тыс. терабайт данных). С использованием новейших методов искусственного интеллекта для анализа «сверхбольших данных» (big data) в Институте фармакоинформатики при ФИЦ ИУ РАН был разработан метод хемотранскриптомного анализа эффектов молекул, основанный на современных методах машинного обучения [8–14].
Цель данного исследования — проведение хемотранскриптомного анализа дозозависимых эффектов воздействия ГС на транскрипцию 12 700 аннотированных генов человека в фибробластах линии FIBRNPC.
Материал и методы
Методики культивирования фибробластов приведены в работе A. Subramanian et al. (2017) [15]. Результаты транскриптомных экспериментов в базе данных GEO представлены в виде таблиц, столбцам которых соответствуют гены, а строкам — соответствующие воздействия на клетку (например, те или иные молекулы). Элементами таблиц являются изменения экспрессии гена при соответствующем воздействии. Каждой такой таблице транскриптомного эксперимента соответствуют: 1) тип клеток, для которых изучались изменения экспрессии; 2) интенсивность воздействия (прежде всего, концентрации воздействующих молекул); 3) время воздействия (6, 12, 24 ч и т. д.). Изменения экспрессии оцениваются относительно контрольных образцов (как правило, содержащих диметилсульфоксид) [15].
При задании (1) типа клеток (например, фибробласты), (2) концентрации и (3) времени воздействия каждый столбец такой таблицы соответствует химической реакции «Генi → мРНКi», в результате которой осуществляется синтез i-й молекулы мРНКi, соответствующей i-му гену (Генi). Данные, содержащиеся в таком столбце таблицы 1 транскриптомного эксперимента, включающей информацию об изменении экспрессии N генов при воздействии n молекул, могут рассматриваться как описание определенного элемента реактома (совокупности всех химических реакций). Соответственно, становится возможным применение теории хемографов [8, 9], методологии хемоинформационного [10] и хемореактомного анализа [11–14] для осуществления хемотранскриптомного моделирования.
Хемотранскриптомный анализ
Данный анализ осуществляется методами, основанными на комбинаторной теории разрешимости [7–9, 14, 16]. Решаются задачи распознавания изменений экспрессии различных констант (оцениваемых в количественных значениях математического ожидания и дисперсии функции распределения). На третьем этапе анализа для исследуемой молекулы для каждого гена вычислялись оценки активации или депривации при различных концентрациях исследуемой молекулы. Методами регрессионного анализа определяли достоверные дозозависимые изменения экспрессии в диапазоне исследуемых концентраций (0,01–10 мкмоль/л). Для каждого из отобранных трендов устанавливался знак изменения экспрессии i-го гена («+»-тренд — достоверное повышение экспрессии при увеличении концентрации ГС, «-»-тренд — достоверное снижение экспрессии i-го гена при увеличении концентрации ГС, действующего начала препарата Сустагард® Артро) и соответствующие трендам гены подразделялись на список генов, для которых показано повышение экспрессии («Список+») и снижение экспрессии («Список-»).
Системно-биологический анализ
Списки генов с достоверным повышением или снижением экспрессии генов, которые были получены в результате применения описанного выше хемотранскриптомного подхода, анализировались посредством метода функционального связывания [3]. Анализ проводился с использованием международной номенклатуры Gene Ontology (GO), описывающей физиологические функции генов и соответствующих белков. Данный метод основан на системном рассмотрении органов, тканей, клеток и их мельчайших компонентов (белков, ДНК, метаболитов) в рамках фундаментальных основ молекулярной биологии и биохимии. Так, на основе информации определенной геномной ДНК синтезируется соответствующий белок, выполняющий строго очерченный круг специфических функций. Как мутации гена, так и дефициты кофакторов белка (ионов металлов — кальция, магния, цинка; витаминов группы B и др.) будут приводить к падению активности тех или иных белков и проявлению той или иной специфической клинической симптоматики [3].
Метод анализа функциональных взаимосвязей, соединяя данные различных уровней (данные о моногенных заболеваниях, биохимические данные о кофакторах белков, данные о клеточной роли белков, симптоматику и критерии диагностики заболеваний и т. д.), позволяет систематически рассмотреть все возможные функциональные эффекты воздействия ГС на транскрипцию каждого из генов. В целом при использовании метода анализа функциональных взаимосвязей для каждого гена человека составляется аннотированная таблица изменений экспрессии генов, включающая следующие описания:
соответствующий гену белок;
список биохимически необходимых эссенциальных кофакторов белка (в т. ч. с указанием потребности ионов кальция для активности рассматриваемого белка);
список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка;
список клеточных функций белка (по номенклатуре GO и др.);
список отдельных симптомов заболеваний, список диагнозов по МКБ-10 и другую информацию из баз данных.
Далее в полученной таблице выделяются гены, частота встречаемости функциональных описаний которых существенно отличается при достоверном повышении экспрессии по сравнению с достоверным снижением экспрессии, и проводится последующий анализ их функций на основании статистических критериев. Для статистической обработки результатов исследования используются методы математической статистики, включающие расчет числовых характеристик случайных величин, проверку статистических гипотез с использованием параметрических и непараметрических критериев, корреляционного и дисперсионного анализа. Сравнение прогнозируемых и наблюдаемых частот встречаемости исследуемых признаков проводится с помощью критерия χ2, T-критерия Вилкоксона —
Манна — Уитни и теста Стьюдента.
Результаты
Хемотранскриптомный анализ эффектов молекулы ГС на транскриптом фибробластов линии FIBRNPC (инкубация в течение 24 ч) показал достоверные дозозависимые эффекты ГС в отношении транскрипции 6535 из 12 700 аннотированных генов человека. Достоверные изменения транскрипции (p
В ходе проведения системно-биологического анализа этих двух списков генов («Список-» и «Список+») были выявлены: различия в частоте встречаемости ключевых слов в описаниях генов (данные UNIPROT), функциональных категорий генов/белков по номенклатуре GO (Gene Ontology), встречаемости различных кофакторов, встречаемости экспрессии генов в различных видах тканей; ассоциированные с генами заболевания и элементы реактома человека. Для установления детальных закономерностей в группах генов, экспрессия которых дозозависимо повышалась или снижалась при моделировании воздействия ГС, был проведен сравнительный системно-биологический анализ двух списков генов («Список-» и «Список+»). С использованием категорий международной номенклатуры GO, описывающей функции генов и соответствующих белков, было выявлено по меньшей мере
47 категорий GO, частота встречаемости которых достоверно отличается между двумя списками.
Экспертный анализ, основанный на результатах анализа ключевых слов, позволил рубрицировать эти 47 категорий в 7 функциональных групп генов, для которых отмечены выраженные отличия в частоте встречаемости: «Факторы воспаления», «Восстановление хряща и кости», «Деление клеток», «Антибактериальный/антивирусный иммунитет», «Детоксикация», «Нейропротекция» и «Кардиопротекция» (табл. 1). На рисунке 1а отражены профили частот встречаемости генов этих 7 функциональных групп в зависимости от количественного изменения экспрессии (на 1 мкмоль ГС).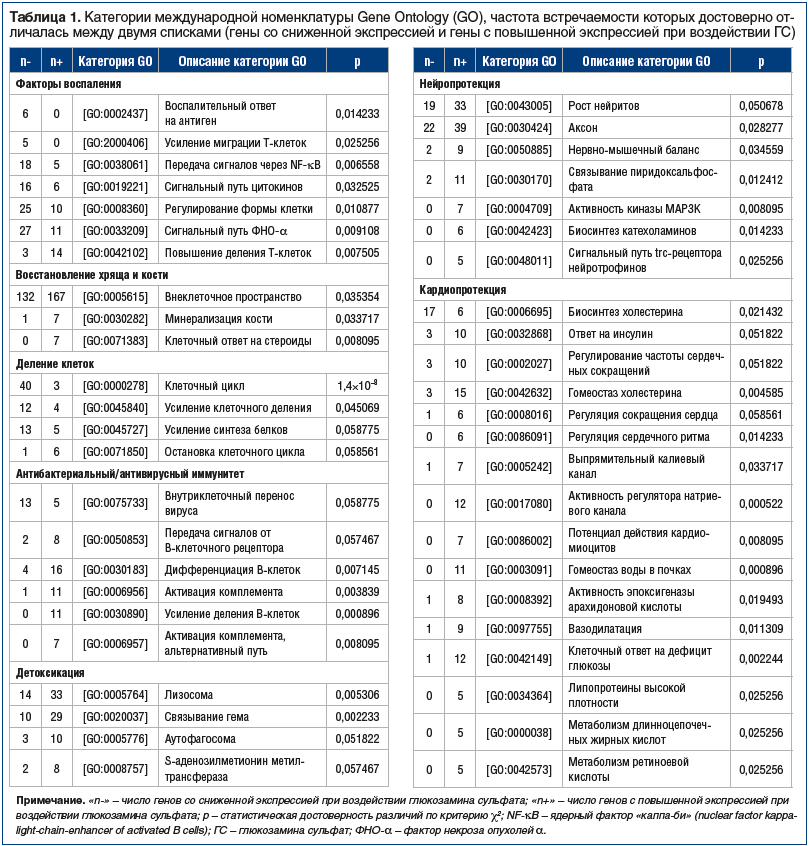
На рисунке 2 отражены числа генов «n-» и «n+», соответствующие функциональным категориям генов, перечисленным в таблице 1. Анализ линейных аппроксимаций профилей частот встречаемости генов 7 функциональных групп (рис. 1б) и данных рисунка 2 позволяет утверждать очевидное систематическое снижение экспрессии генов из групп «Факторы воспаления» и «Деление клеток». В то же время экспрессия генов из групп «Антибактериальный/антивирусный иммунитет», «Детоксикация», «Нейропротекция» и «Кардиопротекция» систематически возрастает.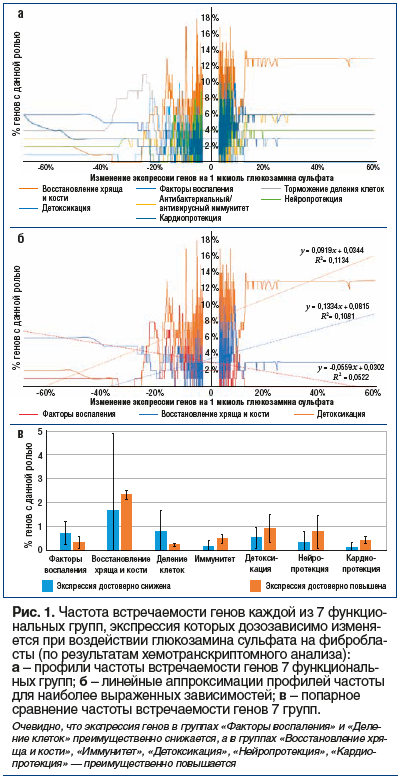
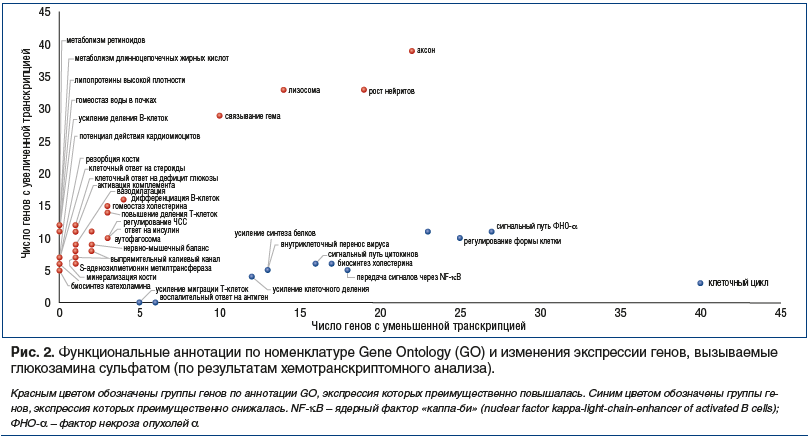
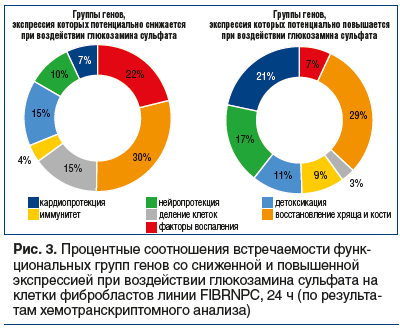
Таким образом, гены, экспрессия которых дозозависимо повышается при воздействии ГС, существенно отличаются по своим биологическим функциям от генов, экспрессия которых дозозависимо понижается (рис. 1, 3, табл. 1). На наш взгляд, установленные изменения транскрипции имеют важную физиологическую интерпретацию.
Нами были применены и прочие подходы к системно-биологическому анализу двух полученных списков генов («Список-» и «Список+»), которые подтвердили приведенные выше выводы об общем направлении транскриптомного действия ГС. Например, анализ встречаемости белковых кофакторов показал, что ГС способствовал преимущественному повышению экспрессии генов, которые кодируют белки с такими кофакторами, как гем (64 гена, p=5,58×10–5), флавинадениндинуклеотид (69 генов, p=0,005949) и ион Mg2+ (232 гена, p=0,046239). Все перечисленные кофакторы играют важную роль в поддержании клеточного дыхания и энергетического метаболизма фибробластов и других видов клеток.
Фибробласты синтезируют соединительнотканную основу различных тканей и, следовательно, представлены практически во всех тканях. Анализ встречаемости экспрессии генов в различных видах тканей подтверждает, что ГС способствует поддержанию метаболизма «энергоемких» тканей. Проведенный нами анализ показал, что ГС способствовал преимущественному повышению экспрессии генов в головном мозге (458 генов, p=3,04×10–5), печени (345 генов, p=0,00259), почках (363 гена, p=1,35×10–5), мышцах (314 генов, p=0,054343), надпочечниках (45 генов, p=0,00177) и сетчатке глаза (45 генов, p=0,000231), в т. ч. в клетках-фоторецепторах (9 генов, p=0,00267).
Также мы провели анализ полученных списков генов с точки зрения отношения соответствующих этим генам белков к различным каскадам реактома человека. Анализ показал, что ГС приводит к достоверным изменениям экспрессии генов, кодирующих белки 229 каскадов реактома человека. Детальный анализ списка этих 229 каскадов подтвердил, что ГС приводит к снижению экспрессии генов, участвующих в процессах деления клетки и транскрипции ДНК («Разматывание ДНК», «Конденсация прометафазных хромосом», «Устранение некомплементарности в ДНК посредством MSH2: MSH3», «Коррекция D-петлевых структур в РНК», «Инициирование репликации ДНК», «PTK6 регулирует клеточный цикл» и др.), нейропротекцией («RUNX3 регулирует сигнализацию WNT», «Катаболизм фенилаланина и тирозина», «Передача сигналов MAPK6/MAPK4», «Кислородозависимое пролин-гидроксилирование фактора, индуцируемого гипоксией», «NRAGE сигнализирует об апоптозе через JNK», «Цикл высвобождения нейротрансмиттера серотонина», «Цикл высвобождения ацетилхолина», «Цикл высвобождения норадреналина» и др.), противовоспалительным действием (снижение экспрессии генов в элементах транскриптома «Dectin-1 опосредованная неканоническая передача сигналов NF-kB», «NIK — неканоническая передача сигналов NF-kB», «FCERI опосредовал активацию NF-kB», «Хемокиновые рецепторы связывают хемокины», «Передача сигналов от рецептора TCR» и др.).
Обсуждение результатов
Описанные выше результаты позволяют сделать несколько важных выводов о транскриптомных эффектах ГС. Во-первых, ГС может способствовать снижению транскрипции генов из функциональных групп «Факторы воспаления» и «Деление клеток». Снижение экспрессии генов, вовлеченных в поддержку факторов воспаления, очевидным образом синергидно с описанным ранее противовоспалительным действием ГС на протеом [1, 2]. Снижение экспрессии группы генов под рубрикой «Деление клеток» соответствует переходу клетки в состояние энергосбережения (т. к. процессы деления клеток весьма энергоемки и на их поддержание расходуется бóльшая часть синтезируемого в клетке АТФ). Очевидно, что режим экономии АТФ способствует повышению энергообеспеченности фибробластов в условиях воспалительного или оксидативного стресса. Иначе говоря, ГС способствует переходу клеток в состояние своего рода «стазиса», при котором выживаемость фибробластов повышается.
Во-вторых, ГС преимущественно повышает экспрессию генов, вовлеченных в синтез компонентов внеклеточного матрикса (повышается экспрессия 167 генов, снижается экспрессия 132 генов). Кроме того, ГС способствует повышению экспрессии генов, вовлеченных в минерализацию кости (p=0,033717) и клеточный ответ на стероиды (p=0,008095). Перечисленные изменения экспрессии генов способствуют восстановлению хряща и кости.
В-третьих, ГС способствует повышению экспрессии генов из функциональных групп «Антибактериальный/антивирусный иммунитет», «Детоксикация», «Нейропротекция» и «Кардиопротекция». Повышение экспрессии этих групп генов соответствует желательным дополнительным эффектам ГС, которые могут быть весьма полезны в терапии коморбидных патологий (данный вопрос более подробно рассматривается в отдельной статье [17]).
Таким образом, хемотранскриптомный анализ эффектов ГС в отношении фибробластов указал на характерные изменения транскрипции генов, способствующие энергосбережению, противовоспалительному действию и кардиопротекции. Важным отличием настоящего исследования от опубликованных ранее транскриптомных исследований производных глюкозамина, например, работы J.N. Gouze et al. (2006) [18], является условие использования фибробластов без какой-либо внешней стимуляции (интерлейкин-1 и т. п.) при разных концентрациях исследуемого вещества. В настоящем исследовании ГС достоверно снижал экспрессию провоспалительных генов, способствовал переходу клетки в состояние энергосбережения, повышал экспрессию генов, вовлеченных в восстановление хряща и кости, и в целом повышал выживаемость фибробластов (рис. 4).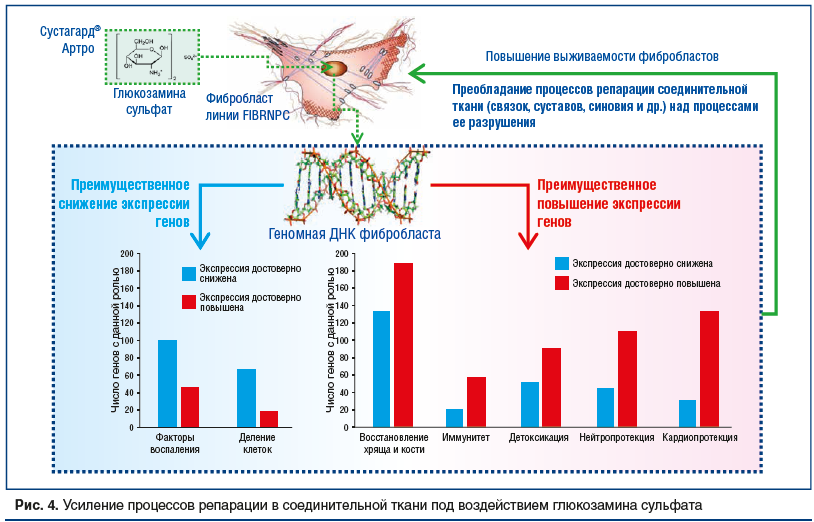
В заключение следует обратить внимание на один важный момент. Как известно, профиль (паттерн) экспрессии генов транскриптома отражает состояние фибробласта в целом. Действительно, процессы транскрипции и сигнальные процессы внутри любой клетки взаимосвязаны. С одной стороны, изменения активности внутриклеточных сигнальных каскадов приводят к изменениям в транскрипции. С другой стороны, изменения в транскрипции стимулируют изменения активности сигнальных каскадов [15].
Что же может являться физическими причинами изменений в транскриптоме, которые были установлены в результате проведения хемотранскриптомного анализа молекулы ГС? Являются ли описанные изменения результатом воздействия ГС на некоторые, еще неизвестные, таргетные белки, которые выступают факторами транскрипции? Или же изменения транскрипции под воздействием ГС отражают изменение состояния фибробластов, обусловленное действием ГС на описанные ранее таргетные белки (рецептор CD44, ингибирование ЦОГ-2 и 5-липоксигеназы, ингибирование ФНО-α, NF-kB и др. [1])? Данный комплекс вопросов весьма сложен и не может быть однозначно разрешен в рамках настоящей статьи.
Заключение
Результаты проведенного нами хемотранскриптомного анализа молекулы ГС (являющейся действующим началом препарата Сустагард® Артро из субстанции компании «Биоиберика С.А.У.», Испания) в отношении экспрессии генов в фибробластах человека (линия FIBRNPC) указали на несколько важных особенностей транскриптомного действия изучаемой молекулы. ГС достоверно снижал экспрессию провоспалительных генов, способствовал переходу клетки в состояние энергосбережения за счет снижения экспрессии генов, участвующих в клеточном делении (митозе), что удлиняло жизненный цикл фибробластов. Также ГС повышал экспрессию генов, вовлеченных в восстановление хряща и кости, и способствовал преимущественному повышению транскрипции групп генов, вовлеченных в кардиопротекцию (134 гена), нейропротекцию (110 генов), детоксикацию (91 ген) и поддержание антивирусного и антибактериального иммунитета (58 генов).
Установленные особенности действия молекулы ГС на транскриптом фибробластов важны для понимания как основного (хондропротекторного) действия ГС, так и для обоснования целесообразности использования ГС у пациентов, страдающих одновременно и патологией хряща, и другими коморбидными заболеваниями (ИБС, аритмии, цереброваскулярная патология, инфекционные заболевания, заболевания печени и почек и др.). Данные свойства ГС имеют большое клиническое значение, поскольку у большинства пациентов с остеоартрозом присутствуют различные коморбидные состояния, влияющие на течение патологического процесса в суставе и возможности терапии [19].
Исследование выполнено при финансовой поддержке гранта РФФИ № 17-07-01419
Информация с rmj.ru