Варианты муколитической терапии кашля у детей
Содержание статьи
Введение
По данным Министерства здравоохранения РФ [1] от 2012 г., частота заболеваемости органов дыхания продолжает неуклонно нарастать как среди взрослого, так и среди детского населения. В 2010 г. зарегистрировано больных детей (с диагнозом, установленным впервые в жизни) в возрасте 0–14 лет 118 173,9 на 100 тыс. детского населения, в 2011 г. — 121 547,6. Среди всего населения, по данным Росстата [2], в 2015–2016 гг. впервые выявленная заболеваемость органов дыхания составила на 100 тыс. 38 612,1 и 40 055,2 человека соответственно. Закономерно возрастает и количество препаратов, которые назначаются врачом и/или применяются родителями самостоятельно для лечения респираторных заболеваний, чаще всего острых респираторных инфекций (ОРИ). А так как одним из самых частых симптомов ОРИ является кашель, то именно с жалобами на кашель к врачу обращаются чаще всего.
Механизм кашлевого рефлекса
Кашлевой рефлекс в первую очередь является защитным механизмом и направлен на очищение дыхательных путей от слизи, микроорганизмов и посторонних предметов. Рефлекс возникает вследствие стимуляции различных рецепторов, расположенных в верхних дыхательных путях (ВДП) и нижних дыхательных путях [3]. Кашлевые рецепторы расположены в основном в гортани, трахее и главных бронхах (рис. 1). Отдельные рецепторы находятся в полости среднего уха, диафрагме и перикарде [4].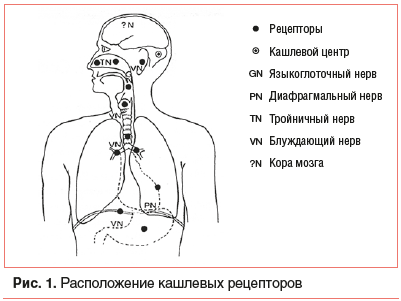
Импульс, возникающий вследствие раздражения рецепторов, передается в центральную нервную систему через систему эфферентных двигательных нейронов блуждающего нерва. Таким образом, кашлевой рефлекс состоит из пяти последовательных звеньев: кашлевого рецептора, афферентных волокон n. vagus, n. trigeminus и n. glossopharyngeus, центра кашля, афферентных волокон n. phrenicus, спинного мозга и n. laryngeus recurrens, диафрагмы, абдоминальных, межреберных и гортанных мышц.
Кашель возникает при раздражении рецепторов блуждающего нерва в кашлевых рефлексогенных зонах, важнейшие из которых расположены в слизистой оболочке гортани, голосовых связках, бифуркации трахеи и в местах деления крупных бронхов (бронхиальных шпор). Основные раздражители кашлевых рецепторов: холодный или сухой вдыхаемый воздух из-за колебаний температуры и влажности, поллютанты, мокрота, назальная слизь, аллергены, воспаление, механические воздействия (инородные тела, давление опухоли), гипервентиляция, гипероксия [5].
Мукоцилиарный клиренс
В норме образование бронхиального секрета и его продвижение в проксимальном направлении — физиологический процесс, составляющий функцию дыхания. Благодаря образующемуся слою бронхиальной слизи вдыхаемый воздух увлажняется, его температура нормализуется. Бронхиальный секрет механически защищает эпителий от микроорганизмов, оказывает бактериостатическое действие. Суточный объем бронхиального секрета в норме составляет от 10–15 до 100–150 мл, в среднем 0,1–0,75 мл на 1 кг массы тела. Однако здоровый человек обычно не ощущает скопления такого количества бронхиального секрета, поскольку путем мукоцилиарного клиренса (МЦК) — физиологического механизма выведения слизи из трахеобронхиального дерева скопившийся секрет выводится. Это обеспечивается за счет скоординированной деятельности реснитчатых клеток в структуре многорядного призматического мерцательного эпителия. Так как скопившийся секрет регулярно выводится, то он не раздражает кашлевые рецепторы и не вызывает кашлевой рефлекс.
На свободной поверхности слизистой оболочки находится около 200 мерцательных ресничек, совершающих 15–16 колебаний в секунду и перемещающих слой слизи со скоростью 4–10 мм в минуту. Контакт слизи с поверхностью клетки очень кратковременный — не превышает 0,1 с. Таким образом, время контакта бактерий/вирусов с клетками слизистой бронхов очень ограниченно, и риск их адгезии, а тем более инвазии внутрь клетки очень незначителен.
Таким образом осуществляется МЦК у взрослых и детей старшего возраста, в отличие от детей раннего возраста. Слизистая оболочка у них более рыхлая, что приводит к более быстрому развитию отека при воспалении, соответственно, и большему образованию секрета. Также частота дыхания у детей выше, что способствует более быстрой потере жидкости, т. е. имеется высокий риск обезвоживания.
Изменения при воспалении
При воспалении происходит раздражение слизистой оболочки, что увеличивает продукцию слизи. Это первый ответ слизистой оболочки трахеобронхиального дерева на внедрение повреждающего инфекционного или неинфекционного агента — воспалительная реакция с гиперсекрецией слизи. Развивается бронхорея, вырабатывается секрет с низким уровнем гликопротеинов. Хронизация воспаления приводит к перестройке слизистой оболочки и эпителия. Воспалительный процесс в этом случае протекает с продукцией вязкой слизи. Избыточное слизеобразование нарушает дренажную функцию бронхов и приводит к их обструкции, сужению просвета. Присоединение вторичной микрофлоры способствует трансформации слизистой мокроты в слизисто-гнойную и гнойную, что сочетается с еще большим повышением ее вязкости, обусловленным нарастанием количества нейтральных муцинов. Наряду с объемом и вязкостью меняются эластические и адгезивные свойства мокроты вследствие активности протеолитических ферментов бактерий и собственных лейкоцитов, а также нарушения целостности слизистой оболочки бронхов [6].
Если взрослый пациент способен откашливать избыток образовавшегося секрета, то у ребенка раннего возраста кашлевой рефлекс выражен значительно меньше. Кроме того, дети раннего возраста больше находятся в горизонтальном положении, увеличение частоты дыхания при ОРИ приводит к потере жидкости, затем к сгущению мокроты и к общему обезвоживанию. Повышение вязкости секрета вследствие гипервентиляции и появления в бронхиальном секрете биологических субстанций, сопровождающих воспалительный процесс, способствует снижению эффективности мукоцилиарного транспорта — основной системы очищения бронхиального дерева. Появляется кашель — защитный механизм, обеспечивающий очищение дыхательных путей. Эффективность кашля и его интенсивность зависят от таких свойств бронхиального секрета, как вязкость, эластичность и текучесть [7].
Ухудшение реологических свойств бронхиального секрета приводит также к нарушению подвижности ресничек мерцательного эпителия, что блокирует их очистительную функцию. С повышением вязкости движение мокроты замедляется или вовсе прекращается. Густой и вязкий бронхиальный секрет со сниженными бактерицидными свойствами является хорошей питательной средой для различных микроорганизмов (вирусов, бактерий, грибов). Повышение вязкости, замедление скорости продвижения бронхиального секрета способствуют фиксации, колонизации и более глубокому проникновению микроорганизмов в толщу слизистой оболочки бронхов, что приводит к усугублению воспалительного процесса [5].
Увеличиваются адгезивные свойства секрета, происходит его прилипание к стенкам бронхов, что еще больше затрудняет отхождение мокроты при кашле. Кроме того, густая мокрота обволакивает реснички мерцательного эпителия, затрудняя МЦК. Иногда при кашле выделяются сгустки мокроты, которые также отрывают реснички от мерцательных клеток. Таким образом, густая мокрота — это еще и фактор «облысения» зон реснитчатого эпителия.
Терапия ОРИ
Таким образом, с учетом всех возможных неблагоприятных факторов терапия любой ОРИ требует комплексного подхода. Поэтому больным с респираторными заболеваниями, особенно с хроническими и рецидивирующими воспалительными заболеваниями легких, назначают лекарства, способствующие снижению вязкости и эластичности мокроты и улучшающие ее экспекторацию. Существует множество препаратов, обладающих таким действием. Это и препараты на основе растительных экстрактов, и синтетические средства.
Муколитические средства прямого действия:
тиолитики (ацетилцистеин, эрдостеин);
протеолитические ферменты (α-ДНКаза, трипсин и др.).
Муколитические средства непрямого действия:
секретолитики (амброксол и бромгексин);
мукорегуляторы (карбоцистеин).
Отхаркивающие средства:
рефлекторного действия (препараты растительного происхождения);
бронхорроики (летучие бальзамы);
мукогидратанты и стимуляторы бронхиальных желез (натрия бикарбонат, калия йодид, аммония хлорид и др.).
Комбинированные препараты.
Другие средства.
Врачу необходимо определиться, с какой целью можно и нужно назначать тот или другой препарат, какие у него свойства при разных вариантах лечения. Также необходимо учитывать возрастные особенности, допустимые варианты комбинирования препаратов, их совместимость.
Препараты прямого действия
Наиболее известный препарат этой группы — ацетилцистеин (N-ацетил-L-цистеин, NAC) — средство, обладающее муколитическим, отхаркивающим и антиоксидантным свойствами. Ацетилцистеин способен разрывать дисульфидные связи мукополисахаридов слизи, что приводит к разжижению густой и вязкой мокроты. Этот эффект был обнаружен в 1950-х гг. профессором В. Феррари.
N-ацетилцистеин показал высокую эффективность в предотвращении бактериальной адгезии и растворении матрицы зрелой биопленки [8, 9]. За счет антиоксидантного действия реализуется и противовоспалительное свойство ацетилцистеина — он повышает защиту клеток от повреждающего действия свободнорадикального окисления, свойственного интенсивной воспалительной реакции. Антиоксидантное и противовоспалительное действие ацетилцистеина особенно важно при ОРВИ с высокой температурой и гриппе [10].
Ацетилцистеин следует применять при заболеваниях, которые могут сопровождаться образованием вязкого и трудноотделяемого секрета, а также при необходимости выведения густого секрета из полостей с замкнутым пространством (отиты, синуситы).
Ацетилцистеин — один из широко известных антидотов, используемых при передозировке парацетамола. Механизм его антитоксического действия связан со взаимодействием с токсичными веществами, ускорением процессов деградации токсичных молекул и усилением синтеза глутатиона, являющегося важным фактором химической детоксикации. Таким образом, при ОРИ с высокой температурой, когда в качестве жаропонижающего применяется именно парацетамол, использование ацетилцистеина может снизить риск развития печеночной недостаточности при передозировке парацетамола. Ацетилцистеин входит в состав многих комплексных препаратов.
Препараты, содержащие ферменты трипсин, химотрипсин, рибонуклеазу, стрептокиназу, обладают специфической особенностью расщеплять некротизированные ткани и фибринозные образования, разжижать вязкие секреты и экссудаты, а при внутримышечном введении оказывать противовоспалительное действие. Поэтому в медицинской практике данные препараты следует применять в случаях уже подтвержденной бактериальной инфекции — при гнойных бронхитах, синуситах, отитах и т. д.
Муколитики непрямого действия
Также активно в клинической практике используются муколитики непрямого действия. Непрямое действие бромгексина и его метаболита амброксола связано со стимуляцией слизистой оболочки дыхательных путей, при этом образуется менее вязкий секрет (повышение секреции гликопротеидов). Более жидкая мокрота облегчает работу реснитчатого эпителия и улучшает МЦК.
Что же лучше — муколитики прямого или непрямого действия?
В течение 3 лет на кафедре детских болезней РГМУ проводилось исследование, в котором приняли участие 259 детей в возрасте от 0 до 15 лет с острой хронической бронхолегочной патологией. 92 ребенка получали ацетилцистеин, 117 — амброксол в виде таблеток, сиропа, ингаляционно и инъекционно. В группу сравнения включили 50 пациентов, из них 30 принимали бромгексин, 20 — мукалтин. Длительность терапии составила от 5 до 15 дней [11].
Эффективность терапии оценивали по следующим критериям: сроки появления продуктивного кашля, уменьшение его интенсивности, сроки выздоровления, вязкость мокроты.
По результатам исследования наилучший клинический эффект показал ацетилцистеин. Бромгексин и амброксол также продемонстрировали выраженный муколитический эффект, но в более поздние сроки, чем ацетилцистеин. Наименьшей клинической эффективностью обладал мукалтин.
Действием, подобным действию ацетилцистеина, обладает карбоцистеин, относящийся к муколитикам с секретолическими свойствами (мукорегуляторными): он также разрушает дисульфидные связи мукополисахарида и изменяет заряд его ионов. В результате этого изменяются реологические свойства бронхиального секрета: уменьшается количество нейтральных гликопептидов, улучшается сиалогликопротеидная функция, что приводит к разжижению мокроты, снижению ее вязкости. Карбоцистеин не только стимулирует моторную функцию мерцательного эпителия дыхательных путей, но и облегчает отхождение бронхиального секрета и отделяемого из синусовых пазух.
Назначение муколитиков того или иного действия зависит исключительно от необходимости применения и эффективности в каждом конкретном случае. Поэтому утверждать, что тот или иной препарат лучше, чем другой, — неправильно.
Отхаркивающие средства
В чем отличие этих средств от муколитических? Муколитики воздействуют или на клетки слизистой оболочки, вырабатывающие бронхиальный секрет, или на уже образовавшийся секрет, изменяя его реологические свойства. Однако далеко не всегда разжиженная мокрота легко выводится из дыхательных путей. И в этом случае нужны отхаркивающие препараты, которые уменьшают прилипание слизи к бронхам, влияют на их сократительную активность, улучшая выведение мокроты из организма.
К таким средствам также относятся лекарственные вещества, влияющие на реологические свойства мокроты и облегчающие ее отделение путем воздействия на золь-слой мокроты. Среди них можно выделить препараты рефлекторного действия, бронхорроики, мукогидратанты и стимуляторы бронхиальных желез. К этой группе относится большинство известных растительных отхаркивающих средств [12].
Бронхорроики — так называемые летучие бальзамы, наносимые на кожу в виде мазей. При неспецифическом раздражении слизистой оболочки дыхательных путей во время вдыхания либо в результате гиперосмолярности за счет увеличения трансэпителиальной секреции воды увеличивают продуктивность кашля («увлажняют» кашель) [13].
Мукогидратанты — это препараты, способствующие внедрению воды в структуру золь-слоя секрета. Вызывают регидратацию слизи за счет увеличения транссудации плазмы, усиление моторной функции бронхов и, как следствие, отхаркивание. К ним относятся: натрия и калия йодид, аммония хлорид, натрия гидрокарбонат и другие солевые препараты.
Механизм рефлекторно действующих препаратов заключается в раздражающем действии на рецепторы желудка и в возбуждении рвотного центра продолговатого мозга, что рефлекторно усиливает секрецию слюнных желез и слизистых желез бронхов. Это экстракты травы термопсиса ланцетного, алтея, солодки, терпингидрата, тимьяна и др. [14].
Существует также большое количество отхаркивающих препаратов растительного происхождения [15]. Экстракт листьев плюща обладает отхаркивающим, муколитическим и спазмолитическим действием (обусловлено наличием сапонинов), а также местно-раздражающим и отвлекающим. Выпускается в виде сиропа и пастилок. Многокомпонентные препараты, в состав которых входят составляющие исключительно растительного происхождения (горечавки корень, первоцвета цветки, щавеля трава, бузины цветки, вербены трава), обладают сочетанным секретолитическим, секретомоторным, противовоспалительным, противоотечным, умеренным антибактериальным и противовирусным эффектом. Это позволяет выводить скопившийся секрет из придаточных пазух носа и ВДП, антибактериальное действие предупреждает развитие осложнений. Активация реснитчатого эпителия повышает МЦК. За счет изменения pH снижается вязкость бронхиального секрета, вследствие активизации деятельности мерцательного эпителия облегчается выведение мокроты.
Эвкабал® Бальзам С — комбинированный растительный препарат, в отличие от других препаратов растительного происхождения выпускается в формах для ингаляций, ванн и растираний. Комбинация из масла листьев эвкалипта и масла хвои сосны обыкновенной обладает выраженным эффектом. Активность в отношении многих микробов и противовоспалительное действие эвкалипта известны с давних времен, его используют в качестве антисептика и ароматического вещества. Масло листьев эвкалипта состоит из 40 летучих компонентов, содержит антисептики, антиоксиданты, дубильные вещества и горечи. Противомикробный эффект эвкалипта сравним с эффектом синтетических антибактериальных препаратов. При устранении воспалительного процесса возникает и обезболивающий эффект. Кроме того, при воздействии масла листьев эвкалипта происходит расширение сосудов ВДП, усиливается приток крови к слизистым оболочкам ВДП, нормализуется секреция и улучшается выведение вязкой мокроты — наблюдается секретолитический эффект.
К эффекту от эвкалипта присоединяется эффект от хвои сосны, содержащей смолу, эфирное масло (скипидар), крахмал, горькие и дубильные вещества, минеральные соли и витамин C, что усиливает секретолитический, иммуномодулирующий, обезболивающий эффекты.
Эвкабал® Бальзам С выпускают в лекарственной форме для ингаляции. Его удобно использовать у детей раннего возраста, т. к. локальность воздействия (именно на слизистую оболочку ВДП) уменьшает риск развития побочных эффектов. При добавлении бальзама в ванночку для купания достигается более мягкий эффект благодаря естественной ингаляции — при вдыхании паров, что очень удобно для применения у детей первых лет жизни. Растирания области грудины и межлопаточной области (проекция крупных бронхов, с большой концентрацией кашлевых рецепторов) вызывают местное раздражение кожи, улучшение кровообращения и опосредованное усиление секреторной активности слизистой оболочки. Оптимально при отсутствии лихорадки, остаточных явлениях кашля в периоде реконвалесценции.
Эвкабал® Сироп от кашля — препарат, также состоящий из нескольких компонентов:
экстракта подорожника. Подорожник обладает противовоспалительным, антисептическим, обезболивающим, секретолитическим, регенерирующим свойствами;
экстракта тимьяна. Тимьян (он же чабрец ползучий) обладает отхаркивающим, незначительным бронхорасширяющим и секретолитическим свойствами.
В комбинации компоненты действуют синергично, улучшая секретолитическое действие, за счет суммации эффектов возможно использовать небольшие концентрации, что уменьшает фармакологическую нагрузку на организм ребенка.
Многие специалисты предупреждают о возможном развитии аллергических реакций при применении препаратов растительного происхождения, Кроме того, указывают на необходимость их частого назначения вследствие короткого периода действия. Однако короткое время действия уменьшает риск скопления разжиженной мокроты. В инструкциях по применению этих препаратов можно увидеть рекомендации принимать их после еды, избегать приема на ночь. Это обусловлено тем, что все препараты с муколитической и секретолитической активностью действуют системно, т. е. оказывают влияние не только на слизистую оболочку дыхательной системы, бронхиальный секрет, но и на желудочно-кишечный тракт. Поэтому у всех этих препаратов одним из побочных действий является нарушение функции кишечника в виде диареи. Кроме того, для разжижения мокроты требуется поступление большого количества жидкости, следовательно, при приеме муко- и секретолитиков необходимо увеличить прием жидкости.
Далеко не все отхаркивающие средства обладают комбинированным действием, чаще они устраняют только один симптом заболевания органов дыхания — кашель с затрудненным отделением мокроты. Поэтому обычно их применяют в комбинации с другими препаратами (жаропонижающими, противовирусными и антибактериальными, противоотечными, иммуностимуляторами, противовоспалительными, витаминами).
Комбинируя несколько препаратов, важно учитывать совместимость и взаимодействие препаратов в организме. Карбоцистеин, бромгексин, амброксол усиливают проникновение в мокроту и слизистую оболочку бронхов противомикробных средств, например амоксициллина, цефуроксима, эритромицина, доксициклина, сульфаниламидов. Поэтому при воспалительных заболеваниях дыхательных путей карбоцистеин, бромгексин, амброксол часто применяют в сочетании с перечисленными противомикробными средствами, устраняющими основную причину заболевания — микробы, а отхаркивающие средства помогают удалить мокроту. Карбоцистеин, кроме того, препятствует сгущению мокроты после приема антибиотиков [6, 8].
Ацетилцистеин уменьшает всасывание антибиотиков, поэтому при ингаляциях их нельзя смешивать. Если ацетилцистеин назначают внутрь, антибиотики (пенициллины, цефалоспорины, тетрациклины) следует принимать не ранее чем через 2 ч после приема ацетилцистеина [16].
Из несовместимых комбинаций стоит упомянуть муко- и секретоактивные препараты и средства, блокирующие кашель. При их сочетании увеличивается объем мокроты, она разжижается, но не выводится. Скопившаяся мокрота легко становится питательной средой для микробов, присоединяется вторичная бактериальная инфекция.
Клинические случаи
Пациентка 7 лет. Жалобы на редкий кашель с густой мокротой, преимущественно в утренние часы. Также мама отмечает постоянную заложенность носа, девочка дышит ртом. Эффект от применения сосудосуживающих средств очень кратковременный. 10 дней назад перенесла острый риносинусит, трахеит. В терапии применялись сосудосуживающие, антигистаминные средства, муколитики непрямого действия. Отмечено быстрое купирование явлений ринореи, однако появилась постоянная заложенность носа, назальный секрет густой, трудноотделяемый. Кашель из сухого быстро стал влажным, но затем вновь стал сухим, мокрота отходит с трудом.
При осмотре состояние средней тяжести. Носовое дыхание затруднено, рот открыт. Кашель сухой, мокрота отделялась после серии кашлевых толчков. При аускультации легких выслушивалось жесткое дыхание, хрипов не было. Было рекомендовано: увеличить объем потребляемой жидкости, отменить сосудосуживающие и антигистаминные препараты. Назначена санация полости носа солевыми растворами (орошение), муколитик прямого действия ацетилцистеин (ЭСПА-НАЦ®) по 200 мг 2 р./сут на 5 дней, растирания препаратом Эвкабал® Бальзам С грудины и межлопаточной области 2 р./сут также на 5 дней. Осмотрена на 6-й день. Состояние удовлетворительное. Сохранялись единичные явления остаточного кашля. Носовое дыхание почти полностью восстановилось. При остаточных явлениях кашля назначен Эвкабал® Сироп по 1 столовой ложке 2 р./сут после еды на 4–5 дней.
Если в первом клиническом случае вопросов относительно назначения препарата не возникало (мокрота образовалась, стала густой, поэтому отделение происходило с трудом, необходимо было разжижить уже образовавшийся назобронхиальный секрет для облегчения его выведения), то во втором случае пришлось перебрать варианты терапии.
Пациент 5 мес. После перенесенной респираторной инфекции сохранялась выраженная заложенность носа, отделяемое густое. Ребенок на грудном вскармливании, заложенность носовых ходов затрудняла вскармливание. При осмотре состояние удовлетворительное, ребенок активен. Аускультативно дыхание проводилось равномерно над всеми отделами легких, выслушивались единичные проводные хрипы. При закрывании полости носа хрипы купировались. Проведение ингаляции с помощью небулайзера невозможно (ребенок боится). Решено назначить ванны с комбинированным растительным препаратом Эвкабал® Бальзам С для улучшения отхождения густого назального секрета. Повторная консультация после 4 ванн. Со слов мамы уже после первой ванны отхождение секрета значительно облегчилось, носовое дыхание улучшилось, также облегчилось вскармливание.
Вывод
Таким образом, в терапии болезней органов дыхания у детей наиболее часто используются муколитические препараты с разным механизмом действия. В каждом случае выбор препарата должен быть строго индивидуальным, с учетом всех возможных факторов: механизма фармакологического действия лекарственного средства, характера патологического процесса, возраста ребенка, возможных комбинаций препаратов.
Информация с rmj.ru






