ОСОБЕННОСТИ КРАТКОВРЕМЕННОЙ МОДИФИКАЦИИ ФОНОВОГО РИТМА В ЗАВИСИМОСТИ ОТ МОМЕНТА ПОСТУПЛЕНИЯ ЭКЗОГЕННОЙ СЕНСОРНОЙ АФФЕРЕНТАЦИИ НА РАЗНЫХ ФАЗАХ ЭНДОГЕННОГО АЛЬФА-РИТМА
Научная статья
Пушкин А.А.1, *, Криволай А.Г.2
1 ORCID: 0000-0002-9412-9475;
2 ORCID: 0000-0001-6903-6819;
1, 2 Академия биологии и биотехнологии им. Д. И. Ивановского ЮФУ, Ростов-на-Дону, Россия
* Корреспондирующий автор (artyompushkin[at]yandex.ru)
Аннотация
На 20 практически здоровых обследуемых обоего пола показано, что фотостимуляция, синхронизованная с восходящими фазами альфа-волн, приводит к «срыву» альфа-ритма на 150-й мс постстимульного периода. Предъявление стимула в нисходящую фазу альфа-волны реорганизует эндогенную альфа-ритмическую активность на 200-й мс постстимульного периода. Наблюдаемые изменения связываются с состоянием потенциал-зависимых ионных каналов, формирующих медленные пейсмекерные потенциалы корковых нейронов.
Ключевые слова: фазозависимое влияние, сенсорная стимуляция, пластическая перестройка ритма, пейсмекерный альфа-ритм ЭЭГ, потенциал-зависимые каналы.
FEATURES OF SHORT-TERM MODIFICATION OF BACKGROUND RHYTHM DEPENDING ON THE MOMENT OF ECTOGENOUS SENSORY AFFERENTATION ENTRY AT DIFFERENT PHASES OF THE ENDOGENOUS ALPHA RHYTHM
Research article
Pushkin A.A.1, *, Krivolay A.G.2
1 ORCID: 0000-0002-9412-9475,
2 ORCID: 0000-0001-6903-6819,
1,2 Academy of Biology and Biotechnology named after D.I. Ivanovsky of SFedU, Rostov-on-Don, Russia
* Corresponding author (artyompushkin[at]yandex.ru)
Abstract
It was proven with the help of 20 practically healthy subjects of both sexes that photo stimulation synchronized with the ascending phases of alpha waves leads to a “breakdown” of the alpha rhythm at the 150th ms of the post-stimulus period. The presentation of the stimulus in the descending phase of the alpha wave reorganizes the endogenous alpha rhythmic activity in the 200th ms of the post-stimulus period. The observed changes are associated with the state of potential-dependent ion channels that form slow pacemaker potentials of cortical neurons.
Keywords: phase-dependent influence, sensory stimulation, plastic restructuring of the rhythm, pacemaker alpha rhythm of the EEG, potential-dependent channels.
Введение
Исследование сенсомоторной интеграции и функционального состояния мозга с разработкой новых высокотехнологических методов целенаправленной регуляции адаптивного приспособительного пейсмекерного ритмогенеза посредством технологии фазозависимой стимуляции [1], [2] в режиме реального времени занимает важнейшее место в мировой науке. Интерес исследователей к проблеме фазозависимой сенсомоторной интеграции обусловлен наличием многочисленных данных о связи фазы альфа-осцилляций с цикличными флуктуациями процессов возбуждения. Гипотеза периодизации процессов возбуждения и торможения находит свое подтверждения в данных Лоренца, согласно которым нейроны головного мозга разряжаются на фоне определенной фазы локального ритма [9], что определяет, в конечном итоге, психофизиологические и электрофизиологические корреляты фундаментальных механизмов обработки информации мозга [7], [8], [10]. Отмечается модулирующее влияние фазы фоновых осцилляций на амплитуду [11], [12] и тайминг биоэлектрической активности популяции нейронов [13].
Однако, данные исследования, доказывающие влияние фазы волн фоновой активности мозга на функциональное состояние мозга и зависящие от него процессы обработки стимульной информации, имеют, с нашей точки зрения, ключевой методический недостаток, состоящий в организации синхронизации стимула с фазой волны ЭЭГ сугубо по фактору устанавливаемой временной задержки подачи стимула и, в значительно меньшей степени, по достижению заданного экспериментатором амплитудного порога, что, в итоге, не может гарантировать подачу стимула строго в определенную фазу волны выбранной частотной полосы [2]. В частности при низкой амплитуде волны альфа-ритма порог стимуляции будет достигаться только на вершине волны, а при высокой амплитуде альфа-волны порог стимуляции достигается уже в начале высокоамплитудной волны [2]. Отличительной особенностью нашего подхода от вышеупомянутых является фактор амплитудно-фазовой синхронизации экзогенных стимулов с эндогенной активностью в любой частотной полосе.
Стоит отметить, что задача выяснения особенностей кратковременных перестроек (секунды), пространственной организации и модификации фонового ритма в постстимульном периоде в зависимости от момента поступления экзогенной повторяемой сенсорной афферентации на разных фазах эндогенного ритма до сих пор не получила должного внимания. Последнее и являлось целью настоящей работы.
Методы исследования
В электроэнцефалографическом исследовании приняли участие 20 практически здоровых обследуемых-добровольцев обоего пола из числа студентов, аспирантов и сотрудников Южного федерального университета (ЮФУ) в возрасте от 18 до 30 лет (12 мужчин и 8 женщин, средний возраст составил 23.40±5.22). Добровольцы подбирались по критерию хорошей выраженности альфа-ритма в затылочных отведениях. Предварительно со всеми испытуемыми проводился инструктаж, в ходе которого они знакомились с целями и задачами проводимого исследования, методическими особенностями регистрации ЭЭГ. Обследования проводились в соответствии со ст. 5, 6 и 7 «Всеобщей декларации о биоэтике и правах человека» (1997). Все добровольцы давали письменное согласие на участие в исследовании.
Изучение влияния сенсорной стимуляции, синхронизированной в режиме реального времени с определенными, характерными для конкретного испытуемого, фазами альфа–волн на механизмы долговременных перестроек фонового ритма человека осуществлялось при одновременном использовании двух усилителей биопотенциалов мозга. С целью выделения необходимого частотного диапазона и указания фазы для подачи зрительного стимула в режиме реального времени использовался аналоговый 8–ми канальный электроэнцефалограф «Биоскрипт БСТ-112» (Германия). Сигналы с выходных каскадов аналогового электроэнцефалографа «Биоскрипт БСТ-112» подавались на входные каналы блока обработки параметров ЭЭГ и управления стимулирующими воздействиями (БОиУ). Данный БОиУ, разработанный нами для достижения поставленной методической цели, представляет собой микропроцессорную многоканальную и эргономичную систему регистрации и модуляции ЭЭГ, обеспечивающую возможность анализа многомерных сигналов биологического генеза в режиме реального времени [2]. БОиУ конструктивно оформлен в виде отдельного блока с автономным источником питания. Сигналы на входные каналы БОиУ подаются с выходных каскадов электроэнцефалографа.
Для выделения необходимого частотного диапазона и указания фазы для подачи зрительного стимула в режиме реального времени в БОиУ используется полосовой фильтр, что обеспечивает цифровую фильтрацию сигналов для идентификации необходимой полосы частот и работы БоиУ в диапазоне колебаний биопотенциалов мозга человека. Полосовая фильтрация ЭЭГ в режиме реального времени осуществляется при помощи двух синусных фильтров нижних частот Баттерворда, которые способны обеспечить необходимую монотонность амплитудно-частотных характеристик как в полосе пропускания, так и в полосе подавления. Необходимая амплитуда и фаза альфа–волны в БОиУ детектируется посредством сравнения отсчетов отфильтрованной ЭЭГ, зарегистрированной при помощи БСТ-112, с мгновенными значениями амплитуд опорного синусоидального сигнала Баттерворда [2].
Сенсорный стимул предъявлялся в определенную фазу альфа-волны, если БОиУ идентифицировал полное схождение параметров (частота, амплитуда, фаза) биопотенциалов с мгновенными значениями опорного синусоидального сигнала Баттерворда.
Активный электрод, используемый для регистрации фаз альфа–волн при фазозависимой сенсорной стимуляции, располагался над правой затылочной областью (O2). Зрительные стимулы, представлявшие собой диффузные вспышки света длительностью 50 мкс и с энергией вспышки 35 Дж, предъявляли на восходящей или нисходящей фазах колебаний (в зависимости от этапа исследования), соответствующих индивидуально доминирующей частоте альфа–ритма. Эту частоту определяли по результатам спектрального анализа 30-секундных ЭЭГ-эпох, зарегистрированных при помощи БСТ-112. В дальнейшем зрительный стимул предъявлялся на восходящие или нисходящие фронты фаз фоновых альфа–волн ЭЭГ человека с пороговым значением амплитуды альфа–волн не менее 100 мкВ. В итоге, каждому испытуемому предъявлялись 100 стимулов с межстимульным интервалом не менее 2222 мс. В свою очередь, диффузные вспышки света формировались стробоскопической лампой-вспышкой (фотостимулятор ФС-02), которая размещалась на уровне глаз обследуемого, на расстоянии 30 см, посредством подачи на вход последней триггерного импульса от БОиУ, усиленного электростимулятором ЭСЛ-2. Все исследования проводились в дневное время суток в слабо освещенной экранированной камере со звукоизоляцией. Все добровольцы во время регистрации электроэнцефалограммы находились в состоянии пассивного бодрствования с закрытыми глазами.
С целью изучения краткосрочных пластических перестроек ритмической активности, вызванных стимулом, анализировали межстимульную когерентность посредством [14] частотно-временной волновой декомпозиции постстимульной активности на базе синусоидального вейвлет-трансформирования (вейвлет Морле). Данная методология параметрической оценки межстимульной когерентности позволяет оценить синхронизацию частотных диапазонов электрограмм, имеющих четкую временную связь с конкретным событием. Длина вейвлет-преобразования анализируемых частот составила 3 цикла. Частотно-временное представление получали, усредненное по группе (n=20), для каждой функциональной пробы (восходящая и нисходящая фаза). Также производили усреднение как генерализованно по всей выборке добровольцев, так и индивидуально для каждой функциональной пробы (восходящая и нисходящая фаза). Вычисления осуществляли в среде программ MatLab 2007b с использованием toolbox EEGLAB 12.
Результаты исследований и их обсуждение
Проведенные нами исследования выявили наличие фазозависимого влияния сенсорной стимуляции, синхронизированной с восходящей или нисходящей фазами индивидуально доминирующих альфа-колебаний, на выраженность пластических кратковременных перестроек ритмов ЭЭГ. В частности, синхронизация кратковременного сенсорного стимула с восходящей фазой альфа-волны приводит к «срыву» альфа-ритма с 200-й мс (рис. 1) и индуцирует синхронизацию в бета-частотном диапазоне с 50 по 150 мс (рис. 1). Последнее сопровождается синхронизацией активности в дельта-частотном диапазоне с 100 по 300 мс (рис. 1).
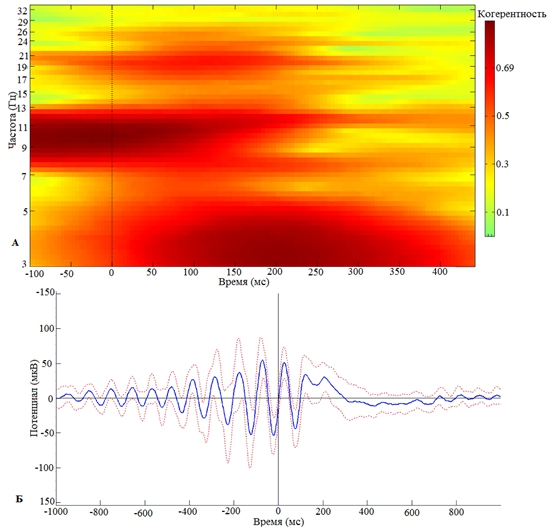
Рис. 1 – Зависимость кратковременной реорганизации фонового ритмогенеза от восходящей фазы предъявления экзогенного стимула:
А – Частотно-временная реорганизация фонового ритма при предъявлении стимула на восходящей фазе альфа-волны; Б – Усредненной по группе добровольцев альфа-ритм в момент предъявления стимула в восходящую фазу альфа-волны. 0 – отметка предъявления стимула в восходящую фазу альфа-волны
Примечание: пунктиром обозначена ошибка среднего
Однако, если стимул предъявляется в нисходящую фазу альфа-волны, альфа-активность сохраняется, при этом межстимульной синхронизации в дельта- или бета-частотных диапазонах не наблюдается (рис. 2).
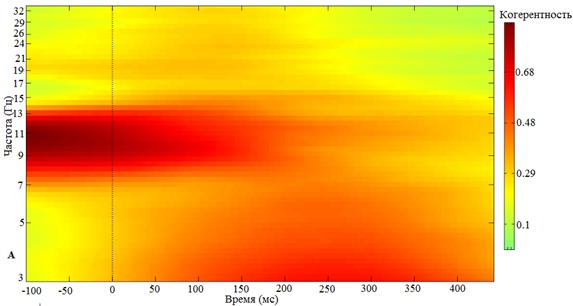
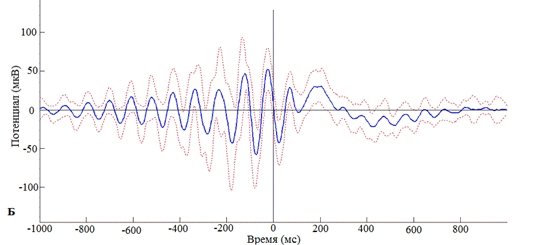
Рис. 2 – Зависимость кратковременной реорганизации фонового ритмогенеза от нисходящей фазы предъявления экзогенного стимула:
А – Частотно-временная реорганизация фонового ритма при предъявлении стимула в нисходящую фазу альфа-волны; Б – Усредненный по группе добровольцев альфа-ритм в момент предъявления стимула в нисходящую фазу альфа-волны. 0 – отметка предъявления стимула в нисходящую фазу альфа-волны
Примечание: пунктиром обозначена ошибка среднего
Анализируя характер выраженности пластических кратковременных (в течение 1 секунды) перестроек фонового ритма ЭЭГ от момента синхронизации сенсорной стимуляции с восходящей или же нисходящей фазами индивидуально доминирующих альфа-колебаний, нами было установлено, что наиболее выраженная реорганизация фонового ритмогенеза наблюдается с 150 по 400 мс в постстимульном периоде.
Интересно, что сенсорный стимул, синхронизованный с восходящей фазой альфа-волны приводит к росту межстимульной синхронизации осцилляций в альфа- и бета-частотных диапазонах, наблюдающейся в постстимульном периоде с 0 по 150 мс. Колебания в бета-частотном диапазоне, регистрирующиеся в правой окципитальной области (О2) в постстимульном периоде, с 0 по 150 мс (рис.1), при фазозависимой стимуляции, функционально, скорее всего, ассоциируются с готовностью, т.е. достаточным уровнем возбуждения, локальных нейронных ансамблей воспринимать, детектировать и осуществлять раннюю категоризацию воздействующих стимулов. Последнее согласуется с литературными данными, отождествляющими процессы восприятия, семантической и эпизодической эксплицитной памяти с ранними компонентами вызванной активности [15]. В последующем, со 150 мс на фоне снижения синхронного межстимульного представительства альфа-частотного диапазона наблюдается увеличение индекса межстимульной когерентности в дельта-частотном диапазоне. Наблюдаемый эффект взаимодействия альфа- и дельта-частотных диапазонов функционально может отражать процессы распознавания биологической значимости, сличения поступающей информации с хранящейся в памяти. В частности, синхронизация кратковременного сенсорного стимула с восходящей фазой альфа-волны приводит, с одной стороны, к уменьшению показателя межстимульной когерентности в альфа-частотном диапазоне (рис. 1) в правой окципитальной области., а с другой стороны, к увеличению показателя межстимульной когерентности в дельта-частотном диапазоне (рис.1) в окципитальной области. Обнаруженное нами реципрокное взаимодействие между осцилляциями дельта- и альфа-частотных диапазонов, устанавливающееся под влиянием сенсорного раздражителя, отмечается и в работах других авторов.
Так, появление осцилляции в дельта–частотном диапазоне ЭЭГ человека, вызванное каким-либо событием, сопровождается развивающейся аттенюацией альфа–осцилляций в ЭЭГ человека. Характер такого рода взаимодействия, по данным некоторых ученых, положительно коррелирует с мотивационными процессами [21] и обусловлен активацией процесса внимания [18]. В функциональном плане, явление реципрокного взаимодействия дельта– и альфа–частотных диапазонов связано с неспецифическими процессами внимания, индуцированными поступающей внешней афферентацией [18]; модификацией мнестических процессов [19]; процессами ожидания [17].
Стоит отметить, что наиболее выраженная реорганизация фонового ритмогенеза наблюдается с 150 по 400 мс в постстимульном периоде (рис. 1 и 2). Следовательно, реорганизация фоновой пейсмекерной ритмической активности связана не с моментом поступления афферентного сигнала в проекционные зоны коры мозга, а с моментом обращения к памяти при опознании сигнала и оценке его биологической значимости, что по латентным периодам соответствует вторичным компонентам ВП, а не первичному ответу, который отражает физические параметры стимула. Поэтому процессы восприятия и памяти, модулируются и разворачиваются в единой концептуальной плоскости на фоне альфа-активности, сохраняющейся при предъявлении стимула в нисходящую фазу эндогенных α-осцилляций, с целью организации оптимального интегративного комплекса.
Следует отметить, что фазозависимые реакции срыва фонового ритма ЭЭГ у разных добровольцев сохраняются в течение продолжительного времени и выявляются при повторных обследованиях одного и того же человека (рис. 3).
Интересно, что динамика показателя межстимульной когерентности частотных диапазонов, зависимая от фазы предъявления стимула, не находит своего логического объяснения в рамках парадигмы нейросетевой таламокортикальной синаптической организации альфа–активности, а скорее всего, отражает его пейсмекерное кортикальное происхождение. Установленные нами врожденные индивидуально-типологические особенности, заключающиеся в сохранении формы реакции на фазозависимую сенсорную стимуляцию при повторных обследованиях одного и того же человека, в частности с 200 по 400 мс постстимульного периода, может свидетельствовать о пейсмекерном, генетически опосредованном, кортикальном происхождении эндогенного фонового ритмогенеза в альфа-частотном диапазоне.
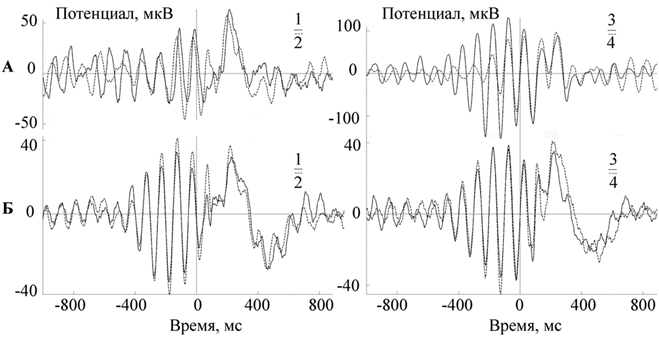
Рис. 3 – А – Сопоставление двух усредненных электрограмм, зарегистрированных с интервалом в 1 месяц у добровольца А. Б – Сопоставление двух усредненных электрограмм, зарегистрированных с интервалом в 1 месяц у добровольца Б. Прим.: пунктиром обозначен усредненный ритм при стимуляции на заданной фазе волны, зарегистрированный через месяц от первой частотно-фазовой стимуляции (сплошная линия). 0 – отметка стимула. ½ – стимуляция выполнялась на нисходящей фазе. ¾ – стимуляция выполнялась на восходящей фазе (цитата по [2])
Так, стимул, приходящийся на восходящую фазу колебаний эндогенного потенциала пейсмекерного нейрона, с учетом времени (30 мс) прохождения импульса от рецептора к корковому представительству, приходится на фазу «открытых» низкопороговых Ca2+ и, в последующем – Na+-каналов плазмолеммы пейсмекерных клеток. Последнее тормозит пейсмекерную активность нейронов, что приводит к «срыву» α–ритма и, в свою очередь, к увеличению когерентной синхронизации в δ–частотном диапазоне. При этом нейронная сеть, генерирующая α-ритм, разряжается по принципу тонического типа пульсаций нейронов, т.е. функционирует в режиме единичных высокопороговых спайков, развивающихся на фоне относительной деполяризации клеточной мембраны (> –55 мВ) через каждые 12-15 мс [22].
| Финансирование
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-315-00201. |
Funding
The study was carried out with the financial support of the Russian Foundation for Basic Research within the framework of the research project No. 18-315-00201. |
Список литературы / References
- Zrenner C. Closed-Loop Neuroscience and Non-Invasive Brain Stimulation: A Tale of Two Loops / C. Zrenner, P. Belardinelli, F. Müller-Dahlhaus, U. Ziemann // Frontiers in Cellular Neuroscience. – 2016. – V. 10. – N. 92. – P. 1-7.
- Pushkin A. A. Regulation of the functional state of the human brain by real time frequency−phase synchronization of sensory stimuli with the EEG rhythm / A. A. Pushkin, L. V. Lysenko, A. G. Sukhov, A. V. Vdovjuk, I. V. Scherban // Biomedical Engineering. – 2017. – V. 51. – N. 1. – P. 28-32.
- VanRullen R. Perceptual cycles / R. VanRullen // Trends in Cognitive Sciences. – 2016. – V. 20. – N. 10. – P. 723-735.
- Milton A. The phase of pre-stimulus alpha oscillations influences the visual perception of stimulus timing / A. Milton, C. W. Pleydell-Pearce // NeuroImage. – 2016. – V. 133. – P. 53–61.
- Mathewson K. E. Making waves in the stream of consciousness: entraining oscillations in EEG alpha and fluctuations in visual awareness with rhythmic visual stimulation / K. E. Mathewson, C. Prudhomme, M. Fabiani, D. M. Beck // Journal of Cognitive Neuroscience. – 2012. – V. 24. – N. 12. – P. 2321–2333.
- Klimesch W. EEG alpha oscillations: the inhibition timing hypothesis / W. Klimesch, P. Sauseng, S. Hanslmayr // Brain Research Reviews. – 2007. – V. 53. – N. 1. – P. 63–88.
- Gho M. A quantitative assessment of the dependency of the visual temporal frame upon the cortical rhythm / M. Gho, F. J. Varela // J. Physiol. Paris. – 1988. – V. 83. – N. 2. – P. 95–101.
- Samaha J. The speed of alpha-band oscillations predicts the temporal resolution of visual perception / J. Samaha, B. R. Postle // Curr. Biol. – 2015. – V. 25. – N. 22. – P. 2985–2990.
- Lоrincz M. L. Temporal framing of thalamic relay-mode firing by phasic inhibition during the alpha rhythm / M. L. Lorincz, K. A. Kekesi, G. Juhasz, V. Crunelli, S. W. Hughes // Neuron. – 2009. – V. 63. – N. 5. – P. 683–696
- Sherman M. T. Rhythmic influence of top-down perceptual priors in the phase of pre-stimulus occipital alpha oscillations / M. T. Sherman, R. Kanai, A. K. Seth, R. VanRullen // J. Cog. Neuroscience. – 2016. – V. 28 – N. 9. – P. 1318–1330.
- Van Meij R. Phase-amplitude coupling in human electrocorticography is spatially distributed and phase diverse. The Journal of neuroscience: the official journal of the / R. VanMeij, M. Kahana, E. Maris // Society for Neuro. – 2012. – V. 32. – N. 1. – P. 111–123.
- Voytek B. A method for event-related phase/amplitude coupling / B. Voytek, M. D’Esposito, N. Crone, R. T. Knight // NeuroImage. – 2013. – V. 64. – P. 416–424.
- Haegens S. α-oscillations in the monkey sensorimotor network influence discrimination performance by rhythmical inhibition of neuronal spiking / S. Haegens, V. Nacher, R. Luna // Proceedings of the National Academy of Sciences. – 2011. – V. 108. – N. 48. – P. 19377–19382.
- Delorme A. EEGLAB: an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis / A. Delorme, S. Makeig // Journal of Neuroscience Methods. – 2004. – V.134. – N. 1. – P 9-21.
- Ossandon, J. P. Superposition model predicts EEG occipital activity during free viewing of natural scenes / J. P. Ossandon, A. V. Helo, R. Montefusco-Siegmund, P. E. Maldonado // The Journal of Neuroscience. – 2010. – V. 30. – N. 13. – P. 4787-4795.
- Bernat E. M. Decomposing delta, theta, and alpha time-frequency ERP activity from a visual oddball task using PCA / E. M. Bernata, S. M. Malonea, W. J. Williamsb, C. J. Patricka, W. G. Iaconoa // Int. J. Psychophysiol. – 2007. – P. 64. – N. 1. – P. 62–74.
- Isoglu-Alkac U. Necker cube reversals during long-term EEG recordings: sub-bands of alpha activity / U. Isoglu-Alkac, D. Struber // Int. J. Psychophysiol. – 2006. – V. 59. – №. 2. – P. 179–189.
- Yordanova J. Event-related alpha oscillations are functionally associated with P300 during information processing / J. Yordanova, V. Kolev // NeuroReport. – 1998. – V. 9. – N. 14. – P. 3159–3164.
- Yordanova J. P300 and alpha event-related desynchronization (ERD) / J. Yordanova, V. Kolev, J. Polich // J. Psychophysiol. – 2001. – V. 38. – N. 1. – P. 143–152.
- Bonfiglio L. Reciprocal dynamics of EEG alpha and delta oscillations during spontaneous blinking at rest: A survey on a default mode-based visuo-spatial awareness / L. Bonfiglio, S. Sello, M. C. Carboncini, P. Arrighi, P. Andre, B. Rossi // Int. J. Psychophysiol. – 2011. – V 80. – N. 1. – P. 44–53.
- Knyazev G. G. EEG delta oscillations as a correlate of basic homeostatic and motivational processes / G. G. Knyazev // Neuroscience and Biobehavioral Reviews. – 2012. – V. 36. – N. 1. – P. 677–695.
- Hughes S. W. Thalamic mechanisms of EEG alpha rhythms and their pathological implications / W. Hughes, V. Crunelli // Neuroscientist. – 2005 – V. 11. – N. 4. – P. 357–372.





