Сравнительная эффективность использования различных моделей небулайзеров при обострении хронической обструктивной болезни легких
Достоинствами ДАИ являются удобство, быстрота выполнения процедуры, низкая стоимость, содержание до нескольких сотен доз препарата в ингаляторе. Однако при использовании ДАИ необходимо четко соблюдать координацию вдоха и ингаляции, что трудновыполнимо для некоторых пациентов. Кроме того, высокая скорость потока образующегося аэрозоля приводит к оседанию его большей части в ротоглотке [2, 3].
Преимущество применения ДПИ: частицы лекарства ингалируются постепенно, за счет вдоха пациента, исчезает проблема координации вдоха и ингаляции. Они компактны, удобны и просты в использовании. Недостатки ДПИ: потеря части дозы препарата в ингаляторе, орофарингеальная депозиция, редко — ирритативный эффект порошка с появлением кашля и бронхоспазма. Минусом ДПИ является прямая зависимость доставки препарата от величины инспираторного потока, что затрудняет использование ДПИ при обострениях заболевания и у пациентов с тяжелой степенью бронхообструкции [2, 3].
К преимуществам небулайзерной терапии относятся: возможность ингаляции высоких доз лекарственных средств, отсутствие необходимости координации вдоха и ингаляции, простота техники ингаляции, отсутствие пропеллентов, раздражающих дыхательные пути, возможность использования системы при тяжелых состояниях, у пожилых пациентов и детей, при двигательных расстройствах и нарушениях сознания, возможность включения в контур подачи кислорода и искусственной вентиляции легких [4–6].
Использование небулайзеров входит в стандарты лечения хронической обструктивной болезни легких (ХОБЛ) как в состоянии ремиссии, так и при обострении заболевания [7]. К достоинствам применения небулайзерной терапии при ХОБЛ относятся возможность ее использования в ситуациях, когда тяжесть состояния пациента, его возраст и плохая координация не позволяют правильно использовать другие ингаляторы.
Доставка препарата в дыхательные пути зависит от множества факторов, важнейшим из которых является размер частиц лекарственного средства. По размерам частиц медицинские аэрозоли подразделяются на высоко-, средне- и низкодисперсные. Установлено, что частицы размером более 10 мкм осаждаются и воздействуют в ротоглотке, от 5 до 10 мкм — в глотке, гортани и трахее, от 1 до 5 мкм — в нижних дыхательных путях, от 0,5 до 1 мкм — в альвеолах, а частицы менее 0,5 мкм остаются взвешенными в воздухе, не осаждаются в органах дыхания и свободно выходят при выдохе [8, 9]. Задачей небулайзерной терапии является продукция аэрозоля с высокой пропорцией (>50%) респирабельных частиц (менее 5 мкм) в течение довольно короткого временного интервала [1].
В зависимости от типа энергии, превращающей жидкость в аэрозоль, выделяют три основных класса небулайзеров:
1) струйные (компрессорные) — использующие струю газа (воздух или кислород), 2) ультразвуковые — использующие энергию колебаний пьезокристалла, 3) мембранные — использующие энергию вибрации мембраны [10]. Компрессорный небулайзер на сегодняшний день считается самым распространенным средством доставки среди всех [1, 2, 6].
Несмотря на сходный дизайн и конструкцию, небулайзеры различных моделей могут иметь значительные различия в выходных характеристиках (например: производительность, скорость подачи аэрозоля, респирабельная фракция), которые будут влиять на длительность проводимой ингаляции и количество препарата, поступающего в легкие [11]. При сравнении 17 типов струйных небулайзеров было показано, что выход аэрозоля различался более чем 2 раза (0,98–1,86 мл), величина респирабельной фракции — в 3,5 раза (22–72%), скорость доставки частиц респирабельной фракции препаратов — в 9 раз (0,03–0,29 мл/мин) [12], средняя депозиция препарата в легких — в 5 раз, средняя орофарингеальная депозиция — в 17 раз [13]. Кроме того, различные модели небулайзеров отличаются такими техническими характеристиками, как остаточный объем лекарственного препарата в камере небулайзера после ингаляции и длительность ингаляции, что во многом определяет эффективность доставки лекарственного препарата в ДП. Модели небулайзеров различаются не только техническими характеристиками, но и габаритами, весом, уровнем шума. Доктору и пациенту сложно разобраться в их многообразии и выбрать наиболее подходящий для терапии конкретного пациента. Целью данного исследования является определение значения модели небулайзера разных производителей для наиболее эффективной и безопасной доставки лекарственного средства на примере комбинированного препарата ипратропия бромид + фенотерол у пациентов с обострением ХОБЛ.
Содержание статьи
Материал и методы
Было обследовано 16 больных в возрасте 56,31±8,19 года с ХОБЛ по классификации GOLD (Global Initiative for Chronic Obstructive Lung Disease) II и III, группа D, смешанный фенотип: эмфизематозно-бронхитический в фазе обострения, госпитализированных в пульмонологический стационар [7].
В исследование не включались пациенты старше 65 лет, с непереносимостью компонентов назначенной терапии, бронхиальной астмой, легким обострением ХОБЛ, клинически значимой сердечно-сосудистой патологией, рецидивирующим кровохарканьем и легочным кровотечением, лихорадкой неясного генеза, инфекционными заболеваниями. Все пациенты подписали информированное согласие.
Базисная терапия проводилась согласно Федеральным клиническим рекомендациям по диагностике и лечению ХОБЛ [14]. В связи с обострением ХОБЛ пациенты получали антибактериальную терапию (цефотаксим 2,0), инфузионную терапию аминофиллином (2,4% 5,0), отхаркивающие препараты (бромгексин 8 мг, экстракт травы алтея лекарственного 50 мг).
Всем пациентам была проведена спирометрия на аппарате Schiller Spirovit SP-1 с оценкой объема форсированного выдоха (ОФВ1), форсированной жизненной емкости легких (ФЖЕЛ), жизненной емкости легких (ЖЕЛ), индекса Тиффно (ОФВ1/ФЖЕЛ). Тяжесть одышки определялась по шкале модифицированного опросника Британского медицинского исследовательского совета (Modified Medical Research Counsil questionnaire, mMRC). Оценка субъективных ощущений пациента включала в себя определение выраженности одышки, чувства заложенности в грудной клетке, наличия кашля и мокроты в баллах от 1 до 5 (CAT-тест). Проводилось измерение артериального давления (АД), частоты сердечных сокращений (ЧСС). Далее больные были разделены на две группы по 8 человек. В 1-й день пациентам группы 1 проводили ингаляцию комбинированным препаратом ипратропия бромид + фенотерол в дозировке 20 капель на 2,0 мл физиологического раствора через небулайзер OMRON C24 (Япония). Пациентам группы 2 проводили ингаляцию данным препаратом в такой же концентрации через другой компрессорный небулайзер со схожими заявленными характеристиками. Во 2-й день пациентам группы 1 проводили ингаляцию данным препаратом ипратропия бромид + фенотерол в той же дозировке через другой компрессорный небулайзер, пациентам группы 2 — через небулайзер OMRON C24.
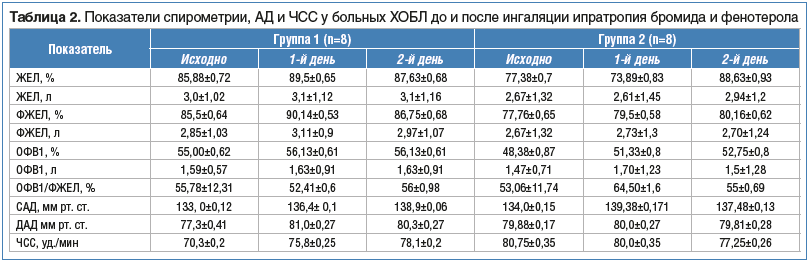
Пациенты из групп 1 и 2 достоверно не различались по возрасту, полу, продолжительности заболевания, среднему количеству обострений в год и стажу курения (табл. 1). Все пациенты предъявляли жалобы на одышку, возникающую преимущественно при физических нагрузках. Спирометрические показатели также были сопоставимы в группах. По выраженности бронхообструкции 62,5% обследованных пациентов (n=10) имели нарушения средней степени тяжести, 37,5% (n=6) — тяжелой степени. Средние величины показателей представлены в таблице 2.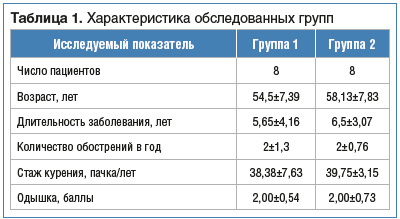
В обеих группах в 1-й и 2-й день исследования после проведения небулайзерной терапии оценивали длительность ингаляции, количество остаточного объема лекарственного препарата в камере небулайзера после ингаляции, субъективные ощущения больного, измеряли АД и ЧСС. Двукратно осуществлялся забор крови из вены в асептических условиях с помощью вакуумной системы в объеме не менее 2 мл, с последующим центрифугированием для анализа его на концентрацию фенотерола (через 10 мин и через 3 ч после окончания ингаляции). После центрифугирования плазма крови была заморожена при температуре —40 °C для дальнейшего исследования. Через 1 ч после ингаляции проводилось спирометрическое исследование с оценкой ОФВ1, ФЖЕЛ, ЖЕЛ, индекса Тиффно.
Определение концентрации фенотерола в плазме крови осуществляли методом жидкостной хроматомасс-спектрометрии с помощью жидкостного хроматографа Dionex UltiMate 3000 (США) c диодноматричным детектором DAD-3000 (RS) и гибридным тройным квадрупольным масс-анализатором 3200 QTrap (Канада) с программным обеспечением Analyst 1.5.
Статистическая обработка данных проводилась с использованием стандартного пакета прикладного статистического анализа Statistica for Windows V.7.0. Определение числовых характеристик переменных с вычислением средней арифметической и средней квадратической ошибки было проведено с помощью описательной статистики.
Результаты и обсуждение
При проведении ингаляции оценивали ее среднюю длительность, остаточный объем лекарственного препарата в камере небулайзера. Рекомендуемая длительность ингаляции в среднем составляет 10 мин [2, 9]. Раннее прекращение ингаляции может значительно снизить величину доставки препарата в связи с остатком неиспользованного лекарственного средства. Величина остаточного объема также оказывает существенное влияние на эффективность небулайзерной терапии [2, 8]. Препарат невозможно использовать полностью, т. к. часть его остается в так называемом «мертвом» пространстве небулайзера, даже если камера почти полностью осушена. Это связано с особенностью строения компрессорного небулайзера. Остаточный объем зависит от конструкции небулайзера и обычно находится в пределах от 0,5 до 1,5 мл. При остаточном объеме 1 мл и объеме наполнения 2 мл может быть преобразовано в аэрозоль не более 50% препарата, при том же остаточном объеме и объеме наполнения 4 мл может быть доставлено в дыхательные пути до 75% препа-рата [1, 2, 9]. Чем больше выбранный исходный объем раствора, тем большая доля препарата может быть ингалирована. Однако при этом увеличивается время небулизации, что может значительно снизить приверженность больных терапии.
При одинаковых заявленных технических характеристиках время проведения ингаляции и остаточный объем лекарства отличались. При проведении терапии через небулайзер OMRON среднее время небулизации на 24,7% меньше, чем при использовании аналогичного небулайзера другой фирмы (табл. 3). Также важной характеристикой является остаточный объем после терапии. При использовании небулайзера OMRON средний остаточный объем был на 29% меньше, в сравнении с остаточным объемом аналогичного прибора другого производителя. Таким образом, при использовании небулайзера OMRON С24 лечение становится более управляемым, поскольку требуемое количество лекарства доставляется к органу-мишени, а не остается в небулайзерной камере, а сокращение времени ингаляции приводит к повышению комплаентности пациента.
По окончании ингаляции оценивали субъективные ощущения больного, измеряли АД, ЧСС. У пациентов после небулайзерной терапии, в большей степени после использования небулайзера OMRON, отмечены уменьшение выраженности одышки и кашля, снижение интенсивности ощущения заложенности в грудной клетке, улучшалось отхождение мокроты (рис. 1). В обеих группах после ингаляции ипратропия бромида и фенотерола клинически незначимо повышались АД и ЧСС, однако более выраженные изменения со стороны сердечно-сосудистой системы были у пациентов, получавших терапию через небулайзер со схожими техническими характеристиками (см. табл. 2). Вероятно, это было вызвано тем, что действующее вещество, которое подавалось через другой небулайзер, в большей степени всосалось из желудочно-кишечного тракта в кровь, что и привело к проявлению эффектов, связанных с резорбтивным действием препарата, повышению систолического АД (САД) и ЧСС, незначительному повышению диастолического АД (ДАД). Этот эффект нуждается в дальнейшем изучении, контроле за безопасностью проводимой ингаляционной терапии. Выраженных нежелательных явлений в обеих группах отмечено не было.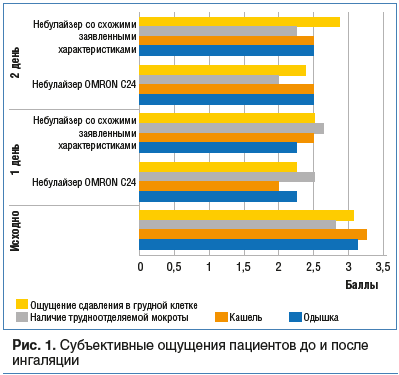
Через 1 ч после ингаляции пациентам была проведена повторная спирометрия с определением ОФВ1, ФЖЕЛ, ЖЕЛ, ОФВ1/ФЖЕЛ (см. табл. 2). У пациентов, использовавших небулайзер OMRON C24, отмечалась тенденция к увеличению ЖЕЛ в группе 1 — ≈3,62% (100 мл), в группе 2 — ≈11,25% (270 мл); ФЖЕЛ в группе 1 — на ≈4,6% (260 мл), ФЖЕЛ в группе 2 — ≈2,4% (30 мл), ОФВ в группе 1–1,13%, в группе 2 — ≈4,37% по сравнению с исходными данными этих групп. Напротив, после использования небулайзера со схожими техническими характеристиками не было выявлено тенденции к увеличению некоторых спирометрических показателей (см. табл. 2). Достоверных различий получено не было, что соответствует литературным данным о влиянии небулайзерной терапии на показатели ФВД [15].
После ингаляции препарата у пациентов дважды забиралась кровь для последующего фармакокинетического исследования (через 10 мин и через 3 ч после ингаляции). По результатам исследования содержание фенотерола в плазме крови, полученной через 10 мин после окончания ингаляции, было обнаружено у 3 пациентов, использовавших небулайзер OMRON (11±1,73 нг/мл), и у 1 пациента, использовавшего небулайзер со сходными техническими параметрами (12 нг/мл). В плазме крови, полученной через 3 ч после окончания ингаляции, фенотерол определялся у 1 пациента, получавшего ингаляцию через небулайзер OMRON
(8 нг/мл), и у 3 пациентов, использовавших другой небулайзер (10±2,64 нг/мл). Полученные результаты через 10 мин отражают концентрацию фенотерола в легких, концентрация через 3 ч связана, по-видимому, с орофарингеальным всасыванием действующего вещества, не достигшего легких [16]. Следует учитывать, что фракция активного вещества способна вызывать системные эффекты, что объясняет повышение АД и увеличение ЧСС у пациентов, получавших терапию через небулайзер со сходными техническими характеристиками.
Заключение
При лечении обострения у пациентов с ХОБЛ рекомендовано использовать небулайзеры в связи с простотой техники маневра, отсутствием необходимости координации вдоха и ингаляции, а также возможностью ингалирования высоких доз лекарственных средств, что позволяет применять небулайзеры даже при самых тяжелых состояниях и у пожилых пациентов [17, 18]. Несмотря на то, что существенного влияния на вентиляционную функцию легких по спирометрическим показателям в обеих исследуемых группах выявлено не было, субъективные ощущения у пациентов во время и после ингаляционной терапии во многом определялись используемой моделью ингаляционного устройства. Выявленное уменьшение неприятных ощущений и длительности ингаляции при использовании небулайзера ОMRON C24 обеспечивает повышение комплаентности пациентов с ХОБЛ. Помимо этого, применение ингалятора OMRON способствует увеличению доставки лекарственного средства в легкие и уменьшению орофарингеальной депозиции, что особенно важно у коморбидных больных ХОБЛ для уменьшения возможности развития побочных эффектов, обусловленных резорбтивным действием таких препаратов, как бета-2-агонисты и ингаляционные кортикостероиды.
Таким образом, для ингаляционной терапии через небулайзер пациентам с ХОБЛ можно рекомендовать небулайзер торговой марки ОMRON Неalthcare, Япония.
Информация с rmj.ru





