Ключевые слова: подагра, подагрический артрит, критерии диагностики, принципы терапии, нимесулид.
Для цитирования: Якупова С.П. Алгоритм ведения пациентов с подагрой в свете современных рекомендаций // РМЖ. Медицинское обозрение. 2017. №1. С. 53-56
Yakupova S.P.
Kazan State Medical University
In the past few decades, there has been an increase in the gout incidence rate. Despite the active development of new directions in the diagnosis of this disease, the formulation of this diagnosis is difficult. Perhaps this is due to insufficient equipment in the regions (polarizing microscope, ultrasound diagnosis of joints lesion, dual energy computed tomography) and / or trained specialists. In these cases, it is important to develop clinical criteria with higher sensitivity and specificity indicators that allow diagnosing gout. In 2015, the European Anti-Rheumatic League (EULAR) and the American College of Rheumatology (ACR) have attempted to develop such criteria, and in 2016 various medical communities (American College of Physicians (ACP) and EULAR) have developed strategies for managing such patients in clinical practice. In addition, in 2016 new drugs for the treatment of gout (colchicine, febuksostat) were registered in the Russian Federation. It is important to implement the algorithm of these guidelines in the work of doctors, who treat patients with gout, — rheumatologists, traumatologists, surgeons, therapists, general practitioners. On an example of a real clinical case, the article deals with the algorithm of diagnosis, the strategic directions of treatment of these patients, the principles of drug choice, the role of nimesulide in the therapy of gouty patients.
Key words: gout, gouty arthritis, diagnostic criteria, principles of therapy, nimesulide.
For citation: Yakupova S.P. Algorithm for gouty patients management in light of modern guidelines // RMJ. MEDICAL REVIEW. 2017. № 1. P. 53–56.
В статье приведен алгоритм ведения пациентов с подагрой в свете современных клинических рекомендаций. На примере реального клинического случая разбираются алгоритм постановки диагноза, стратегические направления лечения пациентов, принципы выбора лекарственных препаратов, роль нимесулида в терапии пациентов с подагрой.
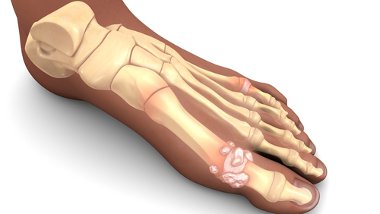
Распространенность подагры составляет 1–4% от общей численности населения. Увеличению этого показателя способствуют неправильное питание, отсутствие физических упражнений, увеличение числа случаев ожирения и метаболического синдрома [1]. В последние несколько лет пересмотрены рекомендации по диагностике и лечению этого заболевания Европейской антиревматической лигой (EULAR, 2016) [2], Американским колледжем врачей (ACP, 2016) [3], рассмотрены новые классификационные критерии подагры (ACR/EULAR, 2015) [4]. Но, несмотря на наличие новых методов диагностики, эффективных методов лечения, подагра все еще часто диагностируется неверно, а подходы к лечению не являются оптимальными [2]. Рассмотрим на примере клинического случая алгоритм диагностики и лечения пациента с подагрой.
Пациент С., 44 года. Обратился с жалобами на сильную боль, припухлость и покраснение в правом 1 плюснефаланговом суставе, невозможность ходить из-за боли, болезненность при прикосновении. Данные жалобы беспокоят в течение последней недели. Принимает диклофенак 100 мг/сут с незначительным эффектом, местно использует нестероидные противовоспалительные препараты (НПВП) – мази.
В анамнезе: в течение 15 лет суставной синдром, преимущественно в 1 плюснефаланговом суставе, около 3 эпизодов острых артритов в год. Принимает НПВП – диклофенак, Найз.
Достоверный диагноз подагры такому пациенту можно выставить после проведения пункции сустава и обнаружения кристаллов моноурата натрия (МУН) в полученной синовиальной жидкости. Исследование синовиальной жидкости нужно проводить как можно скорее, лучше в течение 6 ч. Хотя можно исследовать и в течение 24 ч, если хранить образец при температуре 4°C [1]. К сожалению, поляризационная микроскопия, позволяющая идентифицировать кристаллы МУН, используется крайне редко, чаще всего из-за отсутствия необходимого оборудования.
Согласно новым классификационным критериям диагностики подагры ACR/EULAR 2015 г. (табл. 1), в случае отсутствия достоверного критерия может использоваться набор других критериев этого заболевания, выраженный в баллах (Шаг 3).
Для правильной постановки диагноза нужно собрать анамнез с детализацией характера течения артритов, локализации поражения; тщательное объективное обследование для выявления образований, подозрительных на тофусы; провести лабораторное обследование для выявления сывороточного уровня мочевой кислоты (МК); использовать доступные методы визуализации для подтверждения диагноза: ультразвуковое исследование (признак двойного контура), рентгенографию суставов (к сожалению, выявляет изменения на более поздней стадии болезни) или двухэнергетическую компьютерную томографию.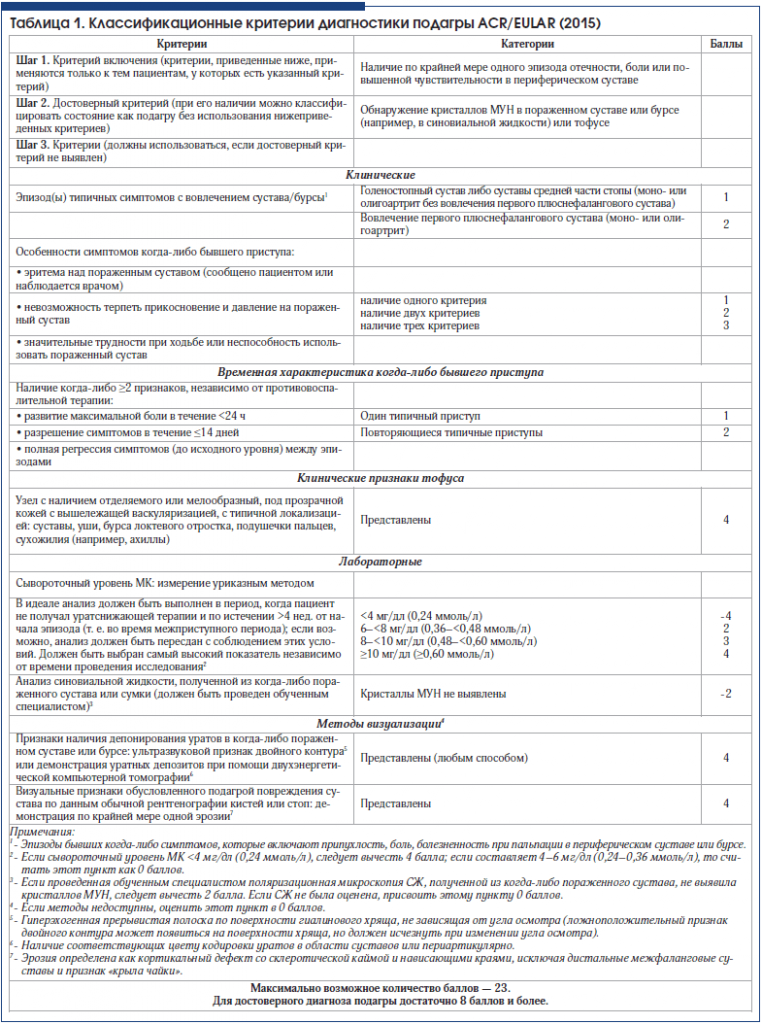
При осмотре пациента тофусов не выявлено, но пациент описал ранее наблюдаемые образования на ушах, которые самостоятельно вскрывались с мелоподобным содержимым. В анализе крови СОЭ – 35 мм/ч. Уровень МК – 0,58 мкмоль/л.
На рентгенограмме стоп в прямой проекции (рис. 1): крупные кисты в субхондральной зоне плюсневых и проксимальных фаланг 1-х пальцев правой и левой стоп и эрозии на суставных поверхностях – у пациента имеется длительный анамнез (15 лет) острых рецидивирующих артритов. 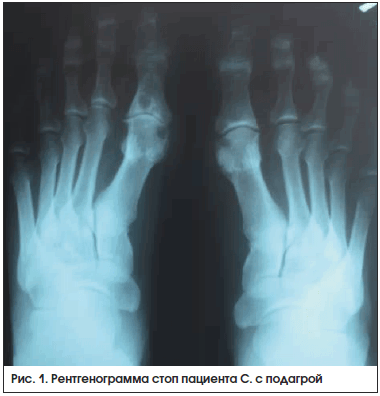
В представленном клиническом случае выявлены типичные симптомы артрита первого плюснефалангового сустава (2 балла); наличие трех критериев, характерных особенностей симптомов приступа (3 балла); повторяющиеся типичные приступы с наличием ≥2 признаков (2 балла); в анамнезе признаки тофусов на ушах (4 балла); лабораторно – повышение сывороточного уровня МК 0,48–
В рекомендациях EULAR 2016 г. по диагностике и лечению подагры отмечена важность систематического обследования пациентов с подагрой для выявления сопутствующих заболеваний и факторов кардиоваскулярного риска (почечная недостаточность, ишемическая болезнь сердца, сердечная недостаточность, инсульт, атеросклероз периферических артерий, ожирение, гиперлипидемия, артериальная гипертония (АГ), сахарный диабет и курение). Коррекция выявленных изменений является неотъемлемой частью лечения пациентов с подагрой.
Пациент курит. Повышен индекс массы тела (ИМТ) – 31,25 кг/м2. Иногда отмечает повышение АД до 150/90 мм рт. ст., антигипертензивные препараты постоянно не принимает. Креатинин – 70,2 мкмоль/л, скорость клубочковой фильтрации (СКФ) (по CKD-EPI) – 109 мл/мин. Общий холестерин – в норме, повышение уровня триглицеридов, снижение уровня липопротеидов высокой плотности (ЛПВП). Риск по SCORE – 2%.
Пациенту даны рекомендации по соблюдению гиполипидемической и гипоурикемической диеты, исключению курения, снижению массы тела, контролю АД (препаратом выбора является лозартан).
Лечение острого артрита при подагре заключается в как можно более раннем назначении эффективного и безопасного для конкретного пациента противовоспалительного препарата (колхицин, НПВП, пероральные кортикостероиды или внутрисуставные кортикостероиды после аспирации синовиальной жидкости). На выбор терапии могут повлиять время от начала приступа, наличие противопоказаний к какому-либо из перечисленных препаратов, предшествующий опыт применения препаратов, а также число и тип суставов, вовлеченных в процесс.
В течение 12–24 ч от начала приступа рекомендуемым препаратом первого выбора для лечения приступа острого подагрического артрита может быть колхицин.
Но пациента симптомы артрита беспокоят уже в течение последней недели.
В анамнезе у больного имеется опыт эффективного приема диклофенака и нимесулида (Найз), при последнем обострении отмечается недостаточная эффективность диклофенака. Возможно ли в этом случае рекомендовать в качестве препарата для купирования текущего обострения и для раннего начала лечения артрита при будущих обострениях препарат нимесулид (Найз)?
Нимесулид имеет следующие особенности фармакокинетики, позволяющие его рекомендовать как препарат выбора при остром и хроническом болевом синдроме: хорошая биодоступность, быстрое и полное всасывание из желудочно-кишечного тракта (ЖКТ), достижение в течение 30 мин 25–80% максимальной концентрации после приема первой дозы, в это же время в среднем наступает его анальгетический эффект [5]. Нимесулид 100 мг по данным исследований превосходил в выраженности и быстроте анальгетического эффекта целекоксиб 200 мг и рофекоксиб 25 мг у пациентов с остеоартритом [6].
Этот препарат относится к группе противовоспалительных препаратов с умеренной селективностью, за счет чего имеет более редкую частоту неблагоприятных реакций со стороны ЖКТ [7]. В отечественных исследованиях [8] не выявлено изменения течения АГ или гемодинамики на фоне применения этого препарата, как и нет бесспорных доказательств гепатотоксичности нимесулида [9]. Хорошая переносимость препарата подтверждается в анализе спонтанных сообщений о нежелательных реакциях, возникавших при использовании нимесулида (Найза) в клинической практике с января 2009 г. по октябрь 2014 г. Выявленная частота очень низкая: менее 1 случая на 150 тыс. курсов лечения для всех нежелательных реакций и менее 1 случая на 1 млн больных [10]. Таким образом, этот препарат сочетает в себе высокую эффективность с хорошей безопасностью, что является важным для коморбидности пациентов с подагрой.
Хочется обратить внимание на то, что используемые пациентом локальные формы НПВП имеют низкую эффективность при подагре и не рекомендуются в таких случаях.
Следующим моментом обсуждения тактики ведения пациента с подагрой является решение вопроса о назначении гипоурикемической терапии и выборе конкретного препарата. Согласно рекомендациям EULAR 2016 [2], показаниями к началу гипоурикемической терапии являются:
– повторяющиеся приступы (≥2 в год);
– тофусы;
– уратная артропатия и/или наличие камней в почках;
– пациенты молодого возраста (
– пациенты с очень высоким уровнем МК в сыворотке крови (>8,0 мг/дл; 480 мкмоль/л) и/или с сопутствующими заболеваниями (почечная недостаточность, АГ, ишемическая болезнь сердца, сердечная недостаточность).
В описанном клиническом случае имеются следующие показания: около 3 эпизодов острых артритов в год, уровень МК – 0,58 мкмоль/л, тофусы на ушных раковинах.
Согласно рекомендациям [2], препаратом первого выбора является аллопуринол, начинать терапию необходимо с низких доз (100 мг/сут) и увеличивать при необходимости на 100 мг через каждые 2–4 нед. для достижения целевого уровня МК в сыворотке (
В представленном клиническом случае у пациента нет противопоказаний к применению аллопуринола, нет анамнеза непереносимости аллопуринола, нет ограничений по дозе препарата (СКФ по CKD-EPI – 104 мл/мин), поэтому не ранее чем через 2 нед. после купирования приступа артрита пациенту рекомендовано начать терапию аллопуринолом 100 мг/сут с контролем уровня МК в крови каждые 2–4 нед.
С целью профилактики обострений артрита на фоне приема уратснижающей терапии рекомендуется использовать либо колхицин в суточной дозе 0,5–1 мг, либо НПВП в низких дозах. Длительность такой терапии составляет 6 мес.
Таким образом, использование алгоритмов диагностики и лечения подагры на основе современных рекомендаций даст возможность врачу более быстро и правильно поставить диагноз подагры, а также выбрать наиболее оптимальную персонифицированную терапию для каждого пациента с подагрой.
Литература
1. Ragaba G., Elshahalyb М., Bardin Т. Gout: An old disease in new perspective – A review // J Adv Res. 2017. Vol. 8(5). P. 495–511.
2. Richette P. et al. EULAR evidence-based recommendations for the management of gout // Ann Rheum Dis. 2016. Vol. 0. P. 1–14.
3. Qaseem А., Harris R.P., Forciea М.А. For the Clinical Guidelines Committee of the American College of Physicians. Management of Acute and Recurrent Gout: A Clinical Practice Guideline From the American College of Physicians // Ann Intern Med. 2017. Vol. 166(1). P. 58–68.
4. Neogi T., Jansen T., Dalbeth N. et al. Gout classification criteria: an American College of Rheumatology. European League Against Rheumatism collaborative initiative // Ann Rheum Dis. 2015. Vol. 74(10). P. 1789–1798.
5. Барскова В.Г. Нимесулид в терапевтической практике // Consilium Medicum. 2011. № 2. С. 49–54 [Barskova V.G. Nimesulid v terapevticheskoj praktike // Consilium Medicum. 2011. № 2. S. 49–54 (in Russian)].
6. Bianchi M., Broggini M. A randomised, double-blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee // Drugs. 2003. Vol. 63(1). P. 37–46.
7. Castelsague J., Pisa F., Rosolen V. et al. Risk of upper gastrointestinal complication in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy // Pharmacoepid and Drug Safety. 2012 (Published online in Willey Online Library, doi: 10.1002/pds.3385).
8. Чичасова Н.В., Имаметдинова Г.Р., Насонов Е.Л. Нимесулид в лечении хронических заболеваний суставов // Лечащий врач. 2008. № 4. С. 75–78 [Chichasova N.V., Imametdinova G.R., Nasonov E.L. Nimesulid v lechenii hronicheskih zabolevanij sustavov // Lechashhij vrach. 2008. № 4. S. 75–78 (in Russian)].
9. Venegoni M., Da Cas R., Menniti-Ippolito F. et al. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy // Ann I-st Super Sanita. 2010. Vol. 46(2). P. 153–157.
10. Каратеев А.Е., Журавлева М.В. Анализ спонтанных сообщений российских врачей о неблагоприятных реакциях, возникших на фоне приема нимесулида: гепатотоксические осложнения очень редки // Эффективная фармакотерапия. 2015. № 21. С. 4–13 [Karateev A.E., Zhuravleva M.V. Analiz spontannyh soobshhenij rossijskih vrachej o neblagoprijatnyh reakcijah, voznikshih na fone priema nimesulida: gepatotoksicheskie oslozhnenija ochen’ redki // Jeffektivnaja farmakoterapija. 2015. № 21. S. 4–13 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





