Материал и методы: всего в исследование включено 57 респондентов, которые были разделены на 3 группы. В 1-ю группу вошли 20 больных БА, во 2-ю — 19 больных с сочетанием БА+ХОБЛ, 3-ю группу составили 19 больных ХОБЛ. Во всех случаях было проведено общеклиническое исследование, оценка функционального состояния респираторной системы с помощью методов спирографии и бодиплетизмографии, изучение клеточного состава индуцированной мокроты и содержания оксида азота в выдыхаемом воздухе.
Результаты исследования: согласно полученным данным, уровень оксида азота в выдыхаемом воздухе значительно выше при сочетании БА и ХОБЛ и сопряжен с количеством обострений заболевания (r=0,60, р=0,022), что свидетельствует о высокой степени воспаления в бронхиальном дереве. Анализ цитограмм индуцированной мокроты свидетельствует о формировании эозинофильного типа воспаления при БА, нейтрофильного — при ХОБЛ. При сочетании БА и ХОБЛ наблюдается нарушение физиологических соотношений отдельных клеточных популяций в индуцированной мокроте в сторону увеличения количества эозинофилов и нейтрофилов, что свидетельствует о смешанном паттерне воспаления и взаимосвязано с увеличением объема базисной терапии (r=0,70, р=0,021).
Заключение: сочетание БА и ХОБЛ характеризуется более тяжелым течением, низкими показателями функции внешнего дыхания, гиперинфляцией и высоким уровнем оксида азота в выдыхаемом воздухе в сравнении с тяжелой БА. Клеточный состав индуцированной мокроты свидетельствует об эозинофильном типе воспаления при БА, нейтрофильном типе при ХОБЛ и смешанном типе при сочетании БА и ХОБЛ.
Ключевые слова: бронхиальная астма, хроническая обструктивная болезнь легких, индуцированная мокрота, оксид азота в выдыхаемом воздухе, воспаление.
Для цитирования: Чубарова С.В., Собко Е.А., Демко И.В., Соловьева А.А., Минеева Е.С., Кублик Е.С. Клинико-функциональные параметры, содержание оксида азота и особенности клеточного состава индуцированной мокроты при сочетании бронхиальной астмы и хронической обструктивной болезни легких // РМЖ. 2018. №3(I). С. 4-8
Chubarova S.V.1,2, Sobko Е.А.1,2, Demko I.V.1,2, Soloveva A.A.1, Мineeva Е.S.1, Кublik Е.S.1
1 Krasnoyarsk State Medical University named after Prof. V.F.Voino-Yasenetsky
2 Regional clinical hospital, Krasnoyarsk
Aim: To study the clinical and functional parameters, the content of exhaled nitric oxide and peculiarities of the cellular composition of induced sputum in patients with a combination of asthma and COPD.
Patients and Methods: The study enrolled 57 respondents, which were divided into 3 groups. The first group included 20 patients with asthma, the second group included 19 patients with a combination of asthma and COPD, the third group consisted of 19 patients with COPD. All patients underwent a general clinical study, evaluation of the functional state of the respiratory system using the methods of spirography and body plethysmography, the study of the cell composition of induced sputum and the content of exhaled nitric oxide.
Results: According to the data obtained, the level of exhaled NO is much higher in the patients with the combination of asthma and COPD and is associated with the number of exacerbations of the disease (r = 0.60, p = 0.022), which indicates a high degree of inflammation in the bronchial tree. The analysis of cytograms of induced sputum indicates the formation of eosinophilic type of inflammation in asthma, neutrophilic — in COPD. The combination of asthma and COPD is characterized by the violation of physiological ratios of individual cell populations in induced sputum in the direction of increasing the number of eosinophils and neutrophils, which indicates a mixed pattern of inflammation and correlates with the increase in the basic treatment (r=0,70, p=0,021).
Conclusion: The combination of asthma and COPD is characterized by a more severe course of the disease, low rates of respiratory function, hyperinflation, and a high level of exhaled NO compared with the patients with severe asthma. The cellular composition of induced sputum testifies of the eosinophilic type of inflammation in asthma, neutrophilic type in COPD and mixed type in the combination of asthma and COPD.
Key words: bronchial asthma, chronic obstructive pulmonary disease, induced sputum, exhaled nitric oxide, inflammation.
For citation: Chubarova S.V., Sobko Е.А., Demko I.V. et al. Clinical and functional parameters, nitric oxide content and peculiarities of induced sputum in combination of asthma and chronic obstructive pulmonary disease // RMJ. 2018. № 3(I). P. 4–8.
Введение
В статье представлены результаты исследования по изучению клинико-функциональных параметров, содержания оксида азота в выдыхаемом воздухе и особенностей клеточного состава индуцированной мокроты у больных бронхиальной астмой в сочетании с хронической обструктивной болезнью легких. Показано, что сочетание этих заболеваний характеризуется более тяжелым течением, низкими показателями функции внешнего дыхания, гиперинфляцией и высоким уровнем оксида азота в выдыхаемом воздухе в сравнении с тяжелой бронхиальной астмой.
Содержание статьи
Введение
Бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ) – два самостоятельных, наиболее часто встречающихся заболевания респираторной системы. По данным ВОЗ, ХОБЛ страдают 230 млн человек в мире. Ежегодно от данного заболевания умирают 2,74 млн, и к 2020 г. ХОБЛ выйдет на 3-е место среди причин смерти [1]. В течение длительного времени ХОБЛ диагностировалась преимущественно у мужчин, однако в настоящее время во всем мире возросло потребление табака женщинами, что привело к росту заболеваемости ХОБЛ в женской популяции.
В мире около 300 млн человек страдают БА – каждый 20-й житель планеты. Распространенность этого заболевания в разных странах мира колеблется от 1 до 18%. По данным ВОЗ, летальность от астмы составляет 250 тыс. человек в год. Исходя из результатов аналитико-прогностических исследований не исключено, что при стремительных темпах урбанизации к 2025 г. БА разовьется дополнительно у 100–150 млн человек [2, 3].
Социальная и экономическая значимость ХОБЛ и БА определяют необходимость глубокого изучения их сочетания у одного пациента. Несмотря на четкие диагностические критерии, в ряде случаев трудно провести границу между этими заболеваниями [4]. В 2014 г. впервые выделен синдром перекреста БА и ХОБЛ, или ACOS-синдром, который сочетает в себе признаки обеих нозологий [5]. Частота сочетания БА и ХОБЛ колеблется от 12,1 до 55,2% среди больных ХОБЛ и от 13,3 до 61,0% среди больных БА [6].
Морфологической основой обоих заболеваний является хроническое воспаление в бронхиальном дереве, нарушающее целостность эпителиального слоя, обусловливающее запуск бронхоконстрикторных реакций, приводящих к бронхиальной обструкции [7, 8]. Известно, что табакокурение способствует дисбалансу протеаз и антипротеаз в легочной ткани и развитию системного окислительного стресса, усиливающего воспаление [9, 10]. Необходимо отметить, что риск развития ХОБЛ у курящего астматика значительно выше, чем у некурящего, хотя суммарная интенсивность курения ниже по сравнению с людьми, страдающими только ХОБЛ [11]. При этом характер воспаления при БА и ХОБЛ имеет принципиальные различия.
Согласно определению, «ACOS-синдром характеризуется персистирующим ограничением воздушного потока, рядом признаков, ассоциированных с астмой, и рядом признаков, ассоциированных с ХОБЛ» [12]. В настоящий момент сочетание БА и ХОБЛ может быть диагностировано при наличии 3-х признаков характерных для БА и 3-х признаков характерных для ХОБЛ [9].
Признаки характерные для БА
Возраст дебюта заболевания до 20 лет.
Проявления гиперреактивности (симптомы варьируют по минутам, часам и дням).
Ухудшение ночью или в ранние утренние часы.
Симптомы появляются во время нагрузки, эмоций, контакта с аллергеном.
Вариабельные ограничения воздушного потока.
Нормальная функция легких между симптомами.
Ранее диагностировалась астма.
Наличие отягощенной наследственности по БА или другим атопическим заболеваниям.
Течение заболевания характеризуется отсутствием прогрессирования симптомов или наличием сезонной вариабельности.
Возможно спонтанное улучшение или быстрый эффект при лечении бронхолитиками или в течение нескольких недель в ответ на ингаляционные глюкокортикостероиды (ИГКС).
Нормальная рентгенологическая картина.
Признаки характерные для ХОБЛ
Возраст дебюта заболевания после 40 лет.
Симптомы персистируют, несмотря на лечение.
Наличие «хороших» и «плохих» дней, но симптомы ежедневные.
Хронический кашель и продукция мокроты обычно предшествуют одышке и не связаны с триггерами.
Персистирующее ограничение воздушного потока.
Сниженная функция легких между симптомами.
Ранее диагностировалась ХОБЛ.
Интенсивное воздействие факторов риска (курение, органическое топливо).
Течение заболевания характеризуется тем, что симптомы медленно прогрессируют (прогрессирование год от года).
Короткодействующие бронхолитики приносят временное облегчение.
Рентгенологическая картина: гиперинфляция.
Прогрессирующее ухудшение легочной функции при сочетании БА и ХОБЛ обусловливает выраженность клинической симптоматики, наряду с которой отмечается снижение качества и продолжительности жизни у данной категории больных [13]. Именно поэтому пациенты с перекрестом БА и ХОБЛ нуждаются в интенсивном использовании ресурсов здравоохранения и требуют назначения персонифицированной фармакотерапии [14]. Комплексное изучение респираторных показателей во взаимосвязи с клиническими особенностями будет способствовать пониманию патофизиологических изменений дыхательной системы и позволит упростить дифференциальную диагностику бронхообструктивных заболеваний [15, 16].
Цель исследования: изучить клинико-функциональные параметры, содержание оксида азота в выдыхаемом воздухе и особенности клеточного состава индуцированной мокроты при сочетании БА и ХОБЛ.
Задачи исследования
1. Оценить клинико-функциональные особенности у больных сочетанной патологией в сравнении с пациентами с ХОБЛ и пациентами с БА.
2. Изучить особенности клеточного состава индуцированной мокроты у больных БА, ХОБЛ и их сочетанием.
3. Изучить содержание оксида азота в выдыхаемом воздухе при БА и ХОБЛ и их сочетании.
4. Выявить возможные взаимосвязи между показателями бронхиальной проходимости, уровнем оксида азота в выдыхаемом воздухе и показателями индуцированной мокроты при бронхообструктивных заболеваниях легких.
Материал и методы
Всего исследовано 57 респондентов, которые были разделены на 3 группы.
Критерии включения в исследование: возраст от 40 до 75 лет; получение информированного согласия на участие в исследовании.
Критерии исключения: наличие в анамнезе хронических заболеваний легких, кроме БА и ХОБЛ; сахарный диабет; цереброваскулярные заболевания (инсульт, транзиторные ишемические атаки), заболевания сердца (инфаркт миокарда в течение года до момента включения, коронарная реваскуляризация, хроническая сердечная недостаточность II и III стадии); злокачественные новообразования; тяжелая почечная и печеночная недостаточность; беременные и кормящие женщины.
В 1-ю группу вошли 20 больных БА, во 2-ю группу – 19 с сочетанием БА и ХОБЛ, в 3-ю группу – 18 больных с ХОБЛ (табл. 1). Все пациенты находились на стационарном лечении в легочно-аллергологическом центре ККБ. Во 2-й и 3-й группах преобладали мужчины (68,4% и 83,3%, при р=0,039 и р=0,003 соответственно), тогда как среди больных БА больше было женщин. Возраст пациентов с БА составил 51 (46; 59) год, что существенно меньше, чем у пациентов 2-й и 3-й группы (р=0,019, р=0,004 соответственно).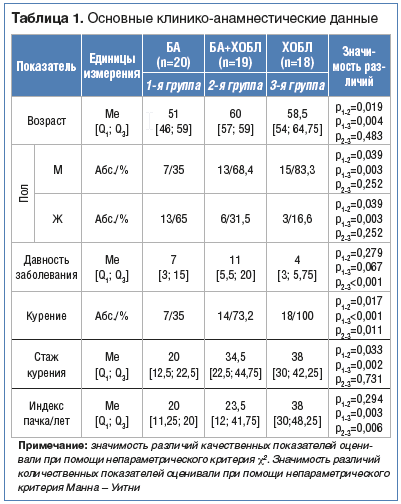
Диагноз БА был верифицирован у больных, имеющих менее 3-х признаков ХОБЛ.
Всем пациентам проводилось клиническое обследование, включающее сбор анамнеза, физикальный осмотр, оценку симптомов заболевания и одышки по шкале MRS.
Исследование функции внешнего дыхания (ФВД) включало проведение: общей бодиплетизмографии (измерение функциональной остаточной емкости легких (ФОЕ), определение общей емкости легких (ОЕЛ), остаточного объема легких (ООЛ) и их отношения (ООЛ/ОЕЛ), сопротивление дыхательных путей на вдохе (СДП вд.) и на выдохе (СДП выд.) и спирометрии с бронходилатационным тестом (400 мкг сальбутамола) (измерение жизненной емкости легких (ЖЕЛ), форсированной жизненной емкости легких (ФЖЕЛ), объема форсированного выдоха за 1 с (ОФВ1), индекса Генслера (ОФВ1/ФЖЕЛ)).
Исследование индуцированной мокроты проводилось путем последовательной ингаляции 3%, 4% и 5% раствора хлорида натрия через ультразвуковой небулайзер (OMRON, Япония) сеансами по 5 мин под контролем ФВД, с последующим подсчетом не менее 400 клеток в 100 полях зрения. Получившееся количество клеток выражали в процентах [10].
Исследование оксида азота в конденсате выдыхаемого воздуха проводилось с помощью аппарата NОBreаth (ppb).
Статистическая обработка полученных данных выполнялась при помощи программы Statistica версии 7,0. Количественные значения представлены в виде медианы (Ме) и интерквартильного интервала (Q1 и Q3), где Q1 — 25-й процентиль, Q3 — 75-й процентиль. Качественные переменные описаны абсолютными и относительными частотами (процентами). При сравнительном анализе групп по количественным признакам использовали непараметрический U-критерий Манна – Уитни (не зафиксировано нормальное распределение выборок, определяемое по методу Колмогорова – Смирнова и критерию Шапиро – Уилка). Для оценки связи признаков применяли корреляционный анализ с расчетом корреляции по методу Спирмена. Различия считались статистически значимыми при p
Результаты и обсуждение
Наиболее значимая длительность заболевания регистрировалась у пациентов с сочетанием БА и ХОБЛ и составила 11 (5,5; 20) лет. Следует подчеркнуть, что ХОБЛ у больных с сочетанной патологией, включенных в исследование, сформировалась на фоне длительного течения БА. Более того, у пациентов 3-й группы показатель давности заболевания оказался наименьшим и составил 4 (3; 5,75) года, что может быть связано с несвоевременной диагностикой и поздней обращаемостью пациентов.
Согласно полученным данным, табакокурение как фактор риска ХОБЛ регистрировалось в 100% случаев в 3-й группе. Более того, интенсивность курения, которая оценивалась с помощью индекса пачка/лет, была существенно выше у больных ХОБЛ в сравнении с показателями в 1-й и 2-й группе (р=0,003, р=0,006 соответственно). Вместе с тем, наименьшее число курящих пациентов отмечалось в группе больных БА и составило 35%, что существенно меньше, чем во 2-й и 3-й группе (р=0,017, р
При оценке клинических симптомов установлено, что у пациентов с сочетанием БА и ХОБЛ количество приступов удушья в течение суток составило 6 (3,5; 8), что существенно выше в сравнении с больными 1-й группы
(р=0,031) и 2-й группы (р=0,029): 3 (2; 5) и 2 (1; 2,75) соответственно. Наибольшая потребность в короткодействующих β2-агонистах (КДБА) также была зафиксирована при сочетании БА и ХОБЛ (р
Одним из признаков, характеризующих тяжесть заболевания, является количество обострений и госпитализаций в течение года. Согласно полученным результатам, у пациентов с сочетанной патологией отмечается наибольшее количество обострений, требующих госпитализации, которое составило 2 (1,5; 3), тогда как при БА данный показатель равен 1,5 (1; 3,25) (р=0,279) и при ХОБЛ – 2 (1; 2) (р=0,031).
По данным спирометрии, во всех группах регистрировалось нарушение бронхиальной проходимости. Наиболее значимые изменения выявлены у больных ХОБЛ (р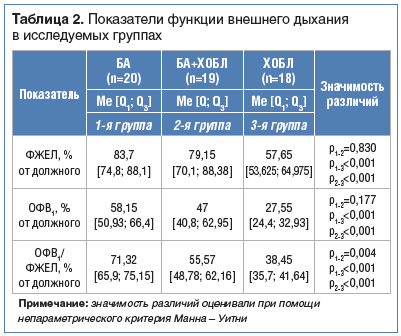
Согласно результатам исследования, по данным спирометрии, в группе больных ХОБЛ изменения скоростных показателей ассоциированы с интенсивностью курения, что подтверждено отрицательной корреляционной связью между стажем курения, параметрами ОФВ1 (r=–0,50, р=0,041) и ФЖЕЛ (r=–0,57, р=0,016), а также между индексом пачка/лет, величиной ОФВ1 (r=–0,49, р=0,038) и ОФВ1/ФЖЕЛ (r=–0,48, р=0,039). Кроме того, снижение ОФВ1 сопряжено с нарастанием показателя MRS (r=–0,68, р=0,014).
По данным бодиплетизмографии установлено, чтово всех группах регистрировалось повышение сопротивления дыхательных путей как на вдохе, так и на выдохе (табл. 3), наибольшие показатели регистрировались у больных ХОБЛ, а наименьшие – у больных БА (р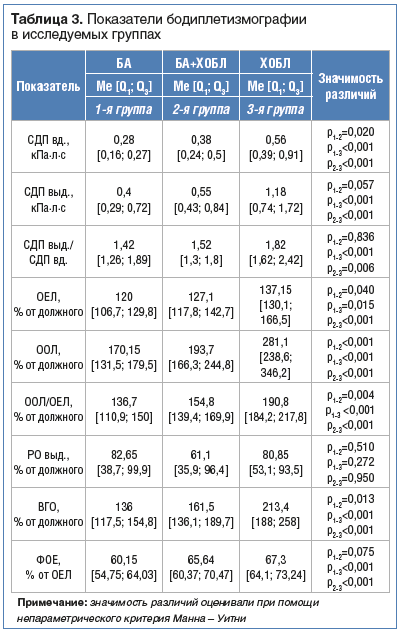
В группе больных ХОБЛ повышение бронхиального сопротивления, по данным бодиплетизмографии, ассоциировано с выраженностью клинических проявлений, о чем свидетельствует прямая корреляционная взаимосвязь между бронхиальным сопротивлением выдоха и суточной потребностью в КДБА (r=0,58; p=0,018). Кроме того, наличие гипервоздушности легочной ткани взаимосвязано с длительностью заболевания, что подтверждается прямыми корреляционными взаимосвязями с ООЛ/ОЕЛ, ООЛ (r=0,59, p=0,015; r=0,8, p
Среди маркеров воспаления дыхательных путей при БА большое внимание уделяется определению оксида азота в выдыхаемом воздухе, повышенное содержание которого считают наиболее ранним и достоверным маркером аллергического воспаления дыхательных путей [12, 19]. При ХОБЛ единичные данные противоречивые, а при сочетании БА и ХОБЛ и вовсе отсутствуют.
Согласно полученным данным, уровень оксида азота в выдыхаемом воздухе существенно выше при сочетанной патологии в сравнении с БА и ХОБЛ взятых в отдельности (р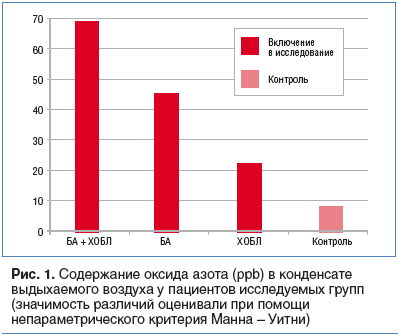
Отклонения клеточного состава индуцированной мокроты от нормы могут характеризовать тип воспаления, который определяют по содержанию в мокроте эффекторных воспалительных клеток — эозинофилов, нейтрофилов, лимфоцитов, макрофагов. Их количество зависит от активности процесса, т. к. именно они первыми реагируют на патогенный агент и запускают воспаление [20]. Одним из основных методов исследования является подсчет клеток мокроты и формирование цитограммы, в которой указывается процентное содержание каждого типа клеток. В результате многочисленных исследований выделили 4 клеточных фенотипа: 1) эозинофильный (≥2% эозинофилов); 2) нейтрофильный (≥61% нейтрофилов); 3) смешанный; 4) неэозинофильный (эозинофилов
Так, в ходе анализа цитограммы индуцированной мокроты наибольшее содержание эозинофилов отмечалось при БА и при сочетанной патологии (табл. 4), что свидетельствует об эозинофильном типе воспаления [21].
Нейтрофилы рассматриваются не только как клетки, выполняющие функцию фагоцитоза и продуцирующие цитотоксические вещества при воспалении [19]. Они секретируют несколько протеиназ, таких, как нейтрофильная протеиназа, эластаза, нейтрофильный катепсин G и др., которые вызывают деструкцию паренхимы, участвуют в деградации эластина и тем самым приводят к развитию эмфиземы [22]. По данным Г.Б. Федосеева и соавт., при сочетании БА и ХОБЛ нейтрофильный фенотип мокроты встречается с частотой 59% [22] и может являться индикатором тяжелого течения заболевания. Для таких больных характерна низкая эффективность лечения ИГКС [23]. Согласно полученным данным, высокое содержание нейтрофильных клеток отмечается у больных ХОБЛ и у пациентов с сочетанием БА и ХОБЛ (см. табл. 4). Более того, во 2-й группе содержание нейтрофилов в индуцированной мокроте ассоциировано с повышением объема базисной терапии, что подтверждено прямой корреляционной связью между количеством данных клеток и дозой ИГКС (r=0,70, р=0,021).
Таким образом, клеточный состав индуцированной мокроты меняется в зависимости от заболевания. Наибольшие изменения в цитограмме претерпевает содержание эозинофилов и нейтрофилов. Наличие разнообразного спектра эффекторных клеток при сочетании БА и ХОБЛ, включая эозинофилы и нейтрофилы, свидетельствует о смешанном паттерне воспаления.
Выводы
Сравнительный анализ показал, что при сочетании БА и ХОБЛ отмечается более выраженная гипервоздушность, проявляющаяся повышением функциональной остаточной емкости легких и внутригрудного объема, что может свидетельствовать о поражении дистальных бронхов и развитии легочной гиперинфляции.
При сочетанной патологии отмечается повышение уровня оксида азота в выдыхаемом воздухе, которое взаимосвязано с количеством обострений заболевания.
Хронический воспалительный процесс бронхолегочной системы при сочетании БА и ХОБЛ характеризуется нарушением физиологических соотношений отдельных клеточных популяций в индуцированной мокроте в сторону увеличения количества эозинофилов и нейтрофилов, что взаимосвязано с увеличением объема базисной терапии.
Литература
1. Урясьев О.М., Рогачиков А.И. Роль оксида азота в регуляции дыхательной системы // Наука молодых — Eruditio Juvenium. 2014. №2. С.133–140 [Urjas’ev O.M., Rogachikov A.I. Rol’ oksida azota v reguljacii dyhatel’noj sistemy // Nauka molodyh — Eruditio Juvenium. 2014. №2. S.133–140 (in Russian)].
2. Ненашева Н.М. Персонализированная терапия бронхиальной астмы: реалии и перспективы // Практическая пульмонология. 2013. №4. С.12–18 [Nenasheva N.M. Personalizirovannaja terapija bronhial’noj astmy: realii i perspektivy // Prakticheskaja pul’monologija. 2013. №4. S.12–18 (in Russian)].
3. Шмелев Е.И. Сочетание бронхиальной астмы и хронической обструктивной болезни легких // Международный медицинский журнал. 2006. №3. С.49–53 [Shmeljov E.I. Sochetanie bronhial’noj astmy i hronicheskoj obstruktivnoj bolezni ljogkih // Mezhdunarodnyj medicinskij zhurnal. 2006. №3. S.49–53 (in Russian)].
4. Bateman E., Reddel H.K., van Zyl-Smit R.N. The asthma-COPD overlap syndrome: towards a revised taxonomy of chronic airways diseases // The Lancet Respiratory Medicine. 2015. Vol. 9. P.719–728.
5. Белевский А.С. Синдром перекреста бронхиальной астмы и хронической обструктивной болезни легких (по материалам совместного документа рабочих групп экспертов GINA и gold) // Практическая пульмонология. 2014. №2. С.12–19 [Belevskij A.S. Sindrom perekresta bronhial’noj astmy i hronicheskoj obstruktivnoj bolezni legkih (po materialam sovmestnogo dokumenta rabochih grupp jekspertov GINA i gold) // Prakticheskaja pul’monologija. 2014. №2. S.12–19 (in Russian)].
6. Wurst K.E., Kelly-Reif K., Bushnell G.A. Understanding asthma-chronic obstructive pulmonary disease overlap syndrome // Respiratory Medicine. 2016. Vol. 110(1). P. 1–11.
7. Лобанова Е.Г., Калинина Е.П., Кнышова В.В. и др. Особенности регуляции иммунного ответа у пациентов с коморбидным течением хронической обструктивной болезни легких и бронхиальной астмы // Пульмонология. 2014. №6. С.5–10. doi:10.18093/0869-0189-2014-0-6-5-10 [Lobanova E.G., Kalinina E.P., Knyshova V.V. i dr. Osobennosti reguljacii immunnogo otveta u pacientov s komorbidnym techeniem hronicheskoĭ obstruktivnoĭ bolezni legkih i bronhial’noĭ astmy // Pul’monologija. 2014. №6. S.5–10 doi:10.18093/0869-0189-2014-0-6-5-10 (in Russian)].
8. Шапорова Н.Л., Трофимов В.И., Марченко В.Н. Бронхиальная астма тяжелого течения // Пульмонология и аллергология. 2014. №4. С.3–6 [Shaporova N.L, Trofimov V.I, Marchenko V.N. Bronhial’naja astma tjazhjologo techenija // Pul’monologija i allergologija. 2014. №4. S.3–6 (in Russian)].
9. Дробик О.С., Битеева Д.В. Неконтролируемая бронхиальная астма — варианты решения проблемы // Астма и аллергия. 2013. №4 [Drobik O.S., Biteeva D.V. Nekontroliruemaja bronhial’naja astma — varianty reshenija problemy // Astma i allergija. 2013. №4 (in Russian)].
10. Прозорова Г.Г., Бурлачук В.Т., Трибунцева Л.В. и др. Клеточный состав индуцированной мокроты у больных бронхиальной астмой как прогностический критерий эффективности лечения заболевания // Журнал анатомии и гистопатологии. 2016. № 1(17). С.52–57 [Prozorova G.G, Burlachuk V.T, Tribunceva L.V, i dr. Kletochnyj sostav inducirovannoj mokroty u bol’nyh bronhial’noj astmoj kak prognosticheskij kriterij jeffektivnosti lechenija zabolevanija // Zhurnal anatomii i gistopatologii. 2016. № 1(17). S.52–57 (in Russian)].
11. Иванов А.Ф., Черняк Б.А. Эффективность тиотропия бромида в лечении пациентов с бронхиальной астмой // Пульмонология. 2014. №4. С.112–117 doi:10.18093/0869-0189-2014-0-4-112-117 [Ivanov A.F., Chernjak B.A. Jeffektivnost’ tiotropija bromida v lechenii pacientov s bronhial’noj astmoj // Pul’monologija. 2014. №4. S.112–117. doi:10.18093/0869-0189-2014-0-4-112-117 (in Russian)].
12. Зыков К.А., Агапова О.Ю., Бейлина В.Б. Новые подходы к лечению пациентов с сочетанием бронхиальной астмы и ХОБЛ – фокус на пролонгированные м-холинолитики // Российский медицинский журнал. 2014. №18. С.1836–1842 [Zykov K.A., Agapova O.Ju., Bejlina V.B. Novye podhody k lecheniju pacientov s sochetaniem bronhial’noj astmy i HOBL — fokus na prolongirovannye m-holinolitiki // Rossijskij medicinskij zhurnal. 2014. №18. S.1836–1842 (in Russian)].
13. Шмелев Е.И. Современные возможности коррекции одышки у больных хронической обструктивной болезнью легких // Пульмонология. 2013. №6. С.79–84 [Shmeljov E.I. Sovremennye vozmozhnosti korrekcii odyshki u bol’nyh hronicheskoj obstruktivnoj bolezn’ju ljogkih // Pul’monologija. 2013. №6. S.79–84 (in Russian)].
14. Белевский А.С., Княжеская Н.П. Сочетание хронической обструктивной болезни легких и бронхиальной астмы — лечебные возможности // Астма и аллергия. 2014. №2. С.13–16 [Belevskij A.S., Knjazheskaja N.P. Sochetanie hronicheskoj obstruktivnoj bolezni legkih i bronhial’noj astmy — lechebnye vozmozhnosti // Astma i allergija. 2014. №2. S.13–16 (in Russian)].
15. Ненашева Н.М. Фенотипы бронхиальной астмы и выбор терапии // Практическая пульмонология. 2014. №2. С.2–11 [Nenasheva N.M. Fenotipy bronhial’noj astmy i vybor terapii // Prakticheskaja pul’monologija. 2014. №2. S.2–11 (in Russian)].
16. Moore W.C., Meyers D.A., Wenzel S.E. Identification of asthma phenotypes using claster analysis in the Severe Asthma Research Program // American Journal of Respiratory and Critical Care Medicine. 2010. Vol. 181. P.315–323.
17. Miravitlles M., Soriano J.B., Ancochea J. Characterisation of the overlap COPD – asthma phenotype. Focus on physican activity and health status // The Respiatory Medicine. 2013. Vol. 107. P.1053–1060.
18. Miravitlles M., Soler-Cataluna J., Calle M. Spanish COPD Guidelines (Ges EPOC): pharmacological treatment of stable COPD // Spanish Society of Pulmonology and Thoracic Surgery. Arch. Broncopneumol. 2012. Vol. 48 (7). P.247–257.
19. Савушкина О.И., Черняк А.В. Теоретические и методические аспекты бодиплетизмографии и ее клиническое применение // Бюллетень физиологии и патологии дыхания. 2016. №60. С.117–124. doi:10.12737/20131 [Savushkina O.I, Chernjak A.V. Teoreticheskie i metodicheskie aspekty bodipletizmografii i ee klinicheskoe primenenie // Bjulleten’ fiziologii i patologii dyhanija. 2016. №60. S.117–124 doi:10.12737/20131 (in Russian)].
20. Ненашева Н.М., Фомина Д.С., Буриев Б.Б. Оксид азота в выдыхаемом воздухе как маркер контроля бронхиальной астмы // Российский аллергологический журнал. 2010. №2. С.32–36 [Nenasheva N.M, Fomina D.S, Buriev B.B. Oksid azota v vydyhaemom vozduhe kak marker kontrolja bronhial’noj astmy // Rossijskij allergologicheskij zhurnal. 2010. №2. S.32–36 (in Russian)].
21. Чучалин А.Г., Авдеев С.Н., Айсанов З.Р. Федеральные клинические рекомендации по диагностике и лечению хронической обструктивной болезни легких // Пульмонология. 2014. №3. С.15–35 [Chuchalin A.G, Avdeev S.N, Ajsanov Z.R. Federal’nye klinicheskie rekomendacii po diagnostike i lecheniju hronicheskoj obstruktivnoj bolezni ljogkih // Pul’monologija. 2014. №3. S.15–35 (in Russian)].
22. Федосеев Г.Б., Трофимов В.И., Негруца К.В. и др. Характеристика мокроты для оценки наличия и характера воспаления бронхолегочного аппарата у больных бронхиальной астмой и хронической обструктивной болезнью легких // Российский аллергологический журнал. 2015. №1. С.15–26 [Fedoseev G.B., Trofimov V.I., Negruca K.V. i dr. Harakteristika mokroty dlja ocenki nalichija i haraktera vospalenija bronholegochnogo apparata u bol’nyh bronhial’noj astmoj i hronicheskoj obstruktivnoj bolezn’ju legkih // Rossijskij allergologicheskij zhurnal. 2015. №1. S.15–26 (in Russian)].
23. Vaguliene N., Zemaitis M., Lavinskiene S. Local and systemic neutrophilic inflammation in patients with lung cancer and chronic obstructive pulmonary disease // BMC Immunology. 2013. Vol. 6. P.14–36.
24. Telenga E. Obesity in asthma: more neutrophilic inflammation as a possible explanation for a reduced treatment response // Allergy. 2012. Vol. 67. P.1060–1068.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru






