Кардиология
Материал и методы: в исследование вошли 48 пациентов с аритмическим вариантом миокардита (с наджелудочковой/желудочковой экстрасистолией, фибрилляцией предсердий). Критерием включения было повышение титров хотя бы 2 видов антикардиальных антител в ≥2 раза. Миокардит диагностирован с применением биопсии миокарда, коронарографии, алгоритма неинвазивной диагностики, включая анамнестические данные, магнитно-резонансную томографию и мультиспиральную компьютерную томографию сердца, сцинтиграфию миокарда. Всем пациентам проводилась стандартная кардиотропная и антиаритмическая терапия. У 22 пациентов (основная группа) дополнительно был проведен курс дискретного плазмафереза с удалением тромболейкослоя и полного объема циркулирующей плазмы. Остальные 26 пациентов вошли в группу сравнения. Динамика клинических и лабораторных показателей оценивалась через 6 и 12 мес.
Результаты исследования: в группе плазмафереза отмечено достоверное снижение титров антикардиальных антител непосредственно после плазмафереза и при контрольных исследованиях (p
Заключение: хороший клинический ответ на плазмаферез отмечен у 81,8% больных с аритмиями иммунно-воспалительного генеза. У больных аритмическим вариантом миокардита проведение плазмафереза повышает эффективность антиаритмической и иммуносупрессивной терапии и позволяет воздержаться от агрессивных режимов иммуносупрессии.
Ключевые слова: миокардит, желудочковая экстрасистолия, наджелудочковая экстрасистолия, фибрилляция предсердий, плазмаферез, иммуносупрессивная терапия.
Для цитирования: Куликова В.А., Недоступ А.В., Благова О.В., Зайденов В.А., Куприянова А.Г., Нечаев И.А., Рагимов А.А. Эффективность лечения аритмий иммунно-воспалительного генеза с помощью плазмафереза // РМЖ. 2018. №11(I). С. 18-26
V.A. Kulikova1, A.V. Nedostup1, O.V. Blagova1, V.A. Zaydenov2, A.G. Kupriyanova3, I.A Nechaev4, A.A. Ragimov4
1 Sechenov University, Moscow
2 Shumakov National Medical Research Center of Transplantology and Artificial Organs, Moscow
3 Veltishchev Research Clinical Institute of Pediatrics, Moscow
4 Sechenov University Blood Center, Moscow
Aim: to study the effectiveness of plasmapheresis as the main type of pathogenetic treatment or in combination with immunosuppressive therapy in patients with arrhythmias of immune-inflammatory genesis.
Patients and Methods: 48 patients with an arrhythmic variant of myocarditis (with supraventricular/ventricular premature beats, atrial fibrillation) were included in the study. The inclusion criterion was an increase in ≥2 times of titers of at least 2 types of anti-cardiac antibodies. Myocarditis was diagnosed using myocardial biopsy, coronary angiography, a non-invasive diagnostic algorithm including anamnestic data, magnetic resonance imaging and multispiral computed tomography of the heart, myocardial scintigraphy. All patients underwent standard cardiotropic and anti-arrhythmic therapy. An additional course of discrete plasmapheresis was performed in 22 patients (the main group) with the removal of the thrombo-leukocyte layer and the total circulating plasma volume. The remaining 26 patients entered the experimental group. Dynamics of clinical and laboratory parameters were evaluated after 6 and 12 months.
Results: in the plasmapheresis group, a significant decrease in anti-cardiac antibody titers was observed immediately after plasmapheresis and during control studies (p<0.05). A good clinical response (decrease in the number of extrasystoles and atrial fibrillation frequency ≥75%) was observed in 81.2% of patients of the plasmapheresis group and 57.7% of the experimental group. In 32% of patients of the main group, it was possible to completely cancel the anti-arrhythmic therapy due to the persistent suppression of myocarditis activity, which was not achieved in the experimental group. The most significant effect was observed in patients with ventricular premature beats. The good response of plasmapheresis was associated with a shorter duration of the disease and younger patients. The predictor of plasmapheresis efficiency was the titer of a specific antinuclear factor (antibodies to the nuclei of cardiomyocytes) 1:40-1:80 and more. More aggressive therapy of myocarditis with methylprednisolone in patients of the main group was conducted significantly less frequently (46%) than in patients of the experimental group (73%), p<0.05. Methylprednisolone doses were also lower in the plasmapheresis patient group than in the experimental group (7[3.5; 16] vs. 16[10; 24] mg per day, respectively, p=0.055).
Conclusion: good clinical response to plasmapheresis was observed in 81.8% of patients with arrhythmias of immune-inflammatory genesis. In patients with the arrhythmic variant of myocarditis, plasmapheresis conduction increases the effectiveness of anti-arrhythmic and immunosuppressive therapy and makes it possible to refrain from aggressive immunosuppression regimens.
Key words: myocarditis, ventricular premature beats, supraventricular premature beats, atrial fibrillation, plasmapheresis, immunosuppressive therapy.
For citation: Kulikova V.A., Nedostup A.V., Blagova O.V. et al. Treatment efficiency of arrhythmias of immune-inflammatory genesis by plasmapheresis // RMJ. 2018. № 11(I). P. 18–26.
В статье изучена эффективность плазмафереза в качестве основного вида патогенетического лечения или в сочетании с иммуносупрессивной терапией у больных с аритмиями иммунно-воспалительного генеза. Показано, что при аритмическом миокардите проведение плазмафереза повышает эффективность антиаритмической и иммуносупрессивной терапии.
Введение
Миокардит — это воспалительное заболевание миокарда, диагностируемое по установленным гистологическим, иммунологическим и иммуногистохимическим критериям. Миокардит является трудным для диагностики заболеванием в связи с гетерогенностью клинических проявлений [1]. Так, проявлениями хронического иммунного миокардита могут быть различные нарушения ритма, которые нередко рассматриваются как «идиопатические»: атриовентрикулярные блокады, наджелудочковые и желудочковые аритмии, включая желудочковую экстрасистолию (ЖЭ), устойчивую и неустойчивую желудочковую тахикардию, отличающиеся резистентностью к медикаментозной терапии [2]. При анализе причин внезапной сердечной смерти у молодых людей миокардит встречался в 2–42% случаев аутопсии. [1] Ряд исследований продемонстрировал наличие при магнитно-резонансной томографии (МРТ) и гистологическом исследовании признаков воспаления в миокарде как предсердий, так и желудочков при «идиопатической» фибрилляции предсердий (ФП) [3].
Развитие нарушений ритма при хроническом миокардите связывают с наличием различных аутоантител к структурам миокарда [1, 4], медиаторов воспаления (С-реактивный белок (СРБ), фибриноген, интерлейкин (ИЛ)-1, ИЛ-2, ИЛ-6, ИЛ-8, фактор некроза опухоли α), а также зон фиброза, которые приводят к электрической нестабильности миокарда. В связи с этим представляется важным поиск методов лечения, направленных на уменьшение иммунной активности при хроническом миокардите. Было показано, например, что использование иммуносупрессивной терапии (ИСТ) глюкокортикостероидами (ГКС) ведет к уменьшению частоты пароксизмов ФП [4]. Однако ГКС имеют ряд побочных эффектов, не всегда позволяющих широко применять их у пациентов с миокардитом. Имеются данные положительного опыта применения немедикаментозных методов лечения при инфекционно-иммунном миокардите с развитием синдрома дилатационной кардиомиопатии. У этой категории пациентов различные методы афереза (иммуносорбция, плазмаферез) улучшают функциональные показатели сердца и снижают активность воспаления, по данным контрольной эндомиокардиальной биопсии [5].
Применение методов афереза при аритмическом варианте миокардита практически не описывается в литературе. Авторы данной работы (А.В. Недоступ совместно с В.В. Панасюком (по неопубликованным данным)) применяли гемосорбцию у пациентов с медикаментознорезистентными нарушениями ритма и получали положительный эффект более чем в 50% случаев. В более позднем исследовании при выполнении плазмафереза у пациентов с нарушениями ритма сердца, резистентными к антиаритмической терапии, положительный эффект наблюдался у половины пациентов, а его продолжительность составляла около 3 мес. [6]. Однако маркеры воспалительной природы аритмий в данной работе не исследовались, механизм действия плазмафереза и конкретные точки его приложения остались не до конца ясными.
Цель настоящего исследования: изучение терапевтической эффективности плазмафереза у пациентов с аритмиями иммунно-воспалительного генеза, резистентными к медикаментозной терапии.
Материал и методы
В сравнительное проспективное нерандомизированное исследование включались пациенты с миокардитом и аритмиями, резистентными к максимально возможной антиаритмической терапии, либо при невозможности назначения им антиаритмических препаратов. Всего в исследование было включено 48 больных, 22 пациентам наряду со стандартной кардиотропной и антиаритмической терапией проведен курс дискретного плазмафереза (центрифуга Sorvall RC 3BP+ Thermo scientific, Германия) с удалением тромболейкослоя и полного расчетного объема циркулирующей плазмы. За одну процедуру замещалось от 250 до 500 мл плазмы, продолжительность курса и кратность проведения процедур подбирались индивидуально в зависимости от расчетного объема циркулирующей плазмы (в среднем 4–6 сеансов в течение недели). Замещение производилось физиологическим раствором. Проводился контроль уровня белков плазмы. Эти пациенты составили основную группу. Остальные 26 пациентов, которые отвечали критериям включения и которым проводилась стандартная кардиотропная и антиаритмическая терапия (без плазмафереза), вошли в группу сравнения. Необходимость назначения и степень агрессивности ИСТ пациентам обеих групп оценивалась в зависимости от уровня активности миокардита. Все пациенты подписали добровольное информированное согласие на участие в исследовании. Проведение исследования было одобрено локальным комитетом по этике Первого МГМУ им. И.М. Сеченова (протокол № 04-16 от 13.04.2016).
Критериями включения в исследование было как минимум двукратное повышение титров двух и более из следующих видов антикардиальных антител к антигенам: ядер кардиомиоцитов (специфический антинуклеарный фактор (АНФ)), эндотелия, волокон проводящей системы и кардиомиоцитов. У всех пациентов до включения в исследование определялась частая желудочковая/наджелудочковая экстрасистолия (НЖЭ), более 3000 в сутки, ФП (пароксизмы чаще одного раза в месяц), сохраняющиеся на фоне максимально возможной антиаритмической терапии. В результате комплексного обследования у всех больных диагностирован аритмический вариант миокардита.
Критериями невключения были:
1) противопоказания к проведению плазмафереза: терминальное состояние, наличие источника кровотечения, требующего хирургического лечения, возможность возникновения кровотечения (язвы, эрозии желудочно-кишечного тракта, опухоли), несанированный очаг инфекции, острая стадия гнойно-воспалительных процессов, жизнеугрожающие нарушения ритма (эпизод клинической смерти, фибрилляция желудочков в анамнезе), АД ниже 90/60 мм рт. ст.; 2) наличие структурно-функциональных изменений сердца, которые выходили за рамки аритмического варианта миокардита (гипертрофия левого желудочка (ЛЖ) от 14 мм и более, конечно-диастолический размер ЛЖ более 5,5 см, фракция выброса ЛЖ менее 45%); 3) наличие заболеваний и состояний, которые могли рассматриваться как невоспалительные причины аритмий (инфаркт миокарда, острый коронарный синдром в анамнезе; врожденные и ревматические пороки сердца; тиреотоксическое, гипертоническое сердце; гипертрофическая кардиомиопатия; амилоидоз, болезни накопления; диффузные болезни соединительной ткани; системные васкулиты; лимфопролиферативные заболевания; состояние после химиотерапии препаратами антрациклинового ряда; операция на сердце давностью менее 2 мес., включая стентирование коронарных артерий и радиочастотную абляцию (РЧА)).
Методы обследования. Всем пациентам выполнялись рутинные лабораторные исследования: общий, биохимический анализ крови, электрофорез белков, определение СРБ, ДНК кардиотропных вирусов в крови методом полимеразной цепной реакции, тиреотропных гормонов, а также электрокардиография (ЭКГ), эхокардиография, холтеровское мониторирование ЭКГ. Исследование антикардиальных антител производилось в ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова и НИИ педиатрии им. акад. Ю.Е. Вельтищева методом непрямого иммуноферментного анализа. Для исключения ишемической болезни сердца (ИБС) выполнялись нагрузочные тесты (тредмил-тест или сцинтиграфия миокарда с нагрузкой, n=21) и коронароангиография (n=10). Для неинвазивной диагностики миокардита проведены также МРТ сердца с гадолинием (n=13), мультиспиральная компьютерная томография (МСКТ) сердца с в/в контрастированием (n=15), сцинтиграфия миокарда (n=25). Применялся алгоритм неинвазивной диагностики миокардита [7], включающий оценку анамнестической триады (острое начало заболевания, связь развития с перенесенной инфекцией, давность менее года), повышения титра антикардиальных антител, наличия отсроченного контрастирования при МСКТ или МРТ или диффузного неравномерного распределения радиофармпрепарата при сцинтиграфии. Морфологическое исследование миокарда (эндомиокардиальная биопсия) для верификации диагноза миокардита выполнено у 5 (10,4%) пациентов.
Непосредственно после выполнения плазмафереза (для основной группы) и в динамике в сроки полгода и год (в обеих группах) оценивался уровень антикардиальных антител, а также проводилось контрольное холтеровское мониторирование ЭКГ. В зависимости от иммунной активности миокардита, выраженности нарушений ритма, эффекта антиаритмической терапии и плазмафереза (в основной группе) индивидуально определялся объем ИСТ миокардита, характеристика которой будет представлена в разделе «Результаты». В соответствии с данными контрольных обследований при снижении частоты ФП или количества ЖЭ/НЖЭ на 75% и более пациенты относились к группе ответивших на лечение, в противном случае — к группе не ответивших на лечение.
Статистическая обработка данных проводилась при помощи программы IBM SPSS Statistics v.21. Проверка на нормальность распределения выполнялась с помощью теста Шапиро — Уилка. Количественные признаки представлены как М±SD (среднее ± 1 стандартное отклонение) или в виде квартилей 50 [25; 75]. Сравнение относительных показателей проводилось при помощи χ2 или точного теста Фишера, а также при помощи Т-теста Стьюдента, U-теста Манна — Уитни и Уилкоксона для количественных показателей. Различия считались достоверными при p
Результаты исследования
Характеристика больных. В таблице 1 представлены исходные клинические данные пациентов, методы обследования и лечения, включая объем проводимой антиаритмической терапии до начала исследования.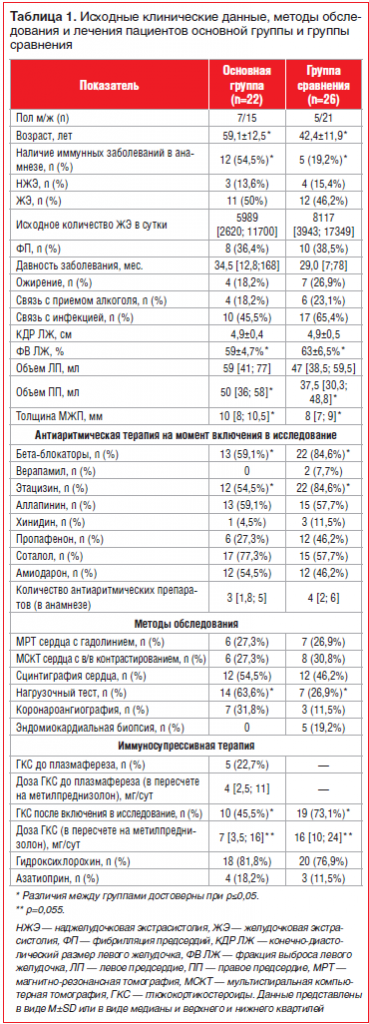
Основная группа и группа сравнения не различались по полу, характеру нарушений ритма, давности заболевания, наличию ожирения, связи развития аритмий с приемом алкоголя и перенесенной инфекцией. Стоит отметить, что пациенты группы плазмафереза были достоверно старше больных группы сравнения и чаще имели такие сопутствующие иммунные заболевания, как сахарный диабет 1-го типа, аутоиммунный тиреоидит, узловой зоб, бронхиальную астму, поллиноз и пр. Среди данных ЭхоКГ обращали на себя внимание достоверно больший объем правого предсердия и толщина межжелудочковой перегородки, а также меньшая фракция выброса ЛЖ в основной группе, которые при этом не выходили за рамки нормальных показателей. Исходная частота НЖЭ у пациентов основной группы составляла 4322, 5500 и 9505 в сутки для каждой из трех пациенток и 11701 [1204; 23050] в сутки у пациентов в группе сравнения.
В основной группе достоверно реже назначались в качестве антиаритмической терапии бета-блокаторы и этацизин и достоверно чаще выполнялись нагрузочные тесты (тредмил-тест или сцинтиграфия миокарда с нагрузкой), что связано с более старшим возрастом пациентов основной группы и более частой необходимостью исключения у них противопоказаний (в первую очередь ишемии) к назначению антиаритмических препаратов 1С класса. У пациентов обеих групп в процессе подбора терапии (на этапе, предшествовавшем включению в исследование) использовалось в среднем по 3–4 антиаритмических препарата, что свидетельствует об устойчивости нарушений ритма к лечению; потребность в назначении амиодарона возникла у половины больных обеих групп. У пациентов с НЖЭ чаще назначались этацизин и бета-блокаторы, с ФП — амиодарон, соталол, аллапинин, бета-блокаторы, с ЖЭ — этацизин, аллапинин, соталол и бета-блокаторы.
Лабораторная эффективность плазмафереза. Уровень антикардиальных антител оценивался при включении в исследование, а затем в сроки непосредственно после плазмафереза, через 6 [6; 7] и 12 [10,8; 15] мес. в основной группе и через 6 [4; 7] и 12 [10; 15] мес. в группе сравнения (табл. 2). В основной группе было отмечено достоверное снижение уровня почти всех антикардиальных антител (за исключением антител к антигенам кардиомиоцитов, титр которых исходно был наименьшим, его снижение не достигло степени достоверности) непосредственно после курса плазмафереза. Эффект плазмафереза в отношении титра антител был достаточно стойким: в течение всего срока наблюдения сохранялось достоверное снижение уровня антител к антигенам эндотелия и проводящей системы, менее выраженное снижение титра АНФ, хотя к концу года наметилась тенденция к частичной утрате лабораторного эффекта плазмафереза (титры антител недостоверно возросли по сравнению с уровнем сразу после плазмафереза и через полгода после него). В группе сравнения было отмечено лишь достоверное снижение уровня антител к антигенам кардиомиоцитов через полгода.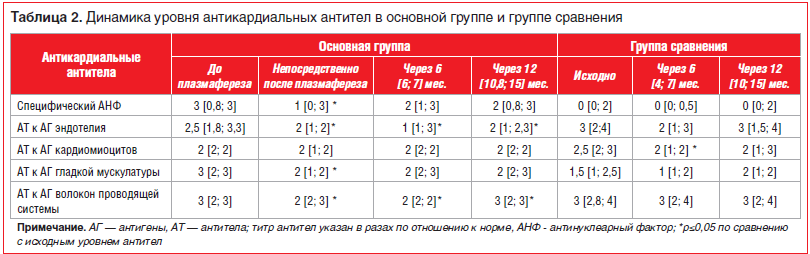
Достижение хорошего лабораторного эффекта плазмафереза (снижение иммунной активности миокардита) позволило уменьшить агрессивность ИСТ миокардита у больных основной группы без утраты клинического эффекта: ГКС были назначены достоверно реже, чем в группе сравнения (см. табл. 1, рис. 1); по частоте назначения гидроксихлорохина и азатиоприна пациенты обеих групп достоверно не различались. У 5 (22,7%) больных терапия ГКС проводилась еще до выполнения плазмафереза. Кроме того, в основной группе оказалась вдвое ниже, чем в группе сравнения, средняя доза ГКС в пересчете на метилпреднизолон, различия были близки к достоверным (p=0,055). Следует отметить, что в обеих группах использовались невысокие (в сравнении с принятыми при лечении более тяжелых вариантов миокардита) дозы ГКС, чем объясняется отсутствие достоверной динамики титра большинства антикардиальных антител в группе сравнения.
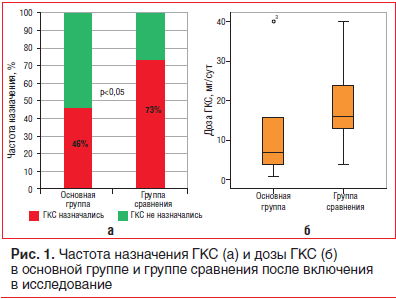
В основной группе осложнений от проведения плазмафереза не наблюдалось, у одной пациентки на фоне ИСТ глюкокортикостероидами в дозе 40 мг/сут было отмечено появление миопатии и сыпи. В группе сравнения у 9 пациентов было отмечено возникновение осложнений от приема ГКС (стероидный диабет, миопатия, гирсутизм и др.). Осложнения терапии ГКС стали основанием для коррекции доз или постепенной отмены препаратов и во всех случаях носили обратимый характер.
Далее оценивалась клиническая эффективность комплексной терапии (антиаритмической и ИСТ) у больных после плазмафереза в сопоставлении с группой сравнения. Контроль холтеровского мониторирования проводился в сроки непосредственно после плазмафереза, через 6 [5; 7] и 14 [12; 15] мес. в основной группе и через 6 [4,3; 8,8] и 12 [10; 15,5] мес. в группе сравнения. В основной группе у 18 пациентов (81,8%) было отмечено улучшение в виде уменьшения экстрасистолии на 75% и более и частоты ФП. В группе сравнения ответили на терапию 15 (57,7%) пациентов (рис. 2). При этом у 7 пациентов (32%) основной группы удалось полностью отменить антиаритмическую терапию за счет стойкого подавления активности основного заболевания (миокардита), чего ни разу не было достигнуто в группе сравнения.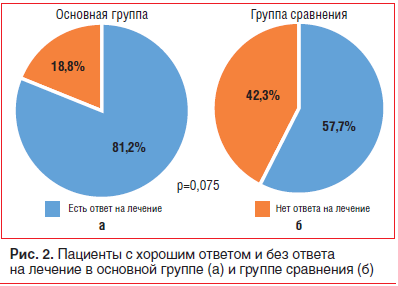
Эффективность плазмафереза при разных видах нарушений ритма была различной (рис. 3). Из 3 пациентов с НЖЭ 2 ответили на лечение. У одной пациентки, не ответившей на лечение плазмаферезом, было отмечено уменьшение количества экстрасистол на 73%, что не позволило формально отнести ее в группу хорошего ответа на плазмаферез, однако к годовому сроку наблюдения ей была полностью отменена антиаритмическая терапия с учетом хорошего клинического эффекта (стойкого отсутствия НЖЭ). У 1 пациентки с НЖЭ было отмечено полное подавление экстрасистолии, и полностью отменена ИСТ, однако в течение полугода возникло несколько эпизодов желудочковой тахикардии, обусловленной наличием фиброзного очага в ЛЖ (по данным МРТ и электроанатомического картирования), по поводу чего была выполнена успешная РЧА.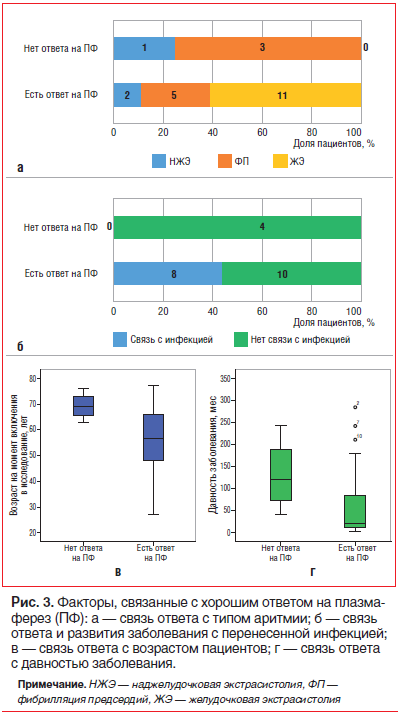
У пациентов с ЖЭ (11 больных) был отмечен хороший ответ на лечение. При этом у 4 (36%) пациентов к концу срока наблюдения была полностью отменена ИСТ, у 3 (27%) полностью отменена антиаритмическая терапия, у 8 (73%) отмечено восстановление эффективности ранее неэффективной антиаритмической терапии и в качестве антиаритмиков после выполнения плазмафереза чаще всего использовались бета-блокаторы.
Хороший клинический ответ на плазмаферез отмечен у 5 (63%) пациентов с ФП. У 3 пациентов после плазмафереза и в течение всего срока наблюдения не было зарегистрировано ни одного пароксизма ФП, 2 пациентам была полностью отменена антиаритмическая терапия, у 3 стала эффективна ранее неэффективная терапия амиодароном. Успешная РЧА выполнена у 2 пациентов с отсутствием эффекта комплексной терапии, одному пациенту имплантирован электрокардиостимулятор в связи с признаками синдрома слабости синусового узла.
Из 10 пациентов с ФП ответили на лечение 6 (60%), при этом антиаритмическая терапия не была отменена ни у одного пациента, ИСТ была отменена у 1 пациента. Из 4 пациентов с НЖЭ ответил на лечение 1 (25%). Из 12 пациентов с ЖЭ ответили на лечение 8 (66,7%). У 5 пациентов была отменена антиаритмическая терапия, у 2 — ИСТ.
Далее были проанализированы возможные предикторы хорошего ответа на плазмаферез (табл. 3). Как отмечено выше, первым фактором, ассоциированным с хорошим ответом на плазмаферез, был непосредственно тип аритмии: наилучший ответ на плазмаферез был отмечен у пациентов с ЖЭ, близкий уровень эффективности — у пациентов с НЖЭ. Наличие ФП ассоциировалось с менее выраженной
эффективностью комплексной терапии (как медикаментозной, так и плазмафереза).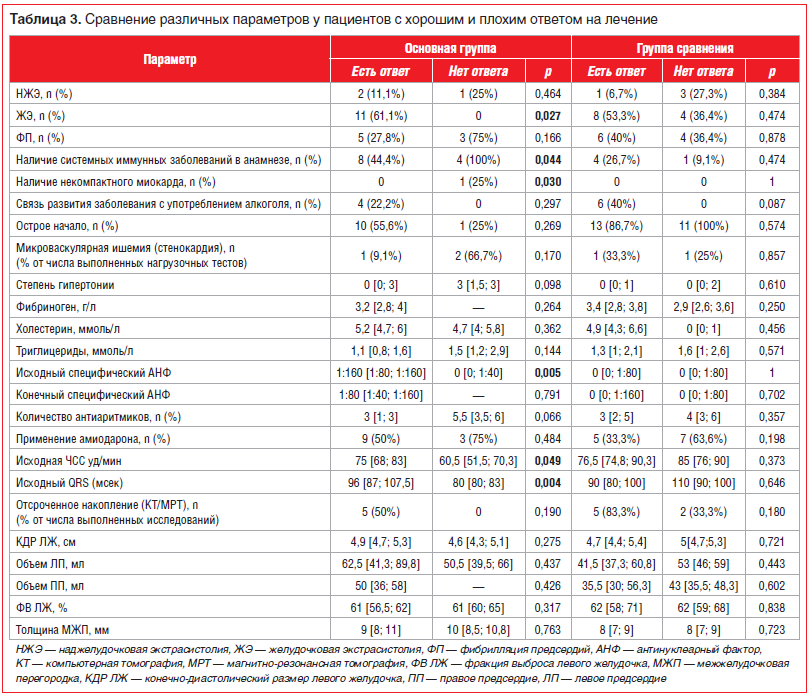
Кроме того, хороший эффект плазмафереза ассоциировался с рядом признаков, которые характеризуют активность и давность миокардита. Отмечена связь хорошего эффекта плазмафереза с наличием связи дебюта заболевания с перенесенной инфекцией, меньшей давностью заболевания, а также более молодым возрастом (рис. 3), однако различия по этим параметрам не достигали степени достоверности.
Единственным достоверным предиктором эффективности плазмафереза у пациентов основной группы стал исходно высокий уровень антител к ядрам кардиомиоцитов (специфического АНФ). Его титр от 1:40 —1:80 и выше (в норме он отсутствует) обладал чувствительностью 88,9% и специфичностью 100% в предсказании хорошего ответа на плазмаферез, AUC — 0,931 по данным ROC-анализа (p=0,008) (рис. 4).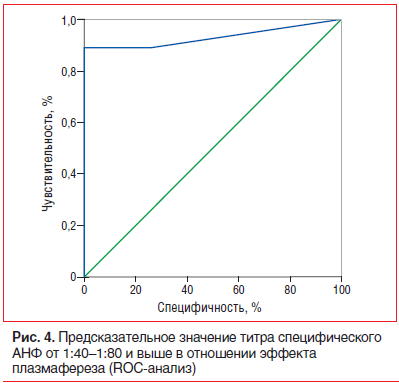
Обсуждение
В настоящем исследовании впервые изучено применение терапевтического плазмафереза у пациентов с аритмическим вариантом миокардита в сопоставлении с группой сравнения. Отметим, что ранее исследования проводились в нескольких направлениях: применение плазмафереза у больных с устойчивыми к лечению аритмиями различной этиологии, а также у пациентов с тяжелым (декомпенсированным) или высокоиммунным (эозинофильным, лекарственным, в рамках системных иммунных заболеваний) вариантами миокардита, основным проявлением которых является, наряду с возможными аритмиями и блокадами, развитие синдрома дилатационной кардиомиопатии и сердечной недостаточности [5].
В литературе встречаются лишь единичные упоминания успешного применения методов афереза в составе комплексной терапии аритмий, обусловленных воздействием аутоантител к различным антигенам сердца: так, недавно описана серия из 12 случаев врожденных блокад у детей с антителами к антигенам проводящей системы (SSA/Ro и SSB/La), которых относительно успешно лечили недельным курсом плазмафереза, в/в вливанием иммуноглобулина и малыми дозами бетаметазона (после 3 лет наблюдения стимуляторы имплантированы половине детей с врожденной блокадой III степени, при II степени блокады вмешательств не потребовалось) [8]. Той же группой авторов плазмаферез в составе комбинированной терапии был с успехом применен у беременной женщины с АВ-блокадой, обусловленной наличием аутоантител к SSA/Ro и SSB/La [9]. Применение плазмафереза при врожденных блокадах в рамках системной красной волчанки (при которой вырабатываются указанные виды антител) описано и в других исследованиях [10]. Вместе с тем работ по изучению эффекта плазмафереза при более широком спектре иммунно-воспалительных нарушений ритма сердца в литературе по-прежнему нет.
Единственное целенаправленное исследование эффективности плазмафереза у больных с медикаментознорезистентными нарушениями ритма проведено нами (А.В. Недоступ, А.Г. Рагимов) совместно с Д.А. Царегородцевым на рубеже 2000-х годов [6]. В исследование вошли 52 пациента с нарушениями ритма различной этиологии, лишь в 19,6% случаев аритмии были расценены как идиопатические, у остальных в качестве причины нарушений ритма рассматривались ИБС, пороки и другие структурные заболевания сердца, среди которых упоминаются миокардиодистрофии и постмиокардитический кардиосклероз (у части больных ретроспективно можно предполагать наличие миокардита). В качестве возможных «гуморальных аритмогенных факторов» изучены неэстерифицированные жирные кислоты, продукты перекисного окисления липидов, реологические характеристики крови, однако найти бесспорный гуморальный маркер, ответственный за развитие аритмий и чувствительный к плазмаферезу, не удалось.
Установлено, что на эффективность плазмафереза влияли преимущественно негуморальные факторы: этиология и вид аритмии (результаты были лучше при наличии ИБС и ФП), размеры левого предсердия, сочетанная медикаментозная антиаритмическая терапия; из гуморальных факторов лишь уровень холестерина и триглицеридов оказались связаны с результатом лечения. Иммунные маркеры как предикторы ответа на плазмаферез в данной работе не изучались, хотя предполагалось, что в преодолении резистентности к антиаритмикам, достигнутой у ряда больных, может играть роль удаление антител к препаратам. Соответственно ИСТ не назначалась; кроме того, в работе отсутствовала группа сравнения.
При различной этиологии аритмий и отсутствии очевидной точки приложения плазмафереза его эффективность составила в данном исследовании 50%, эффект в среднем сохранялся в течение 3 мес., что меньше, чем в нашей работе: хороший эффект плазмафереза отмечен нами у 81,8% пациентов, причем он сохранялся в течение всего срока наблюдения в среднем до года (максимально 45 мес.). Интересно, что в работе Д.А. Царегородцева и соавт. худший эффект был получен у больных с экстрасистолией (в сравнении с ФП), причины чего можно искать в различной (преимущественно невоспалительной?) ее этиологии. Объяснением более высокой эффективности плазмафереза в нашем исследовании (в целом и у пациентов с различными видами аритмий) могут служить два обстоятельства: иммунно-воспалительная этиология и наличие у всех пациентов исходного субстрата для воздействия плазмафереза (высоких титров антикардиальных антител), а также назначение ИСТ, которая позволила не только сохранить достигнутый иммунологический и клинический эффект плазмафереза, но и полностью отменить антиаритмики у каждого третьего больного.
Эффект от проведения плазмафереза был получен нами не у всех больных, что делало целесообразным поиск предикторов его эффективности. Худший результат комплексного лечения у пациентов с ФП представляется закономерным: у больных с миокардитом субстратом данной аритмии служат нередко необратимые изменения миокарда — фиброз и липоматоз, что подтверждают и результаты биопсии миокарда правого желудочка у 5 больных из группы сравнения. Четкой корреляции эффекта плазмафереза с наличием отсроченного накопления по данным МРТ или МСКТ сердца нами не отмечено, что может объясняться невысокой чувствительностью данных методик при аритмическом варианте миокардита (в сравнении с острым и инфарктоподобным вариантами) [11]. Подтверждением роли необратимых структурных изменений в миокарде в отсутствие эффекта плазмафереза служит тот факт, что эффективность плазмафереза ассоциировалась с более молодым возрастом и с меньшей давностью заболевания наших пациентов.
Единственным достоверным предиктором эффективности плазмафереза стал исходно высокий уровень специфического АНФ: в титре 1:40–1:80 и более он обладал высокой чувствительностью и специфичностью. Этот вид антикардиальных антител отражает высокую иммунную активность болезни (его морфологическим эквивалентом является эмпериполезис с лизисом ядер кардиомиоцитов), что позволяет напрямую связывать эффект плазмафереза с уменьшением иммунной активности миокардита. Не отмечено корреляции клинического эффекта с промежуточными и конечными титрами антикардиальных антител, однако этот факт может объясняться более сложным, чем механическое удаление из крови антител, эффектом плазмафереза. В частности, можно предполагать преимущественное удаление АНФ и других видов антител из тканей (миокарда) с поддержанием определенной их концентрации в крови.
Тем не менее снижение титра антикардиальных антител в группе плазмафереза было достоверным и сохранялось на протяжении всего срока наблюдения. Отсутствие такого снижения в группе сравнения можно рассматривать как одну из ведущих причин меньшей эффективности лечения в группе сравнения. Несмотря на достоверно более молодой возраст пациентов группы сравнения, эффективность лечения была выше в основной группе (81,8% против 57,7%). Обращает на себя внимание более высокая частота встречаемости сопутствующих аллергических и иммунных заболеваний у пациентов основной группы, что, вероятно, отражало большую иммунную активность у этих пациентов и могло способствовать лучшему ответу на лечение. В одной из работ у пациентов с ФП, которым проводилось лечение ГКС, отмечена связь высокого уровня СРБ и частоты ФП, причем лечение ГКС снижало частоту пароксизмов ФП и уровень СРБ [4].
Очень значимым результатом нашего исследования явился лучший эффект в группе плазмафереза при одновременном использовании менее агрессивной, чем в группе сравнения, ИСТ: терапия стероидами проводилась в основной группе достоверно реже и в более низких дозах. Использованные в основной группе дозы ГКС были существенно ниже средних, в то время как средняя доза ГКС (16 мг/сут) в группе сравнения хотя и не является высокой, но сопряжена с реальным риском развития побочных эффектов. Нам представляется, что полученные результаты позволяют рекомендовать плазмаферез в качестве дополнительного и весьма эффективного метода лечения аритмического варианта миокардита, особенно при наличии устойчивой к лечению аритмии, высокой иммунной активности и нежелательности назначения средних и высоких доз ГКС.
Заключение
Хороший клинический эффект в виде уменьшения количества экстрасистол и/или частоты ФП на 75% и более отмечен у 81,8% пациентов после плазмафереза и у 57,7% пациентов группы сравнения (p=0,075). Наиболее значимый эффект отмечен у пациентов с ЖЭС (все пациенты с ЖЭС ответили на лечение). Полностью была отменена антиаритмическая терапия у 7 (32%) пациентов основной группы, у остальных больных, ответивших на лечение, восстановился эффект ранее неэффективных антиаритмиков. Исходное повышение специфического АНФ 1:40–1:80 и более (т. е. выявление АНФ в любом титре) являлось предиктором эффективности плазмафереза (AUC — 0,931, чувствительность — 88,9%, специфичность — 100%). Применение плазмафереза позволило достоверно реже использовать ГКС в основной группе, чем в группе сравнения (45,5% против 73,1%, p
Литература
1. Caforio A.L., Pankuweit S., Arbustini E. et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases // Eur Heart J. 2013. Vol. 34(33). P.2636–2648.
2. Pieroni M., Smaldone C., Bellocci F. Myocarditis Presenting with Ventricular Arrhythmias: Role of Electroanatomical Mapping-Guided Endomyocardial Biopsy in Differential Diagnosis // Myocarditis by Dr. Daniela Cihakova. Intech Open. 2011. 428. P.365–386.
3. Mitrofanova L.B., Orshanskaya V., Ho S.Y. et al. Histological evidence of inflammatory reaction associated with fibrosis in the atrial and ventricular walls in a case-control study of patients with history of atrial fibrillation // Europace. 2016. Vol. 18 (suppl 4). P.156–162.
4. Lewek J., Kaczmarek K., Cygankiewicz I. Inflammation and arrhythmias: potential mechanisms and clinical implication // Expert Rev Cardiovasc Ther. 2014. Vol. 12(9):107. P.7–85.
5. Schwartz J., Winters J.L., Padmanabhan A. et al. Guidelines on the use of therapeutic apheresis in clinical practice — evidence-based approach from the writing committee of the American Society for Apheresis: The Sixth Special Issue // J Clin Apher. 2013. Vol. 28(3) P.145–284.
6. Недоступ А.В., Царегородцев Д.А., Рагимов А.А. и др. Использование плазмафереза при лечении нарушений ритма сердца, резистентных к лекарственной терапии // Терапевтический архив. 2002. Т.74. №12. С.41–46 [Nedostup A.V., Czaregorodcev D.A., Ragimov A.A., i dr. Ispol`zovanie plazmafereza pri lechenii narushenij ritma serdcza, rezistentny`x k lekarstvennoj terapii // Terapevticheskij arxiv. 2002. T.74. №12. S.41–46 (in Russian)].
7. Благова О.В., Осипова Ю.В., Недоступ А.В. и др. Клинические, лабораторные и инструментальные критерии миокардита, установленные в сопоставлении с биопсийным исследованием миокарда (алгоритм неинвазивной диагностики) // Терапевтический архив. 2017. Т.89. №9. С.30–40 [Blagova O.V., Osipova Yu.V., Nedostup A.V. i dr. Klinicheskie, laboratorny`e i instrumental`ny`e kriterii miokardita, ustanovlenny`e v sopostavlenii s biopsijny`m issledovaniem miokarda (algoritm neinvazivnoj diagnostiki) // Terapevticheskij arxiv. 2017. T.89. №9. S.30–40 (in Russian)].
8. Ruffatti A., Cerutti A., Favaro M. et al. Plasmapheresis, intravenous immunoglobulins and bethametasone — a combined protocol to treat autoimmune congenital heart block: a prospective cohort study // Clin Exp Rheumatol. 2016. Vol. 34(4). P.706–713.
9. Tonello M., Ruffatti A., Marson P. et al. Plasma exchange effectively removes 52- and 60-kDa anti-Ro/SSA and anti-La/SSB antibodies in pregnant women with congenital heart block // Transfusion. 2015. Vol. 55(7). P.1782–1786.
10. Saxena A., Izmirly P.M., Mendez B. et al. Prevention and treatment in utero of autoimmune-associated congenital heart block // Cardiol Rev. 2014. Vol. 22(6). P.263–267.
11. Francone M., Chimenti C., Galea N. et al. CMR sensitivity varies with clinical presentation and extent of cell necrosis in biopsy-proven acute myocarditis // JACC Cardiovasc Imaging. 2014. Vol. 7(3). P.254–263.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru