Хроническая абдоминальная боль и синдром раздраженного кишечника
М. Ф. Осипенко, доктор медицинских наук, профессор
С. И. Холин, кандидат медицинских наук, доцент
А. Н. Рыжичкина, кандидат медицинских наук, доцент
Новосибирский ГМУ, Новосибирск
Серьезной проблемой внутренних болезней и гастроэнтерологии была и остается абдоминальная боль. Наибольшие сложности возникают при выявлении причин хронического болевого абдоминального синдрома. Понимание механизмов, лежащих в основе формирования болевого синдрома, отчасти может помочь в установлении его причины и выборе пути его купирования [2].
Появление боли связано с активацией ноцицепторов, расположенных в мышечной стенке полого органа, в капсулах паренхиматозных органов, в брыжейке и перитонеальной выстилке задней стенки брюшной полости, растяжением, напряжением стенки полого органа, мышечными сокращениями. Слизистая желудочно-кишечного тракта (ЖКТ) не имеет ноцицептивных рецепторов, поэтому ее повреждение не вызывает болевых ощущений. Воспаление, ишемия органов ЖКТ через выделение биологически активных субстанций (БАС): брадикинин, серотонин, гистамин, простагландины и др. приводят к изменению порога чувствительности сенсорных рецепторов либо напрямую их активируют. Эти же процессы могут провоцировать или усугублять спазм гладкой мускулатуры кишечника, что в свою очередь вызывает раздражение ноцицепторов и ощущение боли. Сигналы от кишечника передаются по афферентным волокнам через спинальные ганглии, достигают передних отделов головного мозга, где в постцентральной извилине происходит осознание ощущения боли. Эфферентные волокна идут на периферию и вызывают сокращение и расслабление гладкой мускулатуры, вазодилятацию. Большое количество различных нейронов оказывает модулирующее влияние на восприятие боли и ответ на нее.
В целом выделяют четыре основных механизма формирования абдоминальной боли: висцеральная, париетальная, иррадиирующая и психогенная.
Одним из вариантов абдоминальной боли вследствие органических причин может быть париетальная боль, возникающая из-за вовлечения брюшины. Она в основном острая, четко локализована, сопровождается напряжением мышц брюшной стенки, усиливается при изменении положения тела, кашле.
Наиболее частым механизмом абдоминальной боли является висцеральная боль, которая вызывается повышением давления, растяжением, натяжением, расстройством кровообращения во внутренних органах и может быть результатом как органических, так и функциональных заболеваний. Боль обычно носит характер тупой, спастический, жгучий, не имеет четкой локализации. Она нередко сопровождается разнообразными вегетативными проявлениями: потливостью, беспокойством, тошнотой, рвотой, бледностью. Благодаря большому количеству синапсов между нейронами нередко возникает двойная иннервация, лежащая в основе иррадиирующего характера боли. Под последней понимают отражение болевых ощущений при интенсивном висцеральном импульсе в области зон повышенной кожной чувствительности, в месте проекции других органов, иннервируемых тем же сегментом спинного мозга, что и вовлеченный орган.
На начальных этапах органические заболевания (аппендицит, дивертикулярная болезнь и пр.) могут сопровождаться висцеральной болью, затем в случае присоединения воспаления брюшины — париетальной.
Психогенная боль возникает при отсутствии соматических причин и обусловлена дефицитом ингибирующих факторов и/или усилением нормальных входящих афферентных сигналов, вследствие поражения центральных контролирующих механизмов и/или снижения синтеза БАС. Боль постоянная, резко снижающая качество жизни, не связана с нарушением моторики, с приемом пищи, перистальтикой кишечника, дефекацией и другими физиологическими процессами.
При функциональных заболеваниях механизмы формирования боли различны и могут носить изолированный или сочетанный характер: висцеральный генез нередко сочетается с иррадиирующим и/или психогенным механизмами. В основном боли носят дневной характер, редко возникают во время сна [4].
В практике значительно больше вероятность органической причины, лежащей в основе висцеральной боли, при наличии симптомов «тревоги», к которым относятся: преимущественно ночной характер боли, будящий больного ото сна; дебют симптомов в возрасте после 50 лет; наличие онкологических заболеваний в семье; наличие лихорадки у пациента; немотивированная потеря массы тела; выявленные при непосредственном исследовании больного изменения (гепатомегалия, спленомегалия и т. д.); изменения лабораторных показателей мочи, кала и крови; изменения, выявленные с помощью инструментальных исследований (камни в билиарном тракте, дивертикулы толстой кишки, расширенный общий желчный проток и т. д.).
Попытка дифференцировать абдоминальную боль, используя наименьшее количество нередко травматичных для пациента обследований, можно хорошо проиллюстрировать на синдроме раздраженного кишечника (СРК). Несмотря на наличие в названии термина «синдром» — эта патология относится к самостоятельным нозологическим формам. Согласно определению World Gastroenterology Organization (WGO), СРК — функциональное расстройство кишечника, при котором абдоминальная боль или дискомфорт ассоциированы с дефекацией или изменением кишечного транзита [20]. Сопутствующими симптомами могут быть вздутие, урчание, нарушения расстройства дефекации. Для постановки данного диагноза согласно Римским критериям III боль должна носить рецидивирующий характер, присутствовать хотя бы три дня в месяц в течение последних трех месяцев или больше и сочетаться хотя бы с двумя из следующих трех признаков: изменяться после дефекации, ее возникновение должно ассоциироваться с изменением частоты или формы стула. Симптомы должны беспокоить пациента три последние месяца, а впервые возникнуть шесть и более месяцев назад [12]. Для СРК, как и для большинства других функциональных заболеваний ЖКТ, характерен повышенный уровень депрессии, тревоги, склонности к ипохондрии.
Абдоминальная боль при СРК присутствует обязательно, но в зависимости от преобладающих нарушений пассажа по кишечнику возможны следующие варианты: СРК с диареей (частота жидкого стула более 25% времени, а плотных каловых масс менее 25%, чаще у мужчин), СРК с запором (твердый стул более 25% времени и соответственно жидкий менее 25%, чаще страдают женщины), СРК смешанного или циклического характера (разжиженный и твердый кал более 25%) [12, 20]. Согласно рекомендациям WGO возможно подразделение на подгруппы в зависимости от того, какие именно симптомы доминируют: СРК с преобладанием нарушений пассажа по кишечнику, СРК с преобладанием боли, СРК с преобладанием вздутия. И, наконец, соответственно провоцирующему фактору, возможно подразделение патологии на СРК постинфекционный, СРК, индуцированный приемом пищи (или определенными пищевыми продуктами), СРК стресс-индуцируемая.
Алгоритм действий практического врача разработан WGO и опубликован в 2009 году (схема). При наличии типичных признаков у пациента в возрасте до 50 лет, отсутствии признаков тревоги, при низкой частоте паразитарных инфекций и целиакии в популяции и отсутствии диареи, при отсутствии изменений результатов обычных рутинных исследований (общий анализ крови) вероятность СРК у данного пациента настолько высока, что нет необходимости в проведении других обследований [20].
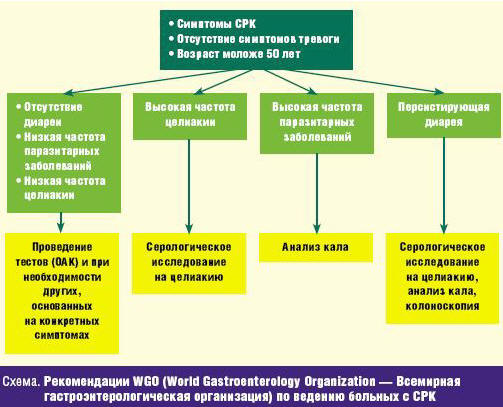
При наличии стойкого диарейного синдрома, высокой частоте целиакии или паразитарных заболеваний необходимо, соответственно, провести исследования на глютеновую энтеропатию, анализ кала для выявления паразитарных заболеваний и колоноскопию (при хроническом диарейном синдроме). При отсутствии отклонений от нормальных показателей диагноз СРК будет наиболее вероятен.
Хронический абдоминальный болевой синдром с нарушениями транзита по ЖКТ, характерный для СРК, имеет сходство с симптомами, возникающими при энтеропатиях (глютеновой, лактазной, паразитарной), колоректальном раке, микроскопическом, паразитарном колите, дивертикулите и некоторых гинекологических заболеваниях: эндометриозе, раке яичников. Связано это с единым висцеральным механизмом возникновения боли, к которому нередко присоединяется и иррадиирующий ее генез, что еще больше затрудняет определение локализации патологического процесса [17].
Купирование хронической абдоминальной боли является серьезной самостоятельной проблемой, поскольку не только устранение, но даже попытка установить основную причину ее возникновения не всегда удается. Учитывая, что часто боль носит сочетанный характер, приходится в реальной практике нередко пользоваться комбинацией различных средств.
Одним из подходов к купированию висцеральной боли является снятие мышечного спазма, который является универсальным механизмом гладкой мускулатуры реагировать на любые патологические воздействия, что неизбежно приводит к возбуждению ноцицепторов, расположенных в мышечном слое ЖКТ [1–4, 18].
Группа спазмолитических препаратов многообразна и довольно разнородна с точки зрения механизма действия и точки приложения, поскольку богатый рецепторный аппарат принимает участие в сокращении мышечного волокна, а также сам этот процесс сложный и многокомпонентный. Так, препараты, подавляющие сокращение мышечного волокна, могут реализовывать свое действие следующим образом:
- блокировать передачу нервного импульса на мышечное волокно (М-холиноблокаторы — атропин, платифиллин, гиосцина бутилбромид (Бускопан));
- подавлять открытие Na+-каналов и поступление Na+ в клетку (блокаторы натриевых каналов — мебеверин);
- подавлять открытие Ca+-каналов и поступление Са+ из внеклеточного пространства в цитоплазму и выход К+ из клетки — начальный этап реполяризации (блокаторы кальциевых каналов — пинаверия бромид, отилония бромид);
- подавлять активность фосфодиэстеразы, распад цАМФ, тем самым блокируя энергетические процессы мышечной клетки (блокаторы фосфодиэстеразы — альверин, дротаверин и др.);
- воздействовать через серотонинергические рецепторы, нарушая регуляцию транспорта ионов;
- воздействовать на опиоидные рецепторы (тримебутин);
- воздействовать на оксидазы (нитроглицерин и нитросорбид).
Назначение каждого препарата должно быть обосновано с позиций эффективности и безопасности. Чем более селективен препарат, тем меньшее число системных побочных эффектов он имеет.
Из всех селективных спазмолитических препаратов дольше всего в Европе применяется антихолинергическое четвертичное аммониевое соединение гиоcцина бутилбромид (Бускопан). Впервые препарат был зарегистрирован в Германии в 1951 г., и в настоящее время он относится к одному из наиболее изученных в эксперименте и в клинике и селективных в отношении ЖКТ спазмолитических препаратов. Важнейшими фармакологическими свойствами гиоcцина бутилбромида является его двойной расслабляющий эффект путем селективного связывания с мускариновыми рецепторами, расположенными на висцеральных гладких мышцах ЖКТ, и парасимпатический эффект блокирования нервных узлов через связывание с никотиновыми рецепторами, что обеспечивает избирательность подавления моторики ЖКТ.
Гиосцина бутилбромид вследствие высокой аффинности к мускариновым и никотиновым рецепторам распределяется главным образом в мышечных клетках органов брюшной полости и малого таза, а также в интрамуральных ганглиях органов брюшной полости. Поскольку препарат не переходит гематоэнцефалический барьер, частота системных антихолинергических (атропиноподобных) побочных реакций при использовании гиоcцина бутилбромида очень низкая и подобна плацебо. Поэтому целесообразность применения данного препарата очевидна и доказана для купирования боли висцерального компонента любого происхождения [1, 3, 18, 19].
Время наступления эффекта при приеме Бускопана внутрь составляет примерно 30 мин; продолжительность действия — 2–6 ч. После однократного применения гиосцина бутилбромида внутрь в дозах 20–400 мг средние пиковые концентрации в плазме достигаются примерно через 2 часа. Период полувыведения препарата после однократного применения внутрь в дозах 100–400 мг колеблется от 6,2 до 10,6 часа. Рекомендуемая доза при приеме внутрь: 10–20 мг 3–5 раз в день. Существует также лекарственная форма Бускопана в ректальных суппозиториях.
Опубликованное в 2006 г. сравнительное плацебо- и парацетамол-контролируемое исследование эффективности и переносимости гиоcцина бутилбромида при лечении рецидивирующих спастических болей в животе, проведенное на базе 163 клинических центров под руководством таких известных гастроэнтерологов, как С. Мюллер-Лисснер и Г. Н. Титгат, включало 1935 пациентов. Оно показало высокую эффективность и безопасность гиосцина бутилбромида при рецидивирующих абдоминальных болях [14].
Доказательством спазмолитического эффекта гиосцина бутилбромида является улучшение результатов инструментального исследования кишки при эндоскопическом и рентгенологическом исследовании, что продемонстрировано как увеличением просвета кишки, так и визуализацией полипов, дивертикулов, а также меньшей выраженностью болевых ощущений при проведении манипуляций [11, 15].
Примером эффективного купирования абдоминальной боли спазмолитиками является их применение при СРК [12].
Метаанализ, проведенный T. Poynard с соавторами, продемонстрировал, что многие спазмолитические препараты по отдельности (мебеверин, циметропия бромид, тримебутин, отилония бромид, гиосцина бутилбромид, пинаверия бромид) и в целом вся группа спазмолитиков (OR 2,13; 95% ДИ 1,77–2,58) эффективнее, чем плацебо, в лечении боли при СРК [16]. Так, вероятность улучшения состояния при применении гиосцина бутилбромида в лечении СРК в 1,56 раза выше (95% ДИ 1,14–2,15), чем при плацебо. В ряде работ показано, что, помимо спазмолитического эффекта, хороший анальгетический эффект Бускопана может быть связан и со снижением порога висцеральной гиперчувствительности, играющей важную роль в патогенезе СРК [10].
Спазмолитиками с доказанной эффективностью в лечении СРК с точки зрения специальной American Gollege Gastroenterology (ACG) являются гиосцина бутилбромид, циметропия бромид, пинаверия бромид и масло перечной мяты. Эти препараты могут купировать боль или дискомфорт при СРК [5].
Спазмолитики не только купируют боль, но также способствуют восстановлению пассажа содержимого и улучшению кровоснабжения стенки органа. Их назначение не сопровождается непосредственным вмешательством в механизмы болевой чувствительности и не затрудняет диагностику острой хирургической патологии.
Безусловно, важное место в купировании боли не только париетального генеза, но и висцерального и психогенного отводится анальгетикам. Всемирной Организацией Здравоохранения предложен следующий поэтапный подход к купированию боли: 1-я ступень — неопиоидные анальгетики, 2-я ступень — добавляются мягкие опиоиды, 3-я ступень — опиоидные анальгетики. Среди неопиоидных анальгетиков предпочтительнее назначать парацетамол из-за меньшего числа побочных эффектов на ЖКТ. В ряде исследований показан хороший эффект для купирования боли при комбинации спазмолитика гиосцина бутилбромида с анальгетиком парацетамолом [13].
Иногда приходится и при функциональных заболеваниях, в частности при СРК, применять прямые анальгетики. Назначения опиатов необходимо всячески избегать, так как при таких хронических состояниях высок риск развития привыкания и зависимости. Такие случаи описаны в литературе и носят название «narcotic bowel syndrome» (кишечный синдром, вызванный наркотическими препаратами). К критериям этого состояния относится хроническая или часто рецидивирующая прогрессирующая со временем боль, которую нельзя объяснить конкретной патологией, для купирования которой требуются большие дозы наркотических препаратов, которая нарастает при отмене опиатов и быстро купируется при их применении [8, 9].
Эффект антидепрессантов потенцировать и усиливать анальгетический эффект других препаратов хорошо известен и доказан. Принимая во внимание наличие психогенного механизма боли при функциональных заболеваниях, выявляемые клинически психоэмоциональные особенности больных (склонность к депрессиям, высокий уровень тревоги), понятен интерес к психотропным препаратам при СРК. Недавно опубликованный системный обзор хотя и указывает на дефекты некоторых дизайнов исследований, представил доказательства в поддержку использования антидепрессантов (как трицикличных, так и селективных ингибиторов повторного захвата серотонина) при СРК (амитриптилин 10–75 мг/день на ночь; селективные ингибиторы повторного захвата серотонина: пароксетин, 10–60 мг/день, циталопрам, 5–20 мг/день) [6, 20].
Объяснение генеза симптомов и прежде всего абдоминальной боли с учетом уровня образования, социального статуса больного, установление доверительных сопереживающих отношений между врачом и пациентом приносит эффект в купировании симптомов [7].
Коррекцию питания с целью уменьшения боли и купирования других симптомов следует использовать с определенной осторожностью, чтобы не вызвать нутритивных проблем у пациента (дефицита микроэлементов, витаминов, других питательных ингредиентов).
Убедительной связи между абдоминальной болью и другими симптомами при СРК не существует. Применение средств, эффективных для купирования различных расстройств при СРК, не оказывало влияния на выраженность болевого синдрома. При наличии СРК с запорами применяются различные классы слабительных средств, клетчатка и другие объемформирующие препараты. Хорошая доказательная база существует в отношении осмотических слабительных (препаратов лактулозы, полиэтиленгликоля в индивидуальных дозировках). Для ускорения получения нормализующего эффекта на пассаж по ЖКТ при СРК с запорами короткими курсами можно назначать раздражающие слабительные (Дульколакс и др.). Для лечения СРК с запорами женщинам возможно применение селективного активатора С-2 хлоридных рецепторов — лубипростона [6]. Есть данные о целесообразности применения пробиотического штамма Bifidobacterium lactis DN-173 010 в целях ускорения транзита по кишечнику.
Основным препаратом для лечения СРК с диареей является лоперамид, требующий индивидуального подбора дозировки. При тяжелом диарейном синдроме у женщин в ряде стран зарегистрирован для применения антагонист серотонинергических рецепторв (5-НТ3)-алосетрон [6, 20]. Для уменьшения газообразования применяют сорбенты и другие пеногасители, а также в некоторых рекомендациях назван антибиотик рифаксимин (по 400 мг 3 раза в день).
Некоторое влияние на улучшение общего состояния и уменьшение болевого синдрома продемонстрировали антагонист серотонинергических рецепторов (5-НТ3)-алосетрон (при СРК с диарейным синдромом), селективный активатор С-2 хлоридных рецепторов — лубипростона (у женщин с запорами) и пробиотический штамм Bifidobacterium infantis 35624.
Для купирования боли и других симптомов при функциональной патологии, в частности при СРК, применяют разнообразные методы терапии, включая психологические: когнитивная/поведенческая терапия, релаксационные методы, гипноз. ACG утверждает, что психологические методы терапии, включающие когнитивную терапию, динамическую психотерапию и гипнотерапию более эффективны в купировании общих симптомов СРК, чем стандартные методы лечения. Отношение к фитотерапии и акупунктуре в целом на сегодняшний день оптимистично сдержанное.
На течение любой патологии и особенно СРК во многом оказывают влияние как личностные особенности пациента (отношение к лечению, уровень тревоги и степень доверия/недоверия к медицинским манипуляциям, наличие хронических психотравмирующих ситуаций, индивидуальные эмоциональные особенности, а также психические заболевания), так и поведение медицинского персонала (способность установления контакта и доверительных отношений, возможность психологической поддержки пациента). Важным моментом, всегда повышающим степень доверия пациента к доктору, является быстрое купирование болевого синдрома. Поэтому выбор препаратов должен быть сделан грамотно и своевременно.
Литература
- Баранская Е. К. Боль в животе: клинический подход к больному и алгоритм лечения. Место спазмолитической терапии в лечении абдоминальной боли // Фарматека. 2005. № 14.
- Вилей Дж. Оценка и значение боли в животе. Глава 1. В кн.: Дж. Хендерсон. Патофизиология органов пищеварения. СПб: Невский диалект, 1997. 275 с.
- Ливзан М. А. Болевой синдром в гастроэнтерологии — алгоритм терапии // Медицинский совет. 2010. № 3–4. С. 68–70.
- Шульпекова Ю. В., Ивашкин В. Т. Симптом висцеральной боли при патологии органов пищеварения // Врач. 2008. № 9. С. 12–16.
- Brandt L. J., Chey W. D., Foxx-Orenstein A. E., Schiller L. R., Schoenfeld P. S., Spiegel B. M., Talley N. J., Quigley E. M. American College of Gastroenterology Task Force on Irritable Bowel Syndrome An evidence-based position statement on the management of irritable bowel syndrome // Am J Gastroenterol. 2009, Jan; 104, Suppl 1: S1–35.
- Camilleri M. Review article: new receptor targets for medical therapy in irritable bowel syndrome // Aliment Pharmacol Ther. 2010, Jan; 31 (1): 35–46.
- Camilleri M. Evolving concepts of the pathogenesis of irritable bowel syndrome: to treat the brain or the gut // J Pediatr Gastroenterol Nutr. 2009, Apr; 48, Suppl 2: S46–48.
- Drossman D. A. Severe and refractory chronic abdominal pain // Clin Gastroenterol Hepatol. 2008, vol. 6, № 9, pp. 978– 982.
- Grunkemeier D. M. S., Cassara J. E., Dalton C. B., Drossman D. A. The narcotic bowel syndrome: clinical features, pathophysiology and management // Clin Gastroenterol Hepatol. 2007; № 5; 1126–1139.
- Khalif I. L., Quigley E. M., Makarchuk P. A., Golovenko O. V., Podmarenkova L. F., Dzhanayev Y. A. Interactions between symptoms and motor and visceral sensory responses ofirritable bowel syndrome patients to spasmolytics (antispasmodics) // J Gastrointestin Liver Dis. 2009, Mar; 18 (1): 17–22.
- Lee J. M., Cheon J. H., Park J. J., Moon C. M., Kim E. S., Kim T. I., Kim W. H. Effects of Hyosine N-butyl bromide on the detection of polyps during colonoscopy // Hepatogastroenterology. 2010, Jan-Feb; 57 (97): 90–94.
- Longstreth G., Thompson W., Chey W., Houghton L., Mearin F., Robin C. Spiller. Functional Bowel Disorders // Gastroenterology. 2006; 130: 1480–1491.
- Mertz H. How effective are oral hyoscine butylbromide and paracetamol for the relief of crampy abdominal pain // Nat Clin Pract Gastroenterol Hepatol. 2007, Jan; 4 (1): 10–11.
- Mueller-Lissner S., Tytgat G. N., Paulo L. G., Quigley E. M., Bubeck J., Peil H., Schaefer E. Placebo- and paracetamol-controlled study on the efficacy and tolerability of hyoscine butylbromide in the treatment of patients with recurrent crampy abdominal pain // Aliment Pharmacol Ther. 2006, Jun 15; 23 (12): 1741–1748.
- Misra S. P., Dwivedi M. Role of intravenously administered hyoscine butyl bromide in retrograde terminal ileoscopy: a randomized, double-blinded, placebo-controlled trial // World J Gastroenterol. 2007, Mar 28;13 (12): 1820–1823.
- Poynard T., Regimbeau C., Benhamou Y. Meta-analysis of smooth muscle relaxants in the treatment of irritable bowel syndrome // Aliment Pharmacol Ther. 2001; 15: 355–361.
- Spiegel B., Bolus R., Harris L. A., Lucak S., Naliboff B., Esrailian E., Chey W. D., Lembo A., Karsan H., Tillisch K., Talley J., Mayer E., Chang L. Measuring irritable bowel syndrome patient-reported outcomes with an abdominal pain numeric rating scale // Aliment Pharmacol Ther. 2009, Dec 1; 30 (11–12): 1159–1170.
- Tytgat G. N. Hyoscine butylbromide: a review of its use in the treatment of abdominal cramping and pain // Drugs. 2007; 67 (9): 1343–1357.
- Tytgat G. N. Hyoscine butylbromide — a review on its parenteral use in acute abdominal spasm and as an aid in abdominal diagnostic and therapeutic procedures // Curr Med Res Opin. 2008.
- WGO Practice guideline — Irritable bowel syndrome: a global perspective.April 2009.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru