Содержание статьи
Введение
В последние десятилетия большое внимание уделяется распространенной наднозологической патологии почек, которая обозначается как хроническая болезнь почек (ХБП) и является значимым фактором, влияющим на продолжительность жизни населения, повышение экономических затрат на коррекцию ее последствий и поддержание жизнедеятельности с применением заместительной почечной терапии [1].
Среди пусковых причин и факторов риска формирования и прогрессирования последствий ХБП рассматриваются традиционные полиэтиологические и мультифакторные заболевания (артериальная гипертензия (АГ), системное атеросклеротическое поражение сосудов, нарушение углеводного обмена и клинически явный сахарный диабет (СД), ожирение, гиперурикемия, прием отдельных лекарственных препаратов и полипрагмазия). Отмечают также синергические эффекты перечисленных факторов в случае их сочетанного присутствия у одного пациента [2–4].
Особое внимание в указанном аспекте привлекает наличие болевых синдромов в различных отделах опорно-двигательного аппарата, особенно при развитии остеоартрита (ОА) коленных суставов. ОА, часто выявляемый у пациентов зрелого и пожилого возраста, осложняет течение метаболических и сосудистых возраст-ассоциированных заболеваний.
С одной стороны, нарушение функции суставов (в частности, коленных) создает условия для гиподинамии — фактора риска развития сердечно-сосудистых заболеваний, СД, остеопороза и т. д. [5]. С другой стороны, высокая частота развития боли при активных и пассивных движениях у этих больных обусловливает необходимость дополнительного применения анальгетических препаратов с доказанным отрицательным влиянием на функцию почек, которая у данной когорты больных уже скомпрометирована имеющимися заболеваниями. Причем сам факт наличия болевых ощущений через систему различных медиаторов отрицательно влияет на восприятие боли и регуляцию метаболических и сосудистых взаимоотношений [6]. В данных условиях нарушение функции почек может рассматриваться с позиции органа-мишени (повреждаемого коморбидными заболеваниями), а также, несомненно, как значимый самостоятельный фактор прогрессирования всех сопутствующих заболеваний [7].
В связи с этим многочисленные клинические и экспериментальные исследования посвящены поиску информативных маркеров раннего повреждения почек, которые могли бы сигнализировать о необходимости нефропротективного воздействия [8]. Однако известные к настоящему времени показатели не могут рассматриваться как идеальные не только с позиции их информативности, но и в аспекте финансовой затратности [9, 10]. По этой причине внимание привлекает использование в клинической практике рутинных методов контроля функции почек и поиск наиболее безопасных методик устранения боли при ОА. Одним из доступных показателей контроля функции почек может быть расчетная скорость клубочковой фильтрации (рСКФ) с использованием медицинского калькулятора [11]. Так, было показано, что у пациентов, нуждающихся в оперативном лечении ОА, снижение рСКФ до 30–45 мл/мин/1,73 м2 обусловливает увеличение (в 3,2 раза) продолжительности госпитализации, потребности в переливании кровезаменителей, повышение смертности от различных причин в первые 30 дней после оперативных вмешательств на суставах [12–15].
В медицинской литературе и регламентирующих документах по оценке качества оказания медицинской помощи указывается на многочисленные ограничения применения нестероидных противовоспалительных препаратов (НПВП) у пациентов высокого и очень высокого риска развития сердечно-сосудистых и желудочно-кишечных осложнений [16], значительно меньше внимания уделяется обязательности контроля за направленностью изменения функции почек в начале и в динамике терапии дегенеративных процессов в суставах и позвоночнике с болевыми проявлениями. Вследствие произошедших в последнее время изменений парадигмы патогенеза ОА с доказательством роли постоянного низкоэнергетического воспаления в хрящевой и окружающих сустав тканях применение НПВП получило патогенетическое обоснование [17], при этом возникла необходимость изучения безопасности их использования. Так, клиническое наблюдение более чем за 1798 пациентами старше 65 лет [18] показало, что даже при снижении рСКФ ниже 60 мл/мин/1,73 м2 респонденты часто использовали группу НПВП без врачебных назначений. Исследование группы фармакологического контроля Индии у пациентов в возрасте 40–80 лет также установило высокую частоту формирования ХБП на фоне применения различных НПВП для устранения болей в суставах и позвоночнике [19]. В то же время имеются данные о возможном улучшении функции почек при введении строгого контроля за показателем рСКФ и ограничении приема НПВП [20]. Еще более настораживающие ситуации связаны с оценкой безопасности комбинации НПВП с ингибиторами ренина и мочегонными препаратами, совместное применение последних считается наиболее эффективным в лечении АГ, сердечной недостаточности и других состояний. Оказалось, что дополнение проверенной двойной комбинации НПВП вызвало достоверное снижение функции почек по оценке рСКФ [21].
Вышеизложенные факты обосновывают поиск путей коррекции болевых синдромов на фоне дегенеративных заболеваний суставов, обеспечивающих уменьшение активности воспалительных реакций с сохранением или улучшением функции почек при условии кардиологической и гастроэнтерологической безопасности. В качестве возможных кандидатов среди лекарственных препаратов с заявленными свойствами рассматриваются хондропротекторы (SYSADOA), обладающие доказанными противовоспалительными и дополнительными плейотропными эффектами [22–24].
Цель исследования: проанализировать особенности изменения фильтрационной функции почек у пациентов с болевым синдромом на фоне ОА коленных суставов с применением терапевтических и хирургических методов устранения боли.
Материал и методы
В исследование включено 193 пациента с ОА коленных суставов II–IV стадии по Kellgen — Lawrence (II–III стадия у пациентов 4-й группы и III–IV стадия у больных 1–3-й групп) в возрасте 61,23±6,64 года с клинически значимым (6 и более см по ВАШ боли) болевым синдромом. Более 90% этих больных в качестве коморбидной патологии имели АГ и получали традиционную антигипертензивную терапию (АГТ), которая не изменялась в течение 3 мес. до включения в исследование и на протяжении всего периода наблюдения. Учитывая наличие АГ практически у всех пациентов, включенных в исследование, в качестве сравнения использовали группу из 23 больных с подтвержденной АГ II стадии, получающих рекомендуемую кардиологом АГТ традиционными препаратами (преимущественно ингибиторами АПФ в сочетании с тиазидоподобными диуретиками) с достигнутым целевым уровнем артериального давления (АД), без клинически значимой патологии суставов (отсутствие жалоб и нарушения функции).
Все пациенты обследованы с оценкой состояния опорно-двигательного аппарата, сердечно-сосудистой системы и почек в условиях ортопедо-травматологического отделения ГБУЗ «НИИ — ККБ № 1», находились под динамическим наблюдением терапевта отделения. Исследование проведено в соответствии с принципами Хельсинкской декларации, все пациенты подтвердили добровольное согласие на участие в исследовании.
В исследование не включали пациентов с урологической патологией, злокачественными заболеваниями, хронической сердечной недостаточностью более 2А стадии, аномалиями развития костной системы, другими заболеваниями суставов, признаками диспластических нарушений соединительной ткани, системными ревматологическими заболеваниями и хроническими заболеваниями внутренних органов в стадии обострения.
Всем пациентам проводили общепринятые [26] клинические и лабораторные исследования, уточняли коморбидные состояния, но акцент в настоящем исследовании был сделан на динамических изменениях фильтрационной функции почек. Оценивали уровень креатинина крови и рСКФ в начале и в конце исследования. Динамику рСКФ оценивали с пересчетом на 1 мес.
Исследование состояло из ретроспективной и проспективной частей. В 1-ю группу были включены 64 человека, перенесших тотальное эндопротезирование (ТЭП) обоих коленных суставов. Оценивали уровень креатинина с расчетом СКФ перед первой (ретроспективно по медицинским документам) и второй операцией на контралатеральном суставе. Это были пациенты, у которых после первой операции значительно (с 6,2±0,6 до 2,3±0,5 см по ВАШ) уменьшилась боль в прооперированном суставе, но сохранялись боли при активных движениях в другом коленном суставе, что требовало эпизодического применения НПВП. Они нерегулярно принимали разные препараты или пищевые добавки хондропротективного ряда, но вынуждены были обратиться к ортопедам для операции на другом коленном суставе. Во 2-ю группу включили 26 пациентов, перенесших второе или единственное ТЭП, у которых оценивали рСКФ перед операцией и проспективно через 2–3 года. Особенностью отбора пациентов во 2-ю группу был факт хорошего анальгетического эффекта (в среднем уровень боли в обоих коленных суставах не превышал 3,2±07 см по ВАШ) после двух или одной операции, что исключало необходимость приема препаратов для лечения суставной патологии. Третью группу составили 48 пациентов, перенесших артроскопическое вмешательство по поводу гонартроза (малые оперативные вмешательства), следствием которого было снижение уровня болевых ощущений в среднем на 2,6±0,9 см по ВАШ. Опрос показал, что пациенты 3-й группы эпизодически принимали НПВП на фоне больших нагрузок, но использовали ортезы в послеоперационном периоде. Проспективно перед операцией и через 1,5–2,5 года динамического послеоперационного наблюдения повторно оценивали рСКФ. В 4-ю группу включено 55 пациентов со II–III стадией гонартроза и значимым (6,1±0,8 см по ВАШ) болевым синдромом, которые длительное время получали консервативное лечение. Подгруппа 4А (n=34) для купирования болевого синдрома принимала НПВП в режиме курсового приема, чередующегося с неконтролируемым режимом «по требованию», отказываясь от систематического лечения базисными препаратами. Динамика рСКФ оценивалась ретроспективно (по документам) и проспективно суммарно в течение не менее 1,5–2,5 года. Подгруппа 4Б (n=21) включала пациентов, которые после длительного периода бессистемного применения НПВП (оценить длительность и дозы препаратов не представлялось возможным) проспективно с высоким уровнем комплаентности получали курсовое (не менее 3 курсов) лечение хондроитина сульфатом (ХС) (Артогистан, ООО «Гротекс», Россия) в соответствии с инструкцией по медицинскому применению препарата [25]. Эта подгруппа также наблюдалась от 1,5 до 2,5 года. Значения рСКФ оценивали перед началом наблюдения и через 1,5–2,5 года. Пациенты всех групп были сопоставимы по возрасту, полу и коморбидному статусу. С учетом разных периодов времени между лабораторными исследованиями уровня креатинина в реальной клинической практике мы определяли среднемесячное изменение рСКФ, что позволило унифицировать исследуемый показатель при анализе его изменений во всех группах обследованных.
Статистическая обработка полученных результатов выполнена на персональном компьютере HP после создания электронных баз данных с использованием программы Microsoft Office Excel 2019 посредством программ Statistica 10.0 (Statsoft Inc., США) и Attestat. При оценке количественных параметров использовали описательную статистику с определением среднего арифметического, стандартного отклонения, медианы. Качественные показатели представлены в виде абсолютных и относительных (%) значений. Для правильного определения использования статистических критериев для начала оценивали распределение изученных параметров в статистических выборках. Нормальность распределения оценивали с помощью критерия Колмогорова — Смирнова. В выборках с нормальным распределением для определения статистической значимости различий использовали критерий Стьюдента с поправкой Бонферрони. Для оценки различий между процентными долями двух выборок использовали метод углового преобразования Фишера с расчетом φ.
Результаты исследования
Результаты длительного (1,5–2,5 года) наблюдения за пациентами с выраженным болевым синдромом представлены в таблице. Пациенты из группы сравнения наблюдались около двух лет, постоянно получая АГТ, в среднем по группе поддерживалась нормотония (практически все пациенты поддерживали целевые значения АД). В этой группе определено среднемесячное снижение рСКФ на 0,23±0,83 мл/мин/1,73 м2, при этом у 60,9% больных отмечено снижение рСКФ, а в 39,1% наблюдений констатировали сохранение или увеличение среднемесячного показателя рСКФ. Такие результаты можно объяснить естественным течением сосудистой патологии или недостаточной комплаентностью пациентов, а возможно, наличием других факторов, которые не учитывались в связи с дизайном данного исследования.
В 1-й группе больных гонартрозом, функция почек у которых оценивалась до проведения первой операции ТЭП и перед вторым вмешательством на другом суставе, продемонстрировано увеличение рСКФ в среднем на 0,245±0,2 мл/мин/1,73 м2 в месяц, причем доля пациентов с нулевым или положительным приростом рСКФ достигала 61%, а уменьшение месячных значений рСКФ выявлено у 39% больных. Во 2-й группе, пациенты которой отмечали полный регресс болей после единственной операции на коленном суставе или после дополнительного вмешательства на противоположном суставе с устранением боли, продемонстрирован наибольший прирост среднемесячного значения рСКФ, который составил 0,558±0,58 мл/мин/1,73 м2. Причем доля больных, у которых сохранялись исходные значения СКФ или фиксировался ее прирост, составила 88%, а снижение рСКФ определено только в 11,54% случаев. Согласно дополнительному опросу эти пациенты в большинстве случаев отказывались от применения НПВП или других анальгетиков, а 15,38% из них в послеоперационном периоде принимали хондропротекторы.
Для подтверждения гипотезы о положительном влиянии снижения потребности в анальгетических средствах на функцию почек была оценена динамика рСКФ у пациентов с ОА, перенесших артроскопическое вмешательство (3-я группа). В целом по группе ежемесячный прирост значений рСКФ составил 0,32 мл/мин/1,73 м2, при этом стабильные значения или нарастание рСКФ отмечались у 79,2% пациентов и только в 20,8% наблюдений при длительном (от 1,5 до 3 лет) наблюдении выявлено снижение рСКФ. Таким образом, даже временное снижение потребности в НПВП, которое наблюдается, например, при проведении артроскопических вмешательств у большого числа больных ОА, позволяет частично или полностью восстановить функцию почек. Другими словами, у ряда пациентов, страдающих клинически значимым ОА с выраженным болевым синдромом, возможно частичное или полное восстановление нарушений рСКФ на фоне уменьшения болевых проявлений посредством различных методов — от артроскопических вмешательств до ТЭП (см. таблицу).
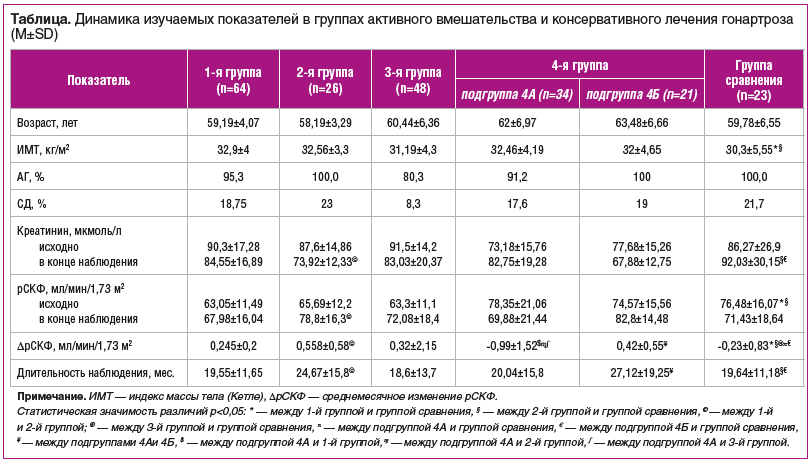
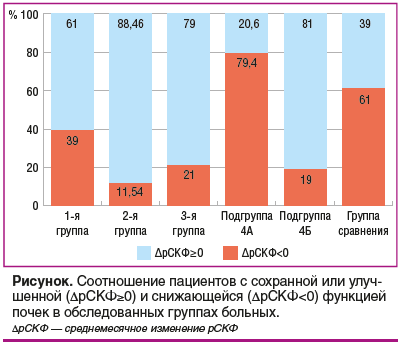
Более интересные данные мы получили при анализе эффективности консервативного лечения ОА у пациентов с ОА II–III стадии, имеющих выраженные боли (≥ 6 см по ВАШ) в коленных суставах, ограничивающие объем движений и длительность передвижения. Этих пациентов мы включили в 4-ю группу, в которой все больные нуждались в терапии болевого синдрома, но в подгруппе 4А основным методом терапии был прием НПВП в связи с отказом пациентов от применения хондропротективных препаратов (см. таблицу), а в подгруппе 4Б пациенты проходили курсовое лечение инъекционной формой ХС (в среднем 3 курса). Оценка особенностей изменения рСКФ в указанных подгруппах показала, что длительное применение НПВП сопровождается преимущественно снижением рСКФ в среднем на 0,99±1,52 мл/мин/1,73 м2 в месяц с нарастанием уровня креатинина в среднем на 13%, хотя его лабораторные значения оставались в референсном диапазоне. При этом у 79,4% больных подгруппы 4А выявлялось снижение среднемесячных показателей рСКФ, а отсутствие изменений или положительная динамика зафиксирована только у 20,6% больных, в то время как в группе сравнения у больных с АГ без суставной патологии на фоне АГТ эта цифра оказалась выше — 39,1%. В подгруппе 4Б за время наблюдения продемонстрировано снижение уровня креатинина в среднем на 13,01% с суммарным среднемесячным приростом рСКФ на 0,42±0,55 мл/мин/1,73 м2. В группе терапии ХС снижение рСКФ за время наблюдения определялось только в 19% случаев, тогда как отсутствие падения рСКФ или ее среднемесячный прирост выявлен у 81% больных. Полученные положительные сдвиги в подгруппе 4Б были более выраженными, чем у пациентов с малоинвазивными вмешательствами, устраняющими болевые ощущения и потребность в применении НПВП, и чем у пациентов с АГ без суставной патологии (см. рисунок). Таким образом, положительные эффекты у пациентов группы 4Б нельзя связать с влиянием антигипертензивных средств или фактом снижения только выраженности самой боли. Можно предположить наличие плейотропных эффектов Артогистана.
Обсуждение
В нашем наблюдении в качестве хондропротективного препарата выбрана инъекционная форма ХС (Артогистан) в связи с наличием в официальной инструкции показания для терапии ОА [25].
У пациентов с дегенеративными заболеваниями опорно-двигательного аппарата основной причиной обращения к врачам и согласия на лечение является наличие болевого синдрома, поэтому прежде всего они принимают препараты анальгетического ряда из группы НПВП. Хорошо известны ограничения в назначении этих средств в отношении сопутствующих кардиологических и гастроэнтерологических заболеваний, но в последнее время привлекает внимание и возможное нарушение функции почек. Выявленное нами в подгруппе 4А снижение рСКФ у большинства пациентов независимо от терапии сопутствующих заболеваний является одним из доказательств высказанных ранее опасений о влиянии продолжительного приема НПВП на функцию почек. В клинических рекомендациях по лечению дегенеративных заболеваний суставов (гонартроз) обращено внимание на рациональность раннего использования препаратов хондропротективного действия (ХС), среди которых инъекционные формы привлекают особое внимание вследствие большей биодоступности и более быстрого достижения обезболивающего эффекта [26], что может снизить потребность в использовании НПВП (как возможной причины снижения функции почек).
Однако в последнее время доступны несколько инъекционных форм ХС, что заставляет обращать внимание на состав самого ХС и вспомогательных компонентов, поэтому эксперты ESCEO настоятельно рекомендуют использовать препараты ХС рецептурного качества (не БАД), ссылаясь на доказанную высокую биодоступность и их клиническую эффективность [17]. К указанной группе может быть отнесен Артогистан, преимуществом которого является отсутствие бензилового спирта. Метаболизм этого консерванта связан с почечным путем выведения, что может оказывать дополнительное отрицательное влияние на функцию почек в сочетании с НПВП [27, 28]. Большое внимание в оценке положительных эффектов ХС уделяют также качеству субстанции, из которой воспроизведена каждая отдельно рассматриваемая форма препарата. Показано, что качество субстанции влияет на терапевтический эффект в связи с возможным наличием определенных примесей [29]. Поэтому эксперты рекомендуют использовать только ХС фармацевтического качества [30]. Малоучитываемым стандартом используемых в настоящее время хондроитинов является соотношение Х4С и Х6С. Считается, что в здоровом молодом гиалиновом хряще 70% составляет Х4С, а Х6С примерно 30%, такое соотношение позволяет поддерживать гидрофильность хряща и его амортизационные свойства [31–34]. В производстве препарата Артогистан используется сырье, поставляемое международной медико-биологической компанией Bioiberica, которое отличается высокой степенью очистки и оптимальным соотношением Х4С и Х6С [35]. В основе сырьевой биомассы — экстракт ХС из трахеи быка с узким диапазоном молекулярной массы (14–26 кДа), что существенно повышает качество стандартизации получаемой фармацевтической субстанции ХС. Немаловажным аспектом является и фармакоэкономическая составляющая лечения и приверженность лечению, особенно при необходимости проведения продолжительных (25–35 инъекций) курсов, что применительно к Артогистану обеспечивается формой выпуска препарата (по 2 мл № 20).
В нашем исследовании установлено, что среди пациентов с болевой формой ОА, в лечении которых преобладают НПВП, отмечается наибольшее количество лиц, у которых постепенно снижается фильтрационная функция почек, тогда как у пациентов, использующих ХС, в подавляющем большинстве случаев указанная функция сохраняется или даже улучшается (восстанавливается). С этой точки зрения интересны работы, подтверждающие наличие у ХС противовоспалительной активности при ОА, сопоставимой с таковой целекоксиба [36], что позволяет при длительном применении ХС полностью заменить или значительно снизить потребность в применении НПВП. Противовоспалительный эффект ХС обеспечивается их способностью снижать активацию NF-кВ, предотвращать продукцию таких провоспалительных биомаркеров, как интерлейкины 1 и 6, С-реактивный белок [37, 38].
Особое внимание привлекает способность ХС снижать потребность в применении НПВП в связи с высокой распространенностью коморбидных состояний у пациентов с ОА [39–42]. Именно в этой группе пациентов, характеризующихся высокой распространенностью ИБС, АГ, ожирения и СД, очень значима проблема профилактики нарушения фильтрационной функции почек. Осознавая небольшой объем представляемого нами наблюдения, мы хотим привлечь внимание врачей практического звена к проблеме необходимости динамического контроля за функцией почек, особенно у пациентов с болями в суставах на фоне дегенеративных повреждений. Такой контроль с помощью простого метода расчета СКФ, не требующего дополнительных экономических затрат, позволяет выявлять лиц, нуждающихся в использовании методик коррекции болей без применения НПВП. В этом аспекте могут быть полезными препараты на основе ХС и/или малоинвазивные хирургические вмешательства.
Заключение
Выполненное нами наблюдение позволяет обратить внимание на возможность ранней диагностики нарушений фильтрационной функции почек у пациентов с дегенеративными поражениями опорно-двигательного аппарата посредством анализа месячной динамики значений рСКФ. Контроль этого показателя позволяет определить когорту пациентов с ОА коленных суставов, для которых замена анальгетической терапии на использование препарата ХС или даже малоинвазивных ортопедических вмешательств может быть предпочтительной в аспекте сохранения или восстановления функции почек. Несомненно, требуется продолжение исследований с определением оптимальных сроков наблюдения, скорости и степени снижения показателей фильтрационной функции почек для оценки возможности их коррекции. Однако уже сейчас понятно, что применение инъекционной формы ХС может быть полезным в сохранении функциональной активности почек. При этом при выборе инъекционного ХС нужно обращать внимание на состав (субстанция, характер и количество консервантов), наличие форм выпуска препарата, обеспечивающих соблюдение прописанного в инструкции способа применения. Препаратом, отвечающим указанным требованиям, можно считать Артогистан.
Информация с rmj.ru
