Содержание статьи
Введение
Хронический простатит (ХП) является одним из самых дискутабельных вопросов в урологии на протяжении последних десятилетий, что во многом объясняет научный интерес среди специалистов и большое количество исследований, направленных на понимание этиологии, распространенности, диагностики и лечения данного заболевания. Впервые в 1800 г. Benfield определил простатит как нозологическую единицу, а в 1815 г. Legngue опубликовал свои наблюдения за воспалительным процессом в предстательной железе (ПЖ) [1]. Однако до сих пор у специалистов нет четкого понимания механизмов развития данного заболевания.
В 2002 г. профессор О.Б. Лоран дал следующее определение ХП: «Хронический простатит — заболевание инфекционного генеза с возможным присоединением аутоиммунных нарушений, характеризуется поражением как паренхиматозной, так и интерстициальной ткани предстательной железы» [2]. В современной урологии под ХП понимают присутствие боли в области малого таза и/или промежности, органах мочеполовой системы в течение по крайней мере 3 мес., а также наличие (отсутствие) обструктивной или ирритативной симптоматики мочеиспускания, положительный (отрицательный) результат бактериологического исследования. ХП рассматривается как мультифакторное полиэтиологичное заболевание ПЖ [3].
Данные мировой литературы свидетельствуют о не-уклонном росте распространенности заболевания в мужской популяции. Так, по результатам статистического анализа Национального института здоровья США (National Institutes of Health (NIH)), по количеству обращений к урологу ХП занимает 5-е место в списке основных диагнозов. Среди специалистов общепринятой является классификация простатита, предложенная в 1995 г. Американским национальным институтом здоровья США и Национальным институтом диабета, пищеварения и болезни почек (NIDDK), согласно которой выделяют острый бактериальный простатит (категория I), хронический бактериальный простатит (ХБП) (категория II), ХП / синдром хронической тазовой боли (категория III), который может быть воспалительным (категория III A) или невоспалительным (категория B), асимптоматическое воспаление ПЖ (категория IV) [4].
Установлено, что около 35% мужчин в мире в возрасте 20–40 лет страдают ХП. На долю ХБП приходится примерно 10% от общей заболеваемости ХП, и в 90% случаев фигурирует диагноз ХАП [5, 6]. При этом многие специалисты объясняют выраженное преобладание ХАП в структуре ХП трудностями лабораторной диагностики, а также трансформацией микроорганизмов в L-формы на фоне курсов антибактериальной терапии, что обусловливает отсутствие их роста на стандартных средах. Однако за статистическими показателями стоят люди, испытывающие серьезный физический и душевный дискомфорт, который выступает триггером психологических проблем, а также оказывает негативное влияние на межличностные взаимоотношения в социуме. Доказано, что у 95% мужчин с ХП в течение 3 лет развивается депрессивное расстройство [7].
За последние годы установлено, что воспалительный процесс является одним из звеньев патогенеза гиперплазии ПЖ, чем объясняется частая встречаемость ХП у мужчин пожилого возраста на фоне доброкачественной гиперплазии ПЖ (ДГПЖ) [8]. Воспаление сопровождается высвобождением цитокинов тканью органа, что приводит к состоянию относительной гипоксии, возникающей в результате увеличения потребности пролиферирующих клеток в кислороде, что в свою очередь оказывает повреждающее воздействие на ткань. Ее последующее восстановление может приводить к развитию узлов аденомы простаты и пролиферативной воспалительной атрофии [9].
Помимо этого, в многочисленных работах по изучению влияния ХБА и ХАП на репродуктивную функцию мужчин установлено, что воспалительный процесс приводит к снижению объема семенной жидкости, уменьшению числа прогрессивно-подвижных форм сперматозоидов, увеличению количества антиспермальных антител [10–12]. Все это подтверждает необходимость детального изучения данной патологии и разработки современных алгоритмов диагностики и лечения.
Как уже было сказано, патогенез хронического воспаления ПЖ окончательно не изучен, и относительно этого в настоящее время существуют различные теории. Немаловажную роль в развитии как бактериального, так и абактериального простатита играет рефлюкс мочи в ответ на повышенное внутрипузырное давление. Попадание мочи в выводные протоки ПЖ во время мочеиспускания при недостаточном расслаблении шейки мочевого пузыря вызывает турбулентность тока мочи в уретре, что и приводит к рефлюксу мочи в выводные протоки ПЖ и развитию асептического воспаления [13]. В случае, когда в моче присутствуют бактерии, происходит диссеминация микроорганизмов в ПЖ. Помимо этого, нарушение микроциркуляции в ПЖ вследствие венозного застоя в органах малого таза, а также застой секрета ПЖ в ацинусах при малоподвижном образе жизни и нерегулярных половых актах способствуют присоединению условно-патогенной микрофлоры и развитию бактериального простатита [14]. В большинстве случаев возбудителями ХБП являются грамотрицательные микроорганизмы: Escherichia coli, Klebsiella spp., Enterococcus faecalis, Staphylococcus, Streptococcus и др. Труднее диагностируются такие возбудители, как Chlamydia trachomatis, Ureaplasma urealyticum и Mycobacterium tuberculosis. Развитие простатита может быть обусловлено и наличием вируса — цитомегаловируса, вируса простого герпеса, вируса папилломы человека [15–17].
В случае ХАП в качестве эмпирической терапии преимущественно используются фторхинолоны с длительностью приема от 2 до 4 нед. При этом многие специалисты не разделяют подхода к назначению длительной антибактериальной терапии ввиду роста резистентности микроорганизмов, несущей глобальную угрозу человечеству [18, 19].
Широкое применение в симптоматической терапии ХП нашли α-адреноблокаторы (α-АБ). Зарубежные и отечественные исследования доказали, что использование α-АБ у пациентов с расстройством мочеиспускания на фоне ХП эффективно в купировании нежелательных симптомов у мужчин, так как блокирование адренорецепторов ПЖ, шейки мочевого пузыря и задней уретры восстанавливает координированную работу детрузора и способствует снижению рефлюкса в выводные протоки ПЖ [20]. Для купирования болевого синдрома при простатите широко используются нестероидные противовоспалительные средства (НПВС), оказывающие анальгезирующее и противовоспалительное действие. НПВС являются неселективными ингибиторами ферментов ЦОГ-1 и ЦОГ-2, что обусловливает периферический обезболивающий эффект [21].
При ХП патогенетически обосновано назначение препаратов на основе регуляторных пептидов с целью нормализации секреторной функции эпителиальных клеток, улучшения кровообращения в ПЖ (за счет антиагрегантной активности), а также уменьшения отека и лейкоцитарной инфильтрации [22]. Так как при ХП снижается экскреторная функция ПЖ, включая снижение секреции лимонной кислоты, α-глюкозидазы, фруктозы и цинка, которые играют важную роль в активности ферментов ПЖ и подвижности сперматозоидов, то обоснованным является комплексное лечение, включающее не только вышеперечисленные группы лекарственных препаратов, но и применение минерально-растительных средств [23].
Цель исследования: оценить эффективность минерально-растительного комплекса Ротапрост в комплексной терапии ХБП и ХАП.
Материал и методы
В настоящее проспективное клиническое исследование включено 60 мужчин в возрасте от 20 до 55 лет (средний возраст 38,2 года) с верифицированным диагнозом ХБП, вызванного E. сoli, и патозооспермией (группа I), а также 72 мужчины в возрасте от 20 до 55 лет (средний возраст 41,5 года) с диагнозом «ХАП / синдром хронической тазовой боли» и патозооспермией (группа II). Диагноз у всех пациентов установлен впервые. Все больные проходили обследование и получали лечение амбулаторно в клинико-диагностическом центре ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России.
Критерии включения в исследование: возраст ≥20 лет, наличие жалоб на расстройства мочеиспускания, уровень ПСА в сыворотке крови не более 4,0 нг/мл (средний уровень 2,1 нг/мл), объем ПЖ по данным трансректального УЗИ (ТРУЗИ) не более 60 см3, максимальная объемная скорость мочеиспускания (Qmax) более 6 мл/с при объеме мочеиспускания не менее 120 мл, объем остаточной мочи по данным УЗИ мочевого пузыря не более 50 мл. Информированное согласие было подписано всеми участниками исследования. Было получено одобрение локального этического комитета на проведение исследования.
Критерии невключения: нейрогенный характер нарушения мочеиспускания, установленный диагноз опухоли мочевыводящей системы, подозрение на наличие рака ПЖ, обострение инфекций мочевыводящих путей, сопутствующие заболевания, делающие невозможными визиты для оценки состояния.
На первом визите нами был проведен сбор жалоб и анамнеза, а также физикальный осмотр пациентов с целью выявления патологий органов мочевыделительной системы. Все мужчины заполнили опросники NIH-CPSI, I-PSS, QoL и МИЭФ-5. Выполнен клинический минимум: общий анализ крови, биохимический анализ крови, общий анализ мочи. Дополнительно определяли концентрацию ПСА в сыворотке крови. Помимо этого, проводили оценку параметров эякулята (спермограмма), оценку оксидативного стресса сперматозоидов (ROS-тест) и MAR-тест с целью выявления антиспермальных антител. Инструментальная диагностика включала ТРУЗИ ПЖ (исследование проводилось на аппарате Siemens ACUSON S2000) и мочевого пузыря с определением уровня остаточной мочи, урофлоуметрию, а также исследование органов мошонки для исключения органической патологии.
Далее, используя автоматизированный генератор случайных чисел, пациенты группы I были разделены на 2 подгруппы: в подгруппе IА (n=30, средний возраст 38,5±1,5 года) пациенты получали антимикробную терапию ципрофлоксацином по 500 мг 2 р/сут и минерально-растительный комплекс Ротапрост по 1 капсуле 2 р/сут на протяжении 4 нед.; пациентам подгруппы IB (n=30, средний возраст 34,3±1,4 года) была назначена монотерапия ципрофлоксацином в течение 4 нед. Пациенты группы II также случайным образом были разделены на 2 подгруппы: в подгруппе IIA (n=36, средний возраст 39,1±0,7 года) в течение 4 нед. применяли регуляторные пептиды в виде ректальных суппозиториев (50 мг) на ночь совместно с минерально-растительным комплексом Ротапрост; в подгруппе IIB (n=36, средний возраст 36,2±1,8 года) были назначены только ректальные суппозитории регуляторных пептидов сроком на 4 нед.
Контрольное обследование пациентов проводили через 4 нед. после начала лечения. Все полученные данные вносились в специальную исследовательскую карту.
Расчет и статистический анализ результатов исследования проводили при помощи программы Statistica 10.0. Количественные переменные описывали следующими статистическими показателями: число валидных случаев, среднее арифметическое значение (М), стандартное отклонение от среднего арифметического значения (σ). Качественные переменные описывали абсолютными и относительными частотами (процентами). Так как выборочные распределения были согласованы с нормальным, то использовали методы параметрической статистики. Для оценки динамики изменения данных, выраженных количественными показателями, использовали t-критерий Стьюдента. Различия считали статистически значимыми при уровне ошибки p<0,05.
Результаты исследования
После 4 нед. терапии по данным опросников в группах ХБП и ХАП получены следующие результаты (табл. 1).
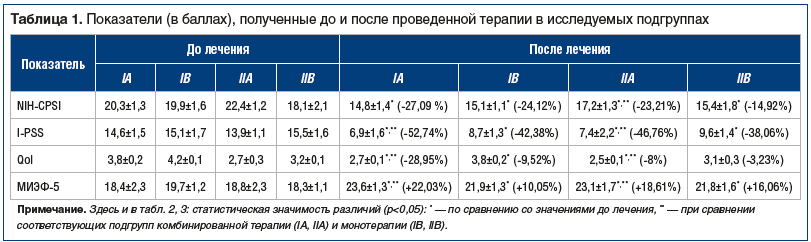
Из таблицы 1 видно, что положительная динамика по данным опросников наблюдалась во всех исследуемых группах, однако в группах комбинированной терапии в большинстве случаев отмечен более выраженный положительный эффект.
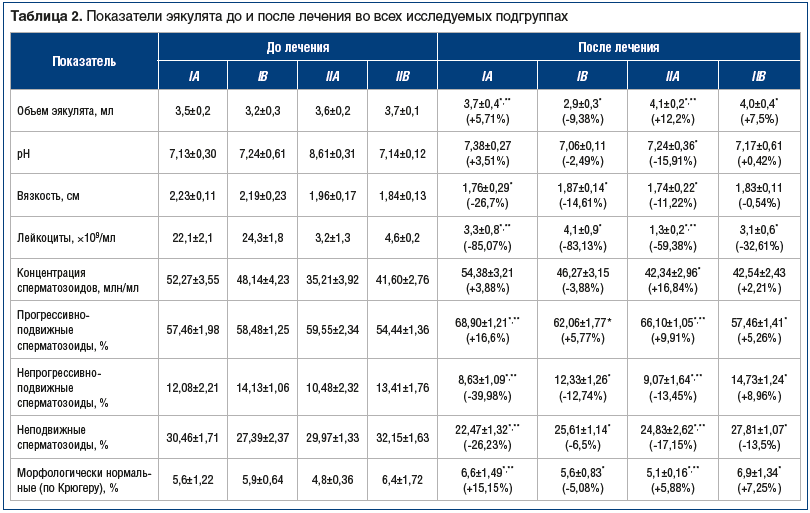
Как показали результаты анализа эякулята, во всех подгруппах лечение сопровождалось изменениями показателей, свидетельствующими об уменьшении выраженности воспаления (табл. 2). Характерно, что положительные изменения в большей степени коснулись пациентов с ХБП, а динамика в подгруппах комплексной терапии как в группе ХБП, так и в группе ХАП была более выраженной, чем в подгруппах монотерапии.
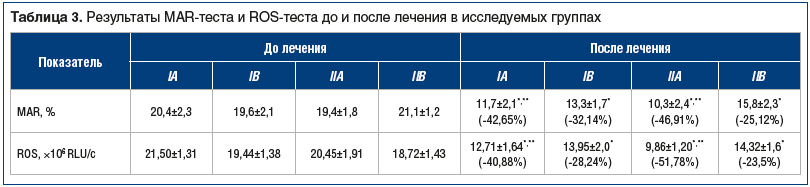
Подтверждением положительного влияния терапии на состояние ПЖ стало существенное улучшение показателей количества антиспермальных антител и оксидативного стресса сперматозоидов, которое, как и для остальных параметров, было более выраженным в подгруппах комплексной терапии (табл. 3).
Во всех группах отмечена статистически значимая (p<0,05) положительная динамика показателей урофлоуметрии. Так, в группе IA значение Qmax увеличилось с 9,2±1,2 мл/с до 15,5±1,3 мл/с, что составляет 40,65%, в группе IB — c 8,4±0,8 мл/с до 13,8±1,6 мл/с (39,13%), в группе IIA — c 8,7±0,9 мл/с до 10,3±1,1 мл/с (15,53%), в группе IIB — с 10,4±1,5 мл/с до 12,2±1,8 мл/с (14,75%).
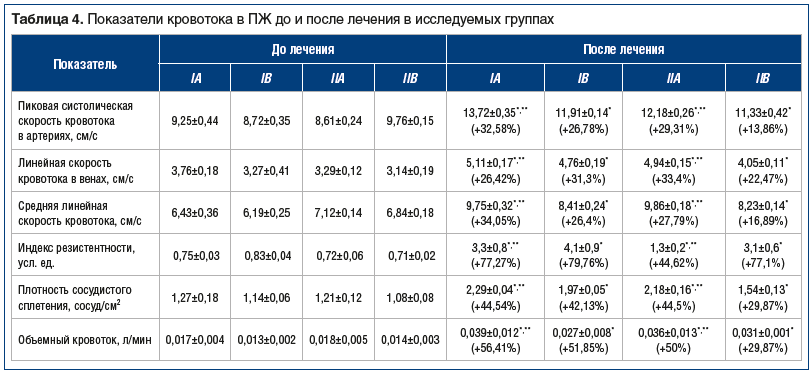
Результаты УЗИ с допплерографией свидетельствовали о более выраженном положительном влиянии комплексной терапии на показатели гемодинамики ПЖ (табл. 4).
Обсуждение
В 2017 г. R.A. Condorelli et al. [24] провели метаанализ 27 исследований влияния ХП на параметры эякулята и пришли к заключению, что ХБП ассоциируется со снижением концентрации сперматозоидов, оказывает негативное влияние на их жизнеспособность и прогрессивную подвижность [25]. При этом ХАП также был связан с уменьшением объема эякулята, снижением концентрации сперматозоидов, уменьшением числа подвижных форм. Помимо этого, у мужчин с данной патологией изменялась морфология сперматозоидов и увеличивалось число антиспермальных антител в эякуляте. Однако изменения при ХП затрагивают не только параметры эякулята. Так, в многочисленных отечественных и зарубежных работах сообщается о нарушении микроциркуляции в ПЖ на фоне ХП, что приводит к отеку органа, развитию болевого синдрома и нарушению акта мочеиспускания из-за раздражения α1-адренорецепторов шейки мочевого пузыря [20, 26]. Следовательно, лечение больных ХП должно быть комплексным и направленным на все звенья патогенеза, оно должно повышать сосудистый тонус, способствовать дренированию ацинусов, оказывать противовоспалительное действие и восполнять дефицит макроэлементов.
Полученные нами данные наглядно демонстрируют положительную динамику во всех подгруппах по валидированным опросникам, результатам оценки спермограммы, оценки оксидативного стресса сперматозоидов и выявления антиспермальных антител, а также по показателям Qmax и кровотока в ПЖ. При этом у пациентов, получавших комбинированную терапию, получены более значимые положительные результаты. По нашему мнению, добавление к стандартной терапии ХП минерально-растительного комплекса Ротапрост привело к максимальному эффекту, так как препарат обладает уникальным сочетанием элементов, необходимых для нормального функционирования ПЖ. В состав комплекса входят такие компоненты, как сухой экстракт плодов карликовой пальмы (Serenoa repens), сухой экстракт семян тыквы (Cucurbita moschata), экстракт корня крапивы (Urtica dioica), а также селен и цинк.
На сегодняшний день экстракт плодов Serenoa repens является одним из самых изученных растительных экстрактов с доказанной эффективностью, применяемых в медицине, который включен в клинические рекомендации Европейской ассоциации урологов в 2021 г. Экстракт плодов карликовой пальмы обладает комплексным механизмом действия и оказывает антиандрогенный, антипролиферативный, противовоспалительный и противоотечный эффекты за счет ингибирования ферментов арахидонового каскада в клетках, таких как фосфолипаза А2, циклооксигеназа и липооксигеназа [26, 27]. K. Zang et al. [28] опубликовали результаты двойного слепого рандомизированного плацебо-контролируемого многоцентрового клинического исследования, в котором принимали участие 226 мужчин с ХП. В группе получавших экстракт плодов Serenoa repens отмечено улучшение балльной оценки по шкале NIH-CPSI на 73,0%.
Учеными было установлено, что семена тыквы оказывают противовоспалительный, антиандрогенный эффекты и уменьшают выраженность симптомов нарушенного мочеиспускания. В работе W. Vahlensieck et al. [29] по изучению эффективности семян тыквы у мужчин с симптомами нижних мочевыводящих путей на фоне ДГПЖ сообщается о клинически значимом облегчении симптомов по шкалам I-PSS и QoL, увеличении Qmax по результатам урофлоуметрии. При этом растительные препараты на основе семян тыквы показали высокий профиль безопасности и переносимости [29, 30].
Экстракт корней крапивы доказал частичное ингибирующее действие на белок 5-липооксигеназу, который является ферментом метаболизма арахидоновой кислоты, тем самым оказывая противовоспалительное действие. M.N. Xanthopoulou et al. [31], изучая действие экстракта листьев и корней крапивы, установили, что противовоспалительный эффект растения во многом объясняется ингибированием универсального фактора транскрипции NF-κB, контролирующего экспрессию генов иммунного ответа, апоптоза и клеточного цикла.
Важно помнить, что сбалансированное течение всех физиологических процессов в ПЖ невозможно без определенного количества микроэлементов, изменение в содержании которых часто наблюдается при воспалении. Так, воспаление ПЖ влияет на накопление цинка и приводит к грубым изменениям фертильности мужчины [32]. При снижении количества цинка ДНК сперматозоидов становится уязвимой для факторов фрагментации. Помимо этого, цинк является активным ингибитором калликреинов, влияя на вязкость спермы, участвует в стабилизации хроматина сперматозоидов и необходим для поддержания антибактериальной активности семенной плазмы [33].
Селен обладает протективным действием по отношению к агрессивным свободным радикалам (О2-, Н2О2, НО*), так как является компонентом каталитического центра глутатионпероксидазы, обеспечивающей инактивацию активных форм кислорода (АФК). Дефицит селена в организме ассоциирован с риском развития мужского бесплодия, обусловленным снижением активности глутатионпероксидазы. Селен обладает выраженными защитными свойствами по отношению к сперматозоидам и влияет на их подвижность [34–36].
В 2022 г. О.Б. Жуков и соавт. [37], изучая эффективность минерально-растительного комплекса Ротапрост, пришли к заключению, что препарат позволяет скорректировать умеренную патозооспермию и показатели нарушенного мочеиспускания у больных с синдромом хронической тазовой боли IIIb и у мужчин с ДГПЖ I стадии. Это обусловлено комплексным воздействием современных многокомпонентных растительно-минеральных препаратов на основные патофизиологические клеточные механизмы возрастных изменений.
Заключение
Таким образом, терапия пациентов с ХП должна включать патогенетически обоснованные компоненты, действие которых направлено на восстановление нормальной функции ПЖ, снижение выраженности болевого синдрома. Полученные нами результаты свидетельствуют об эффективности применения минерально-растительного комплекса Ротапрост у пациентов с хроническим бактериальным и абактериальным простатитом в составе комплексного лечения, а также коррелируют с данными мировых исследований. В ходе исследования показано, что он корректирует умеренную патозооспермию, уменьшает выраженность воспаления и способствует снижению выраженности нежелательных симптомов, улучшая качество жизни мужчин с ХП.
Информация с rmj.ru
