Введение
Демографическое определение бесплодия указывает, что это неспособность сексуально активной пары без использования контрацептивов родить живого ребенка.
По данным доклада, опубликованного Всемирной организацией здравоохранения (ВОЗ), с проблемой бесплодия в течение жизни сталкивается очень большое число людей. Бесплодием страдает около 17,5% взрослого населения, что свидетельствует о настоятельной необходимости расширения доступа всех нуждающихся к недорогостоящим и высококачественным методам лечения бесплодия[1].
К сожалению, проблема бесплодия не только не теряет своей актуальности, но и характеризуется неуклонной тенденцией к глобализации. Согласно имеющимся данным, во всем мире с бесплодием сталкиваются 48 млн супружеских пар и 186 млн человек [1]. A. Agarwal et al. [2] указывают на мировую распространенность бесплодия на уровне 8–12% среди супружеских пар репродуктивного возраста. По разным зарубежным оценкам, в 20–40% всех случаев бесплодия причинами являются нарушения у мужчин, по другим данным, мужской фактор бесплодия составляет 33–41%. Около 22–30% случаев бесплодия во всем мире определяются как идиопатические (необъяснимые) [3, 4]. Мужской фактор бесплодия может быть обусловлен широким спектром причин — от генетических и гормональных нарушений до воздействия внешних факторов, таких как образ жизни, инфекции, экологические условия и стресс. Среди основных проявлений — снижение количества, подвижности или качества сперматозоидов, а также анатомические аномалии и нарушения в процессе сперматогенеза.
Однозначного ответа на то, какой из методов диагностики или лечения бесплодия является самым эффективным и безопасным, не существует в связи с полиэтиологичностью мужского бесплодия. При этом важную роль играют факторы, которые традиционно остаются «за кадром» — субклинические воспаления, оксидативный стресс, дисбаланс микроэлементов, эпигенетические изменения и влияние факторов окружающей среды.
В качестве «фармакотерапии» обычно применяют антиоксидантные добавки (БАД), которые, помимо модификации образа жизни, длительное время были фактически единственным способом улучшения параметров эякулята при идиопатическом бесплодии. В ряде научных исследований показано, что антиоксиданты могут улучшить частоту наступления беременности и живорождений, но доказательства и, соответственно, достоверность этого имеют очень низкий и низкий уровень соответственно [5]. В РФ антиоксиданты широко представлены на рынке, однако суммарные дозировки, применяемые в составе БАД, зачастую значительно ниже, чем те, о которых сообщается в научных публикациях [6], следствием чего являются существенные различия в результатах лечения. Так, одни исследователи сообщают о значительном улучшении определенных параметров спермы, другие — об отсутствии эффекта при использовании того же перорального антиоксиданта [7].
В связи с этим большой интерес представляют разработка и изучение новых эффективных и безопасных методов консервативного лечения мужского бесплодия. Успехи в протеомике позволили исследователям идентифицировать белки семенной плазмы и сперматозоидов и выявить различия в их содержании у фертильных и бесплодных пациентов [8]. Активные исследования в области изучения регуляторных пептидов позволили начать разработки с целью их терапевтического использования [9]. Регуляторные пептиды представляют собой специфические фрагменты белков, которые действуют как сигнальные элементы, участвуя в регуляции физиологических процессов. Среди механизмов действия регуляторных пептидов описаны важные для терапии бесплодия эффекты: предотвращение повреждений ДНК и мембран, повышение устойчивости митохондрий к повреждениям, их количества и активности в тканях семенников и непосредственно в сперматозоидах, усиление репаративных процессов в репродуктивных клетках, антиоксидантные (активация собственных антиоксидантных систем) и противовоспалительные свойства, подтвержденные исследованиями in vitro и in vivo [10–14].
Многие регуляторные пептиды проявляют свои биологические эффекты через рецепторы, связанные с G-белком (GPCR) [15]. Фармацевтические соединения, действующие через такой рецептор, могут по-разному активировать его нижележащие сигнальные пути [16]. Недавние исследования показали, что несколько членов суперсемейства GPCR играют решающую роль в поддержании ионно-водного гомеостаза придатка, формировании гематоэпидидимального барьера и созревании сперматозоидов [17]. Считается, что регуляторные пептиды действуют на геном. В частности, показано усиление экспрессии генов Hk1, PLTP, Hspa5, PDGFRa в репродуктивных клетках и клетках Сертоли под влиянием регуляторных полипептидов яичка [12–14]. На основании этих данных пептидную биорегулирующую терапию рассматривают как перспективный метод консервативного лечения мужского бесплодия. Протеом семенников играет важную роль в обеспечении мужской фертильности. В яичках обнаружено до 6 тыс. пептидов, которые могут участвовать в регуляции сперматогенеза [18]. У разных видов здоровых млекопитающих протеом яичек существенно не различается, поэтому представляется логичным разработка пептидного препарата, который мог бы использоваться в терапии мужского бесплодия [19].
Для терапии пациентов с мужским бесплодием был создан лекарственный препарат Тестивелл® (экс-Фертивелл), который представляет собой комплекс регуляторных пептидов с молекулярной массой не более 10 кДа, выделенных из семенников половозрелого крупного рогатого скота. С учетом того, что у мужчин с тяжелой формой бесплодия — олигоастенотератозооспермией часто выявляют высокий уровень фрагментации ДНК сперматозоидов, следствием чего могут быть потери беременности после экстракорпорального оплодотворения (ЭКО), было принято решение изучить эффективность данного препарата в снижении индекса фрагментации ДНК сперматозоидов (ИФДС).
Цель исследования: сравнить эффективность терапии с использованием парентерального препарата на основе регуляторных пептидов яичка с комплексной терапией (препарат регуляторных пептидов яичка + парентеральные антиоксиданты) у мужчин с олигоастенотератозооспермией c двунитевым разрывом ДНК.
Содержание статьи
Материал и методы
Проведено проспективное исследование с участием 65 мужчин из бесплодных пар, обратившихся за медицинской помощью в период с февраля 2023 г. по июль 2024 г.
Критерии включения:
мужской пол;
возраст от 25 до 49 лет;
бесплодный брак (отсутствие беременности у супруги после 12 мес. половой жизни без контрацепции);
нарушения сперматогенеза: наличие олигоастенотератозооспермии (в соответствии с рекомендациями ВОЗ, 2010), повышение фрагментации ДНК сперматозоидов (метод TUNEL —Transferase mediated dUTP Nick End Labeling) >15%;
уровень фолликулостимулируюшего гормона (ФСГ) не выше 11,1 мЕД/мл, лютеинизирующего гормона (ЛГ) — не выше 8,6 мМЕ/мл, ингибина В — не ниже 42 пг/мл, общего тестостерона — не выше 30 нМ/л.
Критерии невключения: экскреторное бесплодие, азоо- или аспермия в случае ретроградной эякуляции; инфекционно-воспалительные заболевания мочеполовой системы; варикоцеле; врожденные аномалии развития мочеполовых органов; перенесенные оперативные вмешательства на органах мочеполовой системы; заболевания мочеполовых органов, требующие проведения специализированного лечения; применение любой заместительной гормональной терапии с использованием половых гормонов; первичный или вторичный гипогонадизм, обусловленный хромосомными заболеваниями или генной аномалией; гиперпролактинемия; неудовлетворительный гликемический контроль (HbA ≥8%) при сахарном диабете; наличие неконтролируемой инфекции в результате воздействия вируса иммунодефицита человека (ВИЧ) и/или активного гепатита; наличие наркотической или алкогольной зависимости в анамнезе в течение последних 5 лет, аллергия на компоненты препаратов, женское бесплодие.
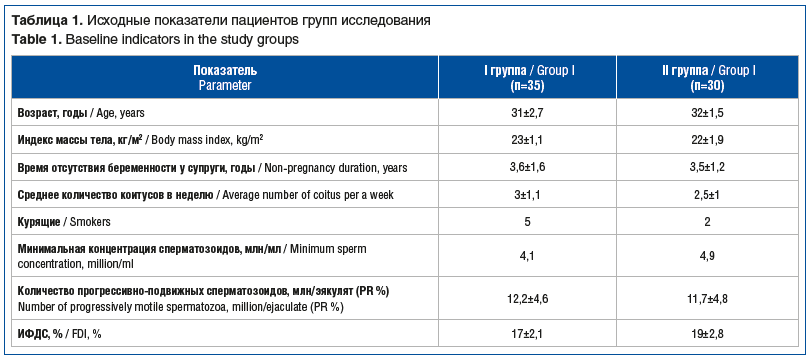
Случайным образом пациенты были распределены в 2 группы в зависимости от назначенного лечения. Пациенты I группы (n=35) получали препарат на основе регуляторных пептидов яичек (Тестивелл®) 5 мг, 1 инъекцию в 7 дней на протяжении 10 нед. (70 дней). Пациенты II группы получали Тестивелл® по аналогичной схеме, а также препараты, направленные на подавление оксидативного стресса в виде карнитина, концентрат для приготовления инфузионного раствора 100 мг/мл, 5 мл с разведением в 200 мл 0,9% раствора натрия хлорида 2 раза в неделю № 5 и препарата тиоктовой кислоты, концентрат для приготовления инфузионного раствора 30 мг/мл, 10 мл с разведением в 200 мл 0,9% раствора натрия хлорида 2 раза в неделю № 5 — всего курсом 10 инфузий общей продолжительностью 5 недель (35 дней). Исходная характеристика пациентов представлена в таблице 1.
Пациенты не получали лекарственную терапию по поводу бесплодия до начала исследования.
Исследование состояло из трех этапов: период скрининга — до 14 дней (визит 1); период терапии и оценки эффективности терапии — 100±5 дней (визит 2); период отсроченного наблюдения — 60±2 дня (визит 3).
Лабораторное обследование включало: спермограмму, MAR(IgG)-тест (mixed agglutination reaction), представляющий собой исследование доли нормальных активно-подвижных сперматозоидов, покрытых антиспермальными антителами, к общему количеству сперматозоидов, определение ИФДС, уровня общего тестостерона, ФСГ, ЛГ, ингибина В, АМГ, пролактина, эстрадиола, выявление возбудителей инфекций, передаваемых половым путем, в уретральном соскобе эпителиальных клеток методом полимеразной цепной реакции, серологическое исследование крови (HbsAg, Anti-HCV, ВИЧ), бактериологический посев мочи и эякулята с антибиотикограммой, УЗИ органов мошонки с допплерографией, ТРУЗИ предстательной железы, клинический и биохимический анализы крови, общий анализ мочи. Для оценки фертильности сперму получали путем мастурбации, период полового воздержания составил 3–5 сут. Исследование эякулята проводилось трехкратно, на каждом визите исследования.
Критериями эффективности считали динамику ИФДС и показателей концентрации и подвижности сперматозоидов, частоту наступления беременности.
Статистическая обработка результатов проведена с использованием программы Statistica v.10.2 (StatSoft Inc., США). Количественные показатели представлены как среднее арифметическое и стандартное отклонение (M±SD). Значимость различий показателей в группе до и после лечения оценивали с помощью парного t-теста Стьюдента. Различия считали статистически значимыми при p<0,05.
Результаты исследования
В I группе пациентов с олигоастенотератозооспермией (n=35) и применением Тестивелла в режиме 5 мг в течение 10 нед. выявлено увеличение средней концентрации сперматозоидов в 2,1 раза по сравнению с исходным уровнем. До курсовой терапии диапазон концентрации сперматозоидов в эякуляте был от 4 до 10 млн/мл, средняя концентрация сперматозоидов составила 6,9±0,17 млн/мл, средний ИФДС составлял 18% (табл. 2).
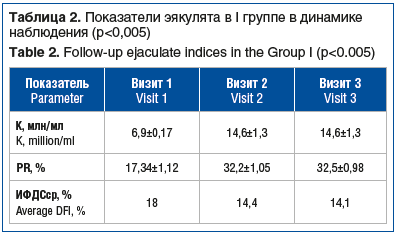
Через 100 дней (визит 2) наблюдалось уменьшение среднего ИФДС до референсного значения 14,4%, или минус 20% от исходного (р<0,005). Изменение относительных индивидуальных параметров минимальной концентрации сперматозоидов в эякуляте по сравнению с исходным уровнем составило 12,4 млн/мл, или 210,3% (р<0,005). На визите 3 (через 3 мес. после окончания курса терапии) эффект от лечения сохранялся практически на таком же уровне. Относительно морфологически нормальных сперматозоидов было отмечено увеличение показателя в абсолютных цифрах на визите 2 на 115%, однако в процентном соотношении их количество оставалось на исходном уровне. На визите 3 показатель в абсолютных цифрах оставался на уровне визита 2. ИФДС на визите 3 не изменялся в сравнении с показателем на визите 2. У 3 (9%) участников ИФДС не снизился после проведенного курса лечения. После того, как было окончено исследование и достигнуты изменения в спермограммах, в группе с олигоастенотератозооспермией были получены следующие результаты по исходам беременности: из 35 супружеских пар только 4 (11,4%) воспользовались вспомогательными репродуктивными технологиями (ВРТ). В данной группе супружеские пары с родившимся ребенком после ВРТ сообщили, что использовали технологию ЭКО. У всех супружеских пар, воспользовавшихся ВРТ, наступили роды первенцами. У 16 (46%) беременность наступила в естественном цикле, роды с живорождением наступили у 13 пар, у троих на 4–5-й неделе отмечена неразвивающаяся беременность. Результат лечения в группе мужчин с олигоастенотератозооспермией в целом можно расценить как положительный у 17 (48,5%) супружеских пар, достигших цели живорождения как в программе ВРТ (n=4), так и в естественном цикле (n=13). Спонтанная беременность наступала в течение 2–3 мес. после окончания курса терапии, т. е. уже в период 90 дней после окончания курса терапии.
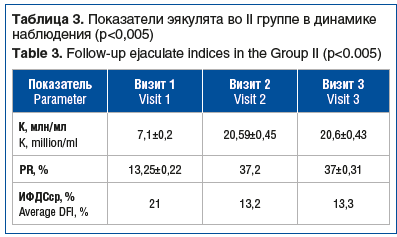
Во II группе мужчин с олигоастенотератозооспермией (n=30) до курсовой терапии диапазон концентрации сперматозоидов в эякуляте был от 5 до 10 млн/мл, средняя концентрация сперматозоидов составила 7,1±0,2 млн/мл, средний ИФДС составлял 21% (табл. 3). Через 100 дней (визит 2) выявлено увеличение средней концентрации сперматозоидов в 2,9 раза, а ИФДС снизился на 37%. У 1 (3%) участника не получено снижение ИФДС. Изменение относительных индивидуальных параметров минимальной концентрации сперматозоидов в эякуляте по сравнению с исходным уровнем составило 19,1 млн/мл, или 283% (р<0,005). На визите 3 эффект от лечения сохранялся практически на таком же уровне.
После лечения PR достигла референсных показателей спермограммы (ВОЗ, 2010), увеличившись через 100 дней от начала исследования в среднем на 181% (р<0,005). На визите 3 показатель сохранялся на прежнем уровне ±0,31%. Относительно морфологически нормальных сперматозоидов было отмечено увеличение показателя в абсолютных цифрах на визите 2 (100 дней) на 189%, однако процентное соотношение, как и в I группе, оставалось на исходном уровне. На визите 3 показатель в абсолютных цифрах оставался на прежнем уровне относительно визита 2.
После того, как было окончено лечение и достигнуты изменения в спермограммах, во II группе были получены следующие результаты по исходам беременности: из 30 супружеских пар только 3 (10%) воспользовались ВРТ. Эти пары с родившимся ребенком после ВРТ сообщили, что использовали технологию ЭКО. У всех супружеских пар, воспользовавшихся ВРТ, наступили роды первенцами. У 15 (50%) беременность наступила в естественном цикле, роды с живорождением наступили у 13 пар, у одной женщины на 4–5-й неделе отмечена неразвивающаяся беременность, у одной произошел неизбежный аборт (спорадический выкидыш). Результат лечения во II группе мужчин в целом можно расценить как положительный у 16 (53,3%) супружеских пар, достигших цели живорождения как в программе ВРТ (n=3), так и в естественном цикле (n=13). Спонтанная беременность наступала в течение 1–3 мес. после завершения курса терапии.
Обсуждение
Влияние на различные стадии сперматогенеза курсового введения Тестивелла в течение 10 нед. выражается в повышении концентрации, увеличении количества прогрессивно-подвижных форм и морфологически нормальных форм сперматозоидов в абсолютных цифрах.
В обеих группах мужчин с олигоастенотератозооспермией после лечения (визит 2) и наблюдения (визит 3) в парах спонтанная беременность наступила в 46 и 50% случаев соответственно. При сравнении показателей концентрации сперматозоидов, активно-подвижных и морфологически нормальных форм сперматозоидов выявлено их увеличение и достижение практически сопоставимых уровней. Однако во II группе можно отметить более выраженное снижение ИФДС по сравнению с I группой (37% против 20%). Необходимо отметить, что изначальный уровень ИФДС был выше во II группе, чем в I, — 19 и 17% соответственно. Дополнительно отмечена тенденция к более быстрому наступлению беременности в группе комплексной терапии. Тем не менее в обеих группах имелись пары с неразвивающейся беременностью. Возможно, одной из причин послужило отсутствие эффекта от проводимого лечения у тех мужчин, у которых не снизился ИФДС. В других случаях причиной могли быть другие эпигенетические факторы, которые потребуют дополнительных методов обследования. Парентеральное использование антиоксидантных лекарственных препаратов улучшает показатели эякулята. Они минуют желудочно-кишечный тракт и усиливают свойства препарата Тестивелл® путем доставки необходимых ингредиентов до органов-мишеней в бόльшей степени, чем использование пероральной БАД.
Полученные данные позволяют надеяться на проведение дальнейших исследований с использованием Тестивелла в комбинации с антиоксидантными лекарственными препаратами у пар с привычным невынашиванием. Учитывая положительную динамику у мужчин с олигоастенотератозооспермией через 1 мес. после завершения терапии с сохранением достигнутых показателей в течение 90 дней после окончания курса, возможно, будут целесообразны повторения курсов терапии пациентам из пар, у которых можно ожидать наступление беременности в естественном цикле.
Заключение
Таким образом, по результатам лечения тяжелой формы репродуктивной дисфункции с нарушением сперматогенеза в виде олигоастенотератозооспермии был сделан вывод, что изученный препарат на основе регуляторных пептидов яичка при применении по схеме 1 раз в неделю на протяжении 10 нед. в дозе 5 мг внутримышечно обладает клинической эффективностью, увеличивая концентрацию сперматозоидов в эякуляте, абсолютное количество прогрессивно-подвижных форм и, соответственно, процентное отношение и абсолютные цифры морфологически нормальных сперматозоидов. Терапия данным препаратом позволила добиться хороших результатов, увеличивая шансы наступления спонтанных беременностей, а также частоту зачатий естественным путем без вступления в программу ВРТ.
Накопление опыта и проведение дальнейшего анализа данных по межгрупповому сравнению, возможно, поможет ответить на вопрос о значимости использования комбинированного лечения препаратом на основе регуляторных пептидов яичка с парентеральной антиоксидантной терапией в снижении риска наступления неразвивающейся беременности у пар, мужчины в которых имеют высокий уровень ИФДС. Ѓ
СВЕДЕНИЯ ОБ АВТОРЕ:
Геворкян Ашот Рафаэлович — к.м.н., врач-уролог ГБУЗ «ГП № 212 ДЗМ»; 119620, Россия, г. Москва, Солнцевский пр-т, д. 11А; доцент кафедры урологии ФГБУ ДПО «ЦГМА»; 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 19, стр. 1А; ORCID iD 0000-0002-1410-5781
Контактная информация: Геворкян Ашот Рафаэлович, e-mail: ashot_gevorkyan@mail.ru
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.01.2025.
Поступила после рецензирования 19.02.2025.
Принята в печать 14.03.2025.
ABOUT THE AUTHOR:
Ashot R. Gevorkyan — C. Sc. (Med.), Urologist, City outpatient clinic No. 212; 11А, Solncevskiy av., Moscow, 119620, Russian Federation; Assistant Professor of the Department of Urology, Central State Medical Academy; 19, build. 1A, Marshal Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0002-1410-5781
Contact information: Ashot R. Gevorgyan, e-mail: ashot_gevorkyan@mail.ru
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.01.2025.
Revised 19.02.2025.
Accepted 14.03.2025.
[1] WHO: Infertility. 2022. (Electronic resource.) URL: https://www.who.int/news-room/fact-sheets/detail/infertility (access date: 14.12.2024).
Информация с rmj.ru
