Введение
Рак желудка (РЖ) является одной из наиболее распространенных форм злокачественных новообразований в России и в мире. В последние десятилетия в экономически развитых странах отмечается снижение заболеваемости и смертности от РЖ. Прежде всего это связано с изменением характера питания жителей этих стран и, несомненно, успехами в своевременной ранней диагностике заболевания, а также совершенствованием методов его лечения [1]. Однако на сегодняшний день РЖ все еще занимает лидирующие позиции в структуре заболеваемости и смертности, что стимулирует к продолжению совершенствования методов диагностики и лечения РЖ.
Существенный прорыв в диагностике, а затем и в лечении РЖ прежде всего связан с разработкой, внедрением и последующим совершенствованием фиброволоконной эндоскопической техники [1]. В широкую клиническую практику фиброволоконная эндоскопическая техника была внедрена в 60–70-х годах прошлого столетия. Впоследствии на смену ей пришла видеоэндоскопическая техника, которая активно продолжает развиваться.
В настоящее время в арсенале врача-эндоскописта имеются видеоэндоскопы с высоким разрешением и дополнительными функциями: узкоспектральным режимом, ZOOM-увеличением и др. Эти инновации позволяют выявлять не только опухоли на самых ранних стадиях, но и предопухолевые заболевания и патологические состояния желудка, благодаря чему в последние годы доля выявленного раннего РЖ значительно возросла [2].
До недавнего времени «золотым стандартом» лечения РЖ, в том числе и ранних его стадий, являлись радикальные резекции и гастрэктомии с D2-лимфодиссекцией [2, 3]. Выполнение столь радикальных операций, даже при ранних формах РЖ, полностью обосновано и оптимально с точки зрения принципов хирургического лечения злокачественных опухолей, но влечет за собой риск развития послеоперационных осложнений и летальных исходов, а также резкое снижение качества жизни пациентов в отдаленной перспективе [4]. По данным литературы, частота послеоперационных осложнений у пациентов, перенесших резекцию или гастрэктомию по поводу РЖ, достигает 50% [5].
Благодаря усовершенствованию системы скрининга, а также диагностики и лечения РЖ возросла доля пациентов, у которых РЖ обнаруживается на самых ранних стадиях, что привело к появлению термина «ранний рак желудка», применяемого к опухоли, ограниченной слизистой оболочкой или подслизистым слоем стенки желудка, независимо от наличия или отсутствия метастазов в регионарных лимфатических узлах.
Содержание статьи
Обзор эндоскопических методов диагностики и лечения РЖ
Возможности современной эндоскопической техники позволяют выявлять мельчайшие изменения слизистой оболочки желудка. Основные уточняющие эндоскопические методики, позволяющие обнаружить ранний РЖ, наиболее часто применяющиеся в современной практике, перечислены ниже.
Хромоскопия — метод окраски слизистой оболочки желудка с помощью различных красителей. Дает возможность обнаружить не только малозаметные при стандартном осмотре небольшие опухоли желудка, но и предопухолевые изменения слизистой оболочки.
Узкоспектральная эндоскопия — оптическая методика, основанная на использовании специальных оптических фильтров, суживающих спектр световой волны.
Увеличительная эндоскопия — позволяет осмотреть патологический участок слизистой оболочки с оптическим увеличением более чем в 100 раз, детально оценить его структуру и точные границы. Методика ценна не только с точки зрения обнаружения опухоли, но используется также и для радикального удаления опухоли посредством эндоскопической резекции слизистой оболочки.
Ультрасонография — метод, позволяющий оценить точную глубину инвазии опухоли в стенку желудка [6].
С помощью современной эндоскопической техники можно не только выявить РЖ, но и выполнить малоинвазивные эндоскопические операции по удалению обнаруженной опухоли, что резко снижает частоту осложнений и послеоперационной летальности. Кроме того, эндоскопическое удаление раннего РЖ — единственный возможный метод радикального лечения пациентов с отягощенным соматическим статусом, которым не показано выполнение большого хирургического вмешательства [6].
Методика эндоскопической резекции слизистой оболочки известна еще с 80-х годов прошлого столетия (рис. 1). После нанесения меток в пределах здоровых тканей по периферии патологического очага при помощи шарового эндоскопического коагулятора в подслизистый слой вводится физиологический раствор с адреналином в разведении 1:1 000 000. Далее с помощью эндоскопических щипцов, предварительно продетых через эндохирургическую петлю, патологический участок приподнимается и петля затягивается под основание образования, затем производится резекция слизистой оболочки единым блоком и в пределах здоровых тканей [6].
![Рис. 1. Этапы эндоскопической резекции слизистой обо- лочки с использованием двухканального эндоскопа [8]. А — подведение эндоскопической петли к опухоли; В, С — захват и подтягивание опухоли при помощи эндоскопических щипцов; D — затягивание коагуляционн Рис. 1. Этапы эндоскопической резекции слизистой обо- лочки с использованием двухканального эндоскопа [8]. А — подведение эндоскопической петли к опухоли; В, С — захват и подтягивание опухоли при помощи эндоскопических щипцов; D — затягивание коагуляционн](https://medblog.su/wp-content/uploads/2022/10/rannij-rak-zheludka-klinicheskoe-nablyudenie-malihova-o-a-ryabova-v-e-lozovaya-v-v-tumanyan-a-o-krylovetskaya-m-a-halaev-z-v.png)
С начала 2000-х годов широкое признание в клинической практике эндоскопистов получила новая методика — резекция слизистой оболочки с диссекцией в подслизистом слое (рис. 2). Основным преимуществом этой методики является возможность выполнения радикальных резекций единым блоком даже в случаях больших размеров опухоли или ее труднодоступного расположения в желудке. Кроме того, при использовании этой методики значительно увеличиваются шансы на радикальность резекции. В ходе резекции слизистой оболочки с диссекцией в подслизистом слое возможно контролировать размер и форму резекции, а также выполнять удаление патологических участков с изъязвлением. Основными недостатками описанной методики являются длительность выполнения и более высокий риск развития осложнений, таких как перфорация стенки желудка и кровотечение [7].
![Рис. 2. Эндоскопическая резекция слизистой оболочки с диссекцией подслизистого слоя [8]. А — ранее обнаруженный патологический очаг в желудке (хромоскопия с использованием индигокармина); В — нанесение меток по периферии опухоли при помощи эндоскопическог Рис. 2. Эндоскопическая резекция слизистой оболочки с диссекцией подслизистого слоя [8]. А — ранее обнаруженный патологический очаг в желудке (хромоскопия с использованием индигокармина); В — нанесение меток по периферии опухоли при помощи эндоскопическог](https://medblog.su/wp-content/uploads/2022/10/1666281660_607_rannij-rak-zheludka-klinicheskoe-nablyudenie-malihova-o-a-ryabova-v-e-lozovaya-v-v-tumanyan-a-o-krylovetskaya-m-a-halaev-z-v.png)
Важно отметить, что эндоскопическому удалению подлежат патологические участки, для которых риск лимфогенного метастазирования опухоли невысокий.
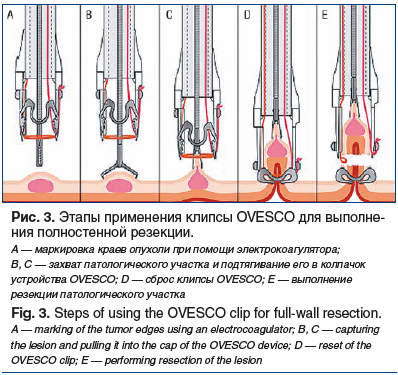
Кроме представленных вариантов эндоскопического удаления раннего РЖ, возможно выполнение полностенной резекции желудка. Одним из вариантов такой методики является применение клипсы OVESCO (рис. 3, 4).

В эндоскопическом отделении ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России накоплен значительный опыт диагностики и лечения пациентов с ранним РЖ. История болезни одного из таких пациентов с ранним рецидивирующим РЖ заслуживает отдельного внимания и подробно изложена далее.
Клиническое наблюдение
Пациент Л., 72 года. Из анамнеза известно, что с сентября 2019 г. пациент предъявляет жалобы на периодическую умеренную боль и дискомфорт в эпигастрии. Указанные жалобы чаще всего беспокоили пациента после приема пищи. Кроме того, появилась и стала нарастать общая слабость. С указанными жалобами пациент обратился к врачу-терапевту по месту жительства, по направлению которого пациенту была выполнена плановая эзофагогастродуоденоскопия (ЭГДС). По результатам ЭГДС в субкардиальном отделе желудка обнаружена опухолевая инфильтрация, выполнена биопсия обнаруженного образования. По данным морфологического и цитологического исследований, проведенных по месту жительства пациента, в субкардиальном отделе желудка диагностирована аденокарцинома.
В научно-консультативном отделении ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (далее — Центр) пациент прошел комплексное дообследование:
КТ органов грудной и брюшной полостей с внутривенным контрастированием: данных за наличие метастазов в органах грудной и брюшной полостей нет.
Рентгенография органов грудной полости: патологические изменения в органах грудной полости не выявлены.
УЗИ органов брюшной полости и малого таза: данных за наличие метастазов нет.
Анализы крови для скрининга инфекций, имеющих особое эпидемиологическое значение (ВИЧ, сифилис, гепатиты В и С): отрицательные.
В условиях эндоскопического отделения выполнена повторная ЭГДС с биопсией ранее обнаруженной опухоли. Подтверждена аденокарцинома желудка.
Дополнительно, в условиях эндоскопического отделения, выполнена эндоскопическая ультрасонография опухоли с целью определения глубины инвазии в стенку желудка. Опухоль исходила из слизистой оболочки желудка и распространялась в ее пределах, признаков инвазии в подслизистый слой не обнаружено. Общий размер образования составлял 1,5 см.
Полученные в ходе комплексного обследования данные позволили сформулировать окончательный диагноз: ранний рак субкардиального отдела желудка — и определить тактику лечения пациента.
В октябре 2019 г. в эндоскопическом отделении Центра пациенту выполнена эндоскопическая резекция слизистой оболочки желудка с диссекцией в подслизистом слое. Малоинвазивное хирургическое вмешательство больной перенес удовлетворительно, осложнения в послеоперационном периоде не наблюдались.
В феврале 2020 г. проведено контрольное обследование пациента. Выполнена ЭГДС, по результатам которой на месте ранее удаленной опухоли выявлен бесструктурный разрыхленный участок слизистой оболочки с перифокальной гиперемией размером 7 мм. В ходе эндоскопического исследования выполнена прицельная биопсия из подозрительного на наличие дисплазии участка слизистой оболочки. По результатам морфологического исследования получены данные за наличие тяжелой дисплазии в зоне ранее выполненной резекции слизистой оболочки желудка. Пациенту рекомендовано выполнение повторной резекции слизистой оболочки с диссекцией в подслизистом слое в условиях эндоскопического отделения Центра. Несмотря на малый размер патологического очага, указанный объем вмешательства был рекомендован ввиду рецидива заболевания.
В феврале 2020 г. пациенту выполнена повторная эндоскопическая резекция слизистой оболочки желудка с диссекцией в подслизистом слое. Участок слизистой оболочки с фокусом дисплазии удален единым блоком и отправлен на морфологическое исследование. Послеоперационный период протекал без осложнений. Результат морфологического исследования: фрагмент слизистой оболочки желудка с картиной хронического слабоактивного гастрита и очагом тяжелой дисплазии эпителия (high grade).
В июне 2020 г. проведено плановое контрольное обследование пациента. В ходе выполнения ЭГДС из зоны ранее проведенной повторной резекции выполнена биопсия, полученный фрагмент отправлен на морфологическое исследование. Результат патоморфологического исследования: фрагмент покровно-ямочного эпителия со слабым хроническим воспалением и реактивными изменениями; в собственной пластинке, у края фрагмента, определяется группа желез, принадлежащая тубулярной аденокарциноме. Таким образом, у пациента диагностирован и подтвержден второй рецидив заболевания.
Ввиду повторного рецидива заболевания пациенту было предложено хирургическое вмешательство в объеме проксимальной субтотальной резекции желудка, от которой он категорически отказался. По этой причине была запланирована повторная эндоскопическая резекция слизистой оболочки желудка, которая была выполнена в июле 2020 г. после комплексного обследования пациента в условиях Центра. По результатам предоперационного обследования данных за наличие метастазов в органах грудной и брюшной полостей, а также малого таза не получено. Повторное малоинвазивное хирургическое вмешательство пациент перенес удовлетворительно, послеоперационные осложнения не наблюдались.
В течение следующего года пациент проходил контрольные обследования с регулярным выполнением ЭГДС с биопсией в условиях Центра. Данных за рецидив заболевания не было. Однако в октябре 2021 г. во время контрольной ЭГДС был заподозрен рецидив заболевания на месте ранее выполненных резекций слизистой оболочки желудка с диссекцией в подслизистом слое (рис. 5, 6). По данным морфологического исследования подтвержден рецидив заболевания. Пациенту рекомендована повторная операция в объеме проксимальной субтотальной резекции желудка, от которой он снова категорически отказался, настаивая на эндоскопическом лечении.
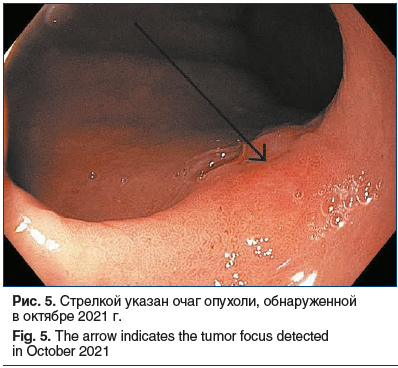
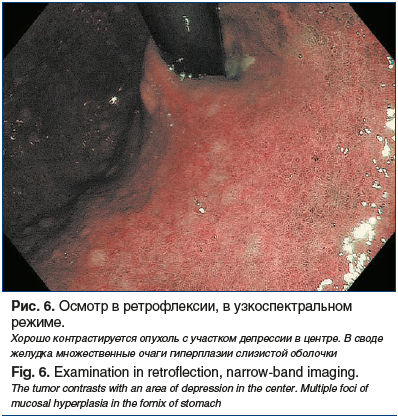
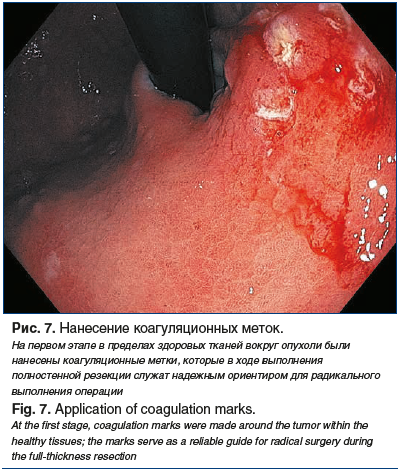
Ситуация обсуждалась на онкологическом консилиуме. Учитывая три рецидива заболевания, приняли решение о попытке выполнения полностенной резекции. Опухоль располагалась в субкардиальном отделе желудка, что предполагало технические трудности для выполнения операции в таком объеме. По этой причине эндоскопическое вмешательство проводилось в условиях развернутой операционной Центра с участием ведущих хирургов. В случае технической невозможности выполнения полностенной резекции с использованием клипсы OVESCO предполагалось расширение объема операции до лапароскопической атипичной резекции желудка с эндоскопическим ассистированием. Полностенная резекция была успешно выполнена в условиях операционной (рис. 7–9). На сегодняшний день пациент находится под наблюдением и регулярно проходит контрольные обследования. Данных за рецидив заболевания нет. Срок послеоперационного наблюдения к настоящему времени составляет 6 мес.
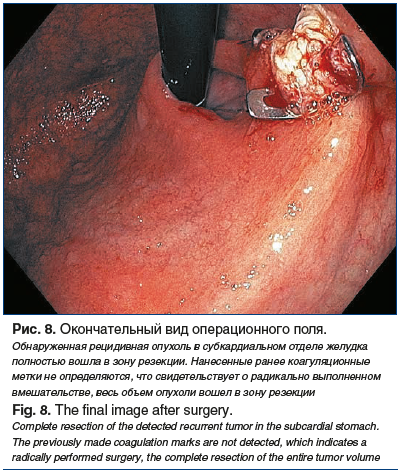
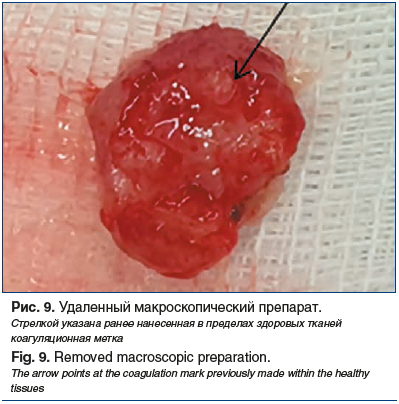
Обсуждение
Исход лечения РЖ напрямую зависит от грамотной стратификации пациентов, которым показано эндоскопическое лечение ранних форм РЖ.
Для отбора пациентов с РЖ, которым может быть выполнена эндоскопическая резекция слизистой оболочки или эндоскопическая резекция слизистой оболочки с диссекцией в подслизистом слое, рекомендуется использовать стандартные критерии:
инвазия опухоли в пределах слизистой оболочки;
аденокарцинома высокой или умеренной степени дифференцировки;
опухоли I, IIа–b стадии;
отсутствие клинически (КТ, эндосонография) определяемых метастазов в регионарных лимфоузлах [9].
При планировании эндоскопической резекции всем пациентам должно быть выполнено комплексное эндоскопическое обследование (увеличительная эндоскопия, NBI, хромоэндоскопия, эндосонография) для оценки глубины инвазии и определения истинных границ зоны опухоли, включая очаги тяжелой дисплазии.
Ранний РЖ характеризуется низкой частотой лимфогенного метастазирования. Только у 10–15% пациентов с ранним (T1) РЖ обнаруживаются метастазы в регионарных лимфатических узлах. При глубине инвазии опухоли в пределах слизистого слоя этот показатель составляет 3%, а при вовлечении подслизистого слоя может достигать 20% [9].
Эндоскопическая резекция раннего РЖ показана также пациентам с отягощенным соматическим статусом, у которых имеется высокий риск развития жизнеугрожающих осложнений при выполнении хирургических вмешательств в объеме гастрэктомии или резекции желудка.
Выбор между эндоскопической резекцией слизистой оболочки и резекцией слизистой оболочки с диссекцией подслизистого слоя основывается прежде всего на размерах патологического очага. В случае, если размер опухоли превышает 10–15 мм, показана резекция слизистой оболочки с диссекцией в подслизистом слое.
Объем предоперационной подготовки пациента к эндоскопической резекции слизистой оболочки или эндоскопической резекции слизистой оболочки с диссекцией подслизистого слоя рекомендуется такой же, как при открытых хирургических вмешательствах. Это необходимо для всесторонней оценки риска развития таких осложнений, как кровотечение или перфорация стенки желудка. В послеоперационном периоде до полного рубцевания пострезекционной язвы пациенты должны получать препараты из группы ингибиторов протонной помпы.
Заключение
Обнаружение РЖ на самых ранних стадиях позволяет не только значительно повысить шансы пациента на полное излечение, но и проводить лечение с помощью максимально щадящих, малоинвазивных методов [10]. Эндоскопическая резекция слизистой оболочки, резекция слизистой оболочки с диссекцией в подслизистом слое, полностенная резекция — сравнительно молодые, однако уже широко зарекомендовавшие себя самостоятельные методы лечения ранних форм РЖ. Эндоскопическая резекция раннего РЖ также является единственно возможным методом радикального лечения РЖ у пациентов с отягощенным соматическим статусом, которым невозможно выполнение резекции желудка или гастрэктомии.
Сведения об авторах:
Малихова Ольга Александровна — д.м.н., заведующая эндоскопическим отделением НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115438, Россия, г. Москва, Каширское ш., д. 23; профессор кафедры онкологии и паллиативной медицины ФГБОУ ВО ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0003-0829-7809.
Рябова Вероника Евгеньевна — врач-эндоскопист эндоскопического отделения НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115438, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0003-2904-0527.
Лозовая Валерия Витальевна — врач-эндоскопист эндоскопического отделения НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115438, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0001-6262-7763.
Туманян Армен Овикович — д.м.н., профессор, врач-эндоскопист научно-консультативного отделения НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115438, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0001-5863-5197.
Крыловецкая Мария Александровна — врач-эндоскопист эндоскопического отделения НИИ клинической онкологии им. академика РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115438, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-0868-3948.
Халаев Залимхан Вахамурадович — заведующий отделением эндоскопии ООО «Медицинская компания»; 364047, Россия, г. Грозный, ул. им. С.Ш. Лорсанова, д. 25а; ORCID iD 0000-0003-0688-2879.
Контактная информация: Рябова Вероника Евгеньевна, e-mail: veronika-zhorova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 21.03.2022.
Поступила после рецензирования 13.04.2022.
Принята в печать 12.05.2022.
About the authors:
Olga A. Malikhova — Dr. Sc. (Med.), Head of Department of Endoscopy of the N.N. Trapeznikov Research Institute of Clinical Oncology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; Professor, Department of Oncology and Palliative medicine, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0003-0829-7809.
Veronika E. Ryabova — endoscopist, Department of Endoscopy of the N.N. Trapeznikov Research Institute of Clinical Oncology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0000-0003-2904-0527.
Valeriya V. Lozovaya — endoscopist, Department of Endoscopy of the N.N. Trapeznikov Research Institute of Clinical Oncology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0000-0001-6262-7763.
Armen O. Tumanyan — Dr. Sc. (Med.), Professor, endoscopist, Department of Endoscopy of the N.N. Trapeznikov Research Institute of Clinical Oncology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0000-0001-5863-5197.
Maria A. Krylovetskaya — endoscopist, Department of Endoscopy of the N.N. Trapeznikov Research Institute of Clinical Oncology, N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoe road, Moscow, 115478, Russian Federation; ORCID iD 0000-0002-0868-3948.
Zalimhan V. Halaev — Head of Department of Endoscopy, «Medical Company» LLC; 25a, S.Sh. Lorasanov str., Grozny, 364047, Russian Federation; ORCID iD 0000-0003-0688-2879.
Contact information: Veronika E. Ryabova, e-mail: veronika-zhorova@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 21.03.2022.
Revised 13.04.2022.
Accepted 12.05.2022.
Информация с rmj.ru
