Введение
POEMS-синдром (P — полинейропатия, O — органомегалия, E — эндокринопатия, M — моноклональная гаммапатия, S — изменения кожи) относится к группе паранеопластических синдромов, возникающих вследствие первичного опухолевого поражения клеток плазмоцитарного ряда в костном мозге [1]. Патогенез синдрома в настоящее время полностью не изучен. Высказываются предположения о том, что вследствие моноклональной плазмоклеточной дискразии в костном мозге запускается гиперпродукция провоспалительных цитокинов, включая наиболее значимый из них сосудистый эндотелиальный фактор роста (vascular endothelial growth factor, VEGF). VEGF, являясь мультифункциональным цитокином, отвечает за процессы ангиогенеза и повышения проницаемости сосудов. Уровень VEGF зачастую значительно повышен у пациентов с POEMS-синдромом по сравнению с пациентами, имеющими другие гематологические заболевания и воспалительные полинейропатии [2]. POEMS-синдром — довольно редкое заболевание. По данным литературы, распространенность синдрома составляет 3 случая на 1 млн населения. POEMS-синдром манифестирует в возрасте от 40 до 60 лет и несколько чаще встречается у мужчин [1, 3].
Несмотря на существование диагностических критериев POEMS-синдрома, разработанных группой исследователей из клиники Mayo во главе с A. Dispenzieri [1], это заболевание остается сложным для диагностики в клинической практике врача-невролога. Полинейропатия с демиелинизирующим паттерном по данным электронейромиографии (ЭНМГ) может быть ошибочно принята за хроническую воспалительную демиелинизирующую полинейропатию (ХВДП). Повышение уровня парапротеина часто незначительно и поэтому упускается из виду, а системные проявления заболевания объясняются не связанной с ним сопутствующей патологией [4]. Неврологические проявления не всегда возникают в дебюте заболевания, наиболее часто POEMS-синдром манифестирует с системных и лабораторных признаков, поэтому такие пациенты сразу попадают под наблюдение врача-гематолога, который определяет тактику лечения.
Особенность нашего клинического наблюдения заключается в том, что неврологические проявления POEMS-синдрома опережали системные признаки и лабораторные маркеры на 8 мес., что отдаляло своевременную диагностику и лечение заболевания.
Клиническое наблюдение
Пациент Т., 36 лет, поступил в клинику неврологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России в апреле 2021 г. При поступлении пациент предъявлял жалобы: на простреливающие боли в ступнях и пальцах ног; слабость в ногах в виде невозможности активных движений и ходьбы; слабость в руках, преимущественно в кистях (невозможность активных движений в кистях и в локтевом суставе).
Первые признаки заболевания возникли в феврале 2020 г. в виде парестезий, дизестезий и сильных нейропатических болей в ступнях. Спустя 1 мес. от начала заболевания развилась слабость в дистальных отделах нижних конечностей. На протяжении 6 мес. от дебюта симптомов у пациента прогрессировала слабость в дистальных и проксимальных отделах ног, через 7 мес. возникла слабость в кистях. На 10-й месяц заболевания слабость в ногах и кистях достигла степени плегии, появилась слабость в проксимальных отделах верхних конечностей. Из анамнеза известно, что с момента начала заболевания пациент похудел примерно на 60 кг.
На 2-й месяц от начала заболевания пациенту выполнена ЭНМГ верхних и нижних конечностей, результаты которой свидетельствовали о демиелинизирующем и вторичном аксональном поражении нервов верхних и нижних конечностей. При повторной ЭНМГ на 13-й месяц заболевания у пациента было зафиксировано электрическое «молчание» мышц нижних конечностей. Спустя 10 мес. от дебюта заболевания пациент самостоятельно выполнил компьютерную томографию (КТ) органов грудной и брюшной полости и малого таза, по данным которой выявлялись немногочисленные гиперплазированные внутригрудные, подвздошные, паховые лимфатические узлы, гепатоспленомегалия.
С 4-го по 11-й месяц течения заболевания пациента наблюдали с диагнозом ХВДП, он получал терапию пероральными глюкокортикостероидами, однако положительного эффекта от лечения не отмечалось. Терапия внутривенным иммуноглобулином и высокообменный плазмаферез до поступления в стационар не проводились.
На момент поступления в клинику неврологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России срок заболевания составил 14 мес. В объективном статусе обращали на себя внимание гиперпигментированные кожные покровы бронзовой окраски. На коже пальцев кистей и стоп — множественные пигментированные пятна по типу гиперкератоза. Также имелось единичное пигментированное пятно гиперкератоза в области большого вертела правой бедренной кости. На коже стоп имелись трофические изменения, на ногах и руках — лейконихии (рис. 1, 2).
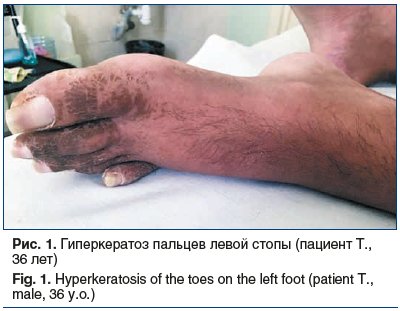
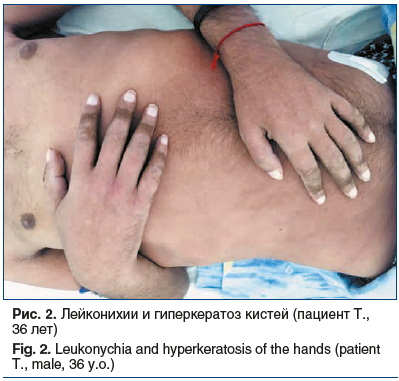
В неврологическом статусе на момент поступления был выявлен полиневритический синдром, представленный в основном грубыми двигательными расстройствами в виде арефлексии нижних и верхних конечностей, глубокого тетрапареза до плегии в ногах с сохранными минимальными движениями в кистях, диффузной мышечной атрофией. Также имелись грубые расстройства поверхностной чувствительности: анестезия по типу перчаток и носков, гипестезия по типу высоких гольфов, аллодиния в ступнях. Присутствовали выраженные нарушения глубокой чувствительности: отсутствие вибрационной чувствительности в верхних конечностях с уровня головки плечевых костей, в нижних конечностях с уровня надколенников, отсутствие суставно-мышечного чувства при движениях в лучезапястных и голеностопных суставах с двух сторон. Кроме того, имелись вегетативные расстройства в виде похолодания и трофических изменений кожи кистей и стоп, стойкого красного дермографизма кожи голеней и стоп. Также у пациента имелся выраженный нейропатический болевой синдром в ногах, который не купировался терапевтическими суточными дозами габапентина (до 2400 мг/сут), дулоксетина (до 60 мг/сут), карбамазепина (до 1200 мг/сут).
Состояние пациента при поступлении было оценено по следующим шкалам выраженности полинейропатии: шкала оценки инвалидизации при воспалительной нейропатии INCAT (Inflammatory Neuropathy Cause and Treatment), опросник качества жизни у пациентов с воспалительными полинейропатиями I-RODS (Inflammatory Rasch-built Overall Disability Scale), шкала невропатических нарушений NIS (Neuropathy Impairment Score). Сумма баллов по шкале INCAT составила 9, по шкале I-RODS — 0, по шкале NIS — 175,5.
Результаты лабораторных исследований. По данным клинического анализа крови выявили эритроцитоз 6,96×1012/л и тромбоцитемию 550×109/л, в биохимическом анализе крови — повышение уровня ТТГ до 6,068 мМЕ/л, снижение содержания общего белка до 57 г/л и витамина В12 до 103,3 пмоль/л. Общий анализ мочи и анализ на общий белок в суточной моче в пределах референсных значений, белок Бенс-Джонса в моче не обнаружен. По данным исследования ликвора выявлено значимое повышение уровня белка до 2460 мг/л, остальные показатели без особенностей. Лабораторные маркеры заболеваний соединительной ткани также без особенностей. По результатам капиллярного электрофореза белков сыворотки крови наблюдалось абсолютное уменьшение концентрации альбумина до 28,4 г/л; абсолютные значения глобулинов были в пределах референсных. Иммуноглобулины классов A, M, G обнаруживались также в пределах референсных значений. В аликвоте мочи обнаружено повышение уровня свободных легких лямбда-цепей иммуноглобулинов до 13,61 мкг/мл. Легкие цепи типов каппа и лямбда в сыворотке крови были в пределах референсных значений. Проводилось типирование образцов сыворотки и мочи иммунохимическим методом, результаты показали наличие (1,17 г/л) парапротеина, представленного IgG/lambda.
В целях поиска остеосклеротических и остеодеструктивных изменений скелета была выполнена низкодозная КТ всего тела, по результатам которой в теле правой лопатки определялся обширный участок разрежения костной ткани с ровным склерозированным контуром, частичным нарушением кортикального слоя и наличием в структуре мягкотканного компонента размером до 31×16×31 мм, в правом поперечном отростке позвонка S4 — схожий участок разрежения костной ткани с ровным четким контуром максимальным размером до 8×15 мм (рис. 3).
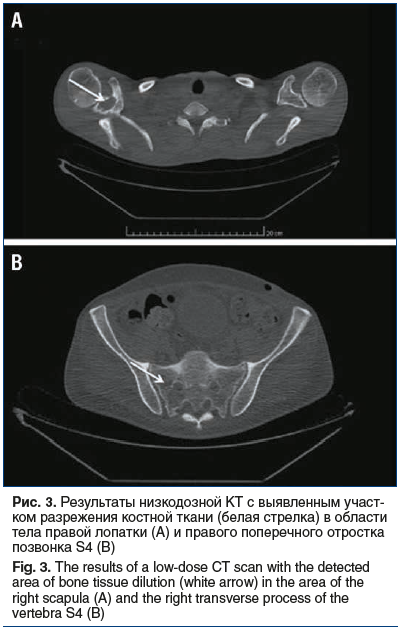
В рамках дифференциального диагноза первичного амилоидоза была выполнена биопсия подкожной жировой клетчатки области живота и исследована сыворотка крови на β2-микроглобулин. По результатам биопсии признаков накопления амилоида не выявлено, уровень β2-микроглобулина был повышен до 5,18 мг/л.
По результатам проведенных лабораторных и инструментальных исследований назначена консультация гематолога с последующим выполнением трепан-биопсии костного мозга. В ходе комплексного иммуногистохимического исследования полученного биоптата костного мозга был выявлен умеренно выраженный избыток плазматических клеток (7–8%) без признаков монотипической экспрессии легких цепей.
Таким образом, на основании данных клинической картины, анамнеза и проведенного на догоспитальном и госпитальном этапах обследования можно было заподозрить у пациента наличие POEMS-синдрома: имели место 2 обязательных больших критерия POEMS-синдрома, 1 дополнительный большой критерий и 4 малых критерия.
Совместно с гематологом было принято решение об инициации специфической терапии леналидомидом, так как применение бортезомиба (первая линия терапии при POEMS-синдроме) в данном случае было противопоказано по причине риска прогрессии полинейропатии.
После выписки из стационара пациент взят под динамическое наблюдение гематологом с целью инициации лечения POEMS-синдрома по схеме, включающей препараты леналидомид и дексаметазон.
Спустя 3 мес. после начала специфической терапии у пациента наблюдается положительная динамика в виде уменьшения выраженности моторного дефицита и снижения интенсивности нейропатического болевого синдрома. Также наблюдается улучшение в соматическом статусе в виде нормализации массы тела, уменьшения гиперпигментации кожных покровов. Пациент продолжает специфическое лечение и остается под наблюдением врача-гематолога и врача-невролога.
Обсуждение
В структуре диагностики воспалительных полинейропатий POEMS-синдром занимает особое место. При развернутой клинической картине синдрома постановка верного диагноза не составляет труда, однако в тех случаях, когда развитие неврологической симптоматики опережает системные клинические и лабораторные проявления, врачу-неврологу сложно своевременно заподозрить POEMS-синдром и направить пациента к врачу-гематологу для начала специфической терапии. По данным литературы, дебют POEMS-синдрома в виде неврологических симптомов встречается менее чем у 50% пациентов с данным заболеванием [3].
Представленное нами клиническое наблюдение интересно тем, что неврологическая симптоматика опережала классические системные клинические признаки POEMS-синдрома (гепатоспленомегалия и лимфаденопатия) примерно на 10 мес. Следует отметить, что в дебюте заболевания пациент был прицельно обследован для исключения парапротеинемических полинейропатий, однако данных за патологическую секрецию парапротеина по результатам лабораторных анализов обнаружено не было.
Из-за отсутствия данных за POEMS-синдром в дебюте заболевания пациенту на основании критериев EFNS/PNS 2010 г. был установлен диагноз достоверной типичной формы ХВДП. В литературе также упоминается, что ошибочный диагноз ХВДП у пациентов с POEMS-синдромом не является редкостью. H.C. Lehmann et al. [5] в своей работе приходят к выводу, что в связи со схожестью клинической картины и несовершенством существующих критериев диагноза ХВДП пациенты с POEMS-синдромом формально полностью удовлетворяют критериям достоверной ХВДП. У пациента в представленном нами случае имелись все клинические признаки типичной формы ХВДП, а именно: а) симметричные проксимальная и дистальная мышечная слабость и чувствительные нарушения в руках и ногах, развивающиеся в течение не менее 2 мес.; б) хроническое прогрессирующее течение заболевания; в) отсутствие сухожильных рефлексов на руках и ногах. Кроме того, анализ ликвора показал повышение уровня белка до 2460 мг/л при цитозе менее 10 лейкоцитов на 1 мм3. Данные ЭНМГ при исследовании нервов верхних и нижних конечностей также соответствовали демиелинизирующему паттерну, характерному для достоверной ХВДП [6].
По мнению ряда авторов, лишь незначительные нюансы в электрофизиологической картине заболевания позволяют отличить полинейропатию при POEMS-синдроме от истинной ХВДП. Предположить POEMS-синдром по данным ЭНМГ можно при обнаружении признаков демиелинизации, преимущественно в нервном стволе, а не в дистальных отделах нерва, а также более выраженной аксональной дегенерации в нервах нижних конечностей по сравнению с верхними [7]. В описанном нами клиническом наблюдении у пациента в развернутой стадии заболевания по данным ЭНМГ наблюдалось электрическое «молчание» мышц нижних конечностей в виде снижения амплитуды М-ответа с исследуемых двигательных нервов до нуля, что позволяет сделать вывод о выраженном повреждении нервов нижних конечностей.
Из всего вышеперечисленного следует вывод, что иммуноопосредованная полинейропатия при POEMS-синдроме является одним из заболеваний, скрывающихся за маской ХВДП. Для того чтобы вовремя заподозрить диагноз POEMS-синдрома у пациента с клиникой типичной ХВДП, врачу-неврологу необходимо обращать внимание на так называемые «красные флаги». В литературе «красными флагами» POEMS-синдрома считаются следующие признаки: выраженные нейропатические или мышечные боли в стопах или икрах в дебюте заболевания, коморбидные состояния или признаки системного поражения органов (отеки, потеря веса, органомегалия, пигментация кожи или ногтей, сыпь, гинекомастия) и отсутствие ответа на адекватную терапию ХВДП первой линии.
Также для иммуноопосредованной полинейропатии при POEMS-синдроме характерно более быстрое развитие нарушений самостоятельной ходьбы, чем при ХВДП, — в среднем от дебюта заболевания до инвалидизации пациента проходит 9,5 мес. [8]. У представленного пациента заболевание дебютировало выраженными нейропатическими болями в ступнях. Также обращает на себя внимание постепенное выраженное снижение массы тела до 60 кг за 1 год от начала заболевания. Кроме того, при поступлении при внешнем осмотре пациента имелись ярко выраженная гиперпигментация кожи и изменение цвета ногтей (лейконихии). При анализе темпов прогрессирования заболевания можно отметить быстрое и неуклонное нарастание неврологического дефицита до плегии в ногах и кистях за 10 мес. с момента дебюта заболевания, несмотря на проводимую в адекватных дозах терапию ХВДП первой линии пероральной формой метилпреднизолона в течение 6 мес. в дозе 1 мг/кг/сут.
Таким образом, все вышеперечисленные атипичные черты, выявленные при тщательном сборе анамнеза и объективном обследовании пациента, позволили заподозрить диагноз иммуноопосредованной полинейропатии, ассоциированной с POEMS-синдромом. Однако для исключения альтернативных причин воспалительной полинейропатии и для подтверждения диагноза согласно критериям POEMS-синдрома мы провели ряд дополнительных лабораторных и инструментальных обследований, результаты которых представлены выше. В целях поиска очагов остеосклероза была выполнена низкодозная КТ тела пациента, которая является более чувствительным методом в диагностике изменений скелета при POEMS-синдроме, чем рентгенография плоских костей [9]. В соответствии с критериями POEMS-синдрома, предложенными в 2014 г. A. Dispenzieri et al. [1], для подтверждения диагноза необходимо наличие обоих обязательных больших критериев, одного из трех других больших критериев и одного из шести малых критериев.
В таблице мы приводим сравнение критериев POEMS-синдрома и имеющихся данных пациента Т. с патогенетическим обоснованием их возникновения.
![Таблица. POEMS-синдром: диагностические критерии [1], клинические проявления и их патогенетическое обоснование у пациента Т. Table. POEMS syndrome: diagnostic criteria [1], clinical manifestations and their pathogenetic rationale in patient T. Таблица. POEMS-синдром: диагностические критерии [1], клинические проявления и их патогенетическое обоснование у пациента Т. Table. POEMS syndrome: diagnostic criteria [1], clinical manifestations and their pathogenetic rationale in patient T.](https://medblog.su/wp-content/uploads/2022/11/1667868656_120_poems-sindrom-s-debyutom-zabolevaniya-v-vide-dizimmunnoj-hronicheskoj-polinejropatii-korotaeva-v-v-kushnir-ya-b-kudyasheva-o-v-polushin-a-yu-krasnov-v-s.png)
Важным аспектом в обследовании пациента с POEMS-синдромом является проведение дифференциального диагноза с такими лимфопролиферативными заболеваниями, как множественная миелома, вялотекущая миелома и солитарная плазмоцитома. Также необходимо исключить полинейропатию, ассоциированную с моноклональной гаммапатией неопределенного значения, которая представляет собой большую диагностическую проблему, так как встречается у 3–4% людей в популяции старше 50 лет, а риск трансформации ее в злокачественное лимфопролиферативное заболевание с возрастом увеличивается на 1% каждый год [16]. В связи с этим пациентам с парапротеинемией проводится трепан-биопсия костного мозга с последующим иммуногистохимическим исследованием. Установление патоморфологического диагноза очень важно, так как лечение, последующая поддерживающая терапия и ожидаемые токсические эффекты от лечения совершенно различаются при разных лимфопролиферативных заболеваниях [1].
Нельзя оставить без внимания и трудности лечения пациентов с POEMS-синдромом, в клинической картине которых доминирует выраженный неврологический дефицит. Поскольку опубликованных рандомизированных клинических исследований в группе пациентов с POEMS-синдромом мало, рекомендации по лечению основаны на ограниченных данных, полученных на небольших когортах пациентов, и описаниях отдельных клинических наблюдений. Для лечения POEMS-синдрома используются такие методы, как лучевая терапия, цитостатики (мелфалан, бортезомиб), иммуномодуляторы (леналидомид, талидомид), препарат моноклональных антител к VEGF (бортезомиб), аутотрансплантация гемопоэтических стволовых клеток (АТГСК), а также комбинированный подход в виде высокодозной иммуносупрессивной терапии с последующей АТГСК. Протокол терапии подбирается индивидуально для каждого пациента врачом-гематологом на основании протоколов лечения заболевания в рамках клинических рекомендаций. В связи с тем, что POEMS-синдром является плазмоклеточной дискразией, режимы терапии данного заболевания схожи с использующимися при лечении множественной миеломы [17]. В случаях POEMS-синдрома без поражения костного мозга используется локальная лучевая терапия, при поражении костного мозга применяются протоколы терапии, включающие химиотерапевтические агенты, иммуномодуляторы, моноклональные антитела, АТГСК. Как уже упоминалось выше, пациенты с POEMS-синдромом с тяжелым неврологическим дефицитом требуют особого подхода в подборе терапии. Такие препараты, как талидомид и бортезомиб, использующиеся в лечении POEMS-синдрома, обладают доказанным нейротоксическим действием и усугубляют течение полинейропатии у таких пациентов [1, 18]. У нашего пациента в клинической картине основным инвалидизирующим синдромом была полинейропатия с выраженным тетрапарезом, поэтому совместно с врачом-гематологом было принято решение о дальнейшей тактике лечения пациента с использованием препаратов с минимальным нейротоксическим действием (леналидомид, дексаметазон). Такой терапевтический подход в подобных ситуациях представлен в результатах клинических исследований по POEMS-синдрому [19, 20].
Заключение
Таким образом, своевременная диагностика POEMS-синдрома у пациентов с воспалительной полинейропатией позволяет определить тактику ведения больного и улучшить прогноз заболевания. Врач-невролог при проведении дифференциального диагноза должен руководствоваться «красными флагами», сигнализирующими о, возможно, имеющемся у пациента POEMS-синдроме. Особенно важно принимать во внимание те особенности клинической картины и анамнеза заболевания, которые имеются на ранней стадии заболевания, еще до развернутой клинической картины синдрома. Ранняя постановка диа-гноза до развития тяжелого неврологического дефицита и системного поражения позволяет подобрать оптимальный метод лечения и предотвратить инвалидизацию пациента. Мультидисциплинарный подход в виде тесного сотрудничества врачей разных специальностей (неврологов, гематологов, рентгенологов) является, несомненно, важным при проведении обследования пациента с атипичными диз-иммунными полинейропатиями, в том числе POEMS-синдромом, и дальнейшем наблюдении за ним по мере прохождения специфического лечения.
Сведения об авторах:
Коротаева Виктория Вадимовна — клинический ординатор 2-го года обучения кафедры неврологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-1255-2972.
Кушнир Яна Богдановна — врач-невролог 1-го неврологического отделения клиники НИИ неврологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0001-7891-9883.
Кудяшева Ольга Викентьевна — врач-гематолог клиники НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0001-5517-7741.
Полушин Алексей Юрьевич — к.м.н., ассистент кафедры неврологии, руководитель блока химиотерапии и трансплантации стволовых клеток при онкологических и аутоиммунных заболеваниях ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0001-8699-2482.
Краснов Владимир Сергеевич — к.м.н., доцент кафедры неврологии, врач-невролог приемного отделения ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-9769-447X.
Контактная информация: Коротаева Виктория Вадимовна, e-mail: victorykorotaeva@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.05.2022.
Поступила после рецензирования 09.06.2022. Принята в печать 05.07.2022.
About the authors:
Victoria V. Korotaeva — second-year resident of the Department of Neurology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-1255-2972.
Yana B. Kushnir — neurologist of the 1st Neurological Department, Clinic of the Research Institute of Neurology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-7891-9883.
Olga V. Kudyasheva — hematologist, Clinic of the R.M. Gorbacheva Research Institute of Children Oncology, Hematology and Transplantation, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-5517-7741.
Alexey Yu. Polushin — C. Sc. (Med.), Assistant Professor of the Department of Neurology, Head of the Department of Chemotherapy and Stem Cell Transplantation for Cancer and Autoimmune Diseases, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-8699-2482.
Vladimir S. Krasnov — C. Sc. (Med.), Associate Professor of the Department of Neurology, neurologist of the admission department, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-9769-447X.
Contact information: Victoria V. Korotaeva, e-mail: victorykorotaeva@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 17.05.2022.
Revised 09.06.2022.
Accepted 05.07.2022.
Информация с rmj.ru
