Введение
Одной из ведущих причин потери центрального зрения и инвалидности по зрению у взрослого населения развитых стран является возрастная макулярная дегенерация (ВМД) [1, 2]. Необходимо отметить, что более 80% случаев потери зрения при ВМД отмечаются в результате формирования хориоидальной неоваскуляризации (ХНВ) и ее последствий, а именно: экссудации, ретинальных геморрагий и дисциформных рубцов [3, 4]. В настоящее время доказана ведущая роль нарушений регуляции эндотелиального сосудистого фактора роста (vascular endothelial growth factor, VEGF) в патогенезе неоваскулярной ВМД (нВМД) [5, 6].
Современные успехи в лечении нВМД обусловлены, прежде всего, активным использованием лекарственных средств, подавляющих неоангиогенез. Первым препаратом, зарегистрированным в 2008 г. в РФ для анти-VEGF-терапии нВМД, был ранибизумаб [6–8]. Данный препарат является антигенсвязывающим Fab-фрагментом гуманизированного рекомбинантного моноклонального антитела, воздействующего на все изоформы VEGF-A. Низкая молекулярная масса ранибизумаба, составляющая 48 кДа, обеспечивает его хорошее проникновение через ретинальные слои для взаимодействия с рецепторами VEGF новообразованных сосудов [9].
Но с наработкой клинического опыта оказалось, что у ряда пациентов имеется резистентность или тахифилаксия к данному препарату. Причем их доля в общей совокупности пациентов с нВМД достаточно высока: от 10% до 50% [10–13].
Позже был разработан другой препарат для лечения нВМД — афлиберцепт с молекулярной массой 97 кДа. Он был зарегистрирован в РФ в 2016 г. Афлиберцепт представляет собой полностью человеческий гибридный белок — «рецептор-ловушку», специально разработанный для антиангиогенной терапии [14–16]. Его молекула состоит из VEGF-связывающих доменов VEGFR1 и VEGFR2, соединенных с Fc-фрагментом человеческого иммуноглобулина G. Преимуществом афлиберцепта в сравнении с ранибизумабом является его способность образовывать очень стабильную инертную связку с иммунными комплексами VEGF-A, характеризующуюся высокой аффинностью, строго в соотношении 1:1 [14, 15]. Кроме того, афлиберцепт обладает возможностью связывания плацентарного фактора роста (PIGF), играющего важную роль в патогенезе формирования неоваскуляризации [17–19].
Однако, несмотря на все преимущества афлиберцепта, при его использовании были выявлены отдельные случаи формирования хориоретинальной атрофии [20–22]. В связи с этим поиски наиболее эффективного и безопасного метода лечения нВМД по-прежнему остаются актуальными.
Новым ингибитором ангиогенеза стал недавно появившийся в клинической практике препарат бролуцизумаб (Визкью®, Novartis Pharma AG, Швейцария). Структурной основой бролуцизумаба является гуманизированный одноцепочечный фрагмент антитела с намного меньшей молекулярной массой (~26 кДа) в сравнении как с ранибизумабом, так и с афлиберцептом. Эти свойства позволяют ему успешно ингибировать связывание VEGF-A с рецепторами VEGFR1 и VEGFR2. По данным мультицентровых исследований HAWK и HARRIER, клиническая эффективность бролуцизумаба при достижении редукции интраретинальной и субретинальной жидкости оказалась значительно выше таковой у афлиберцепта (до 30% и более) [23].
В РФ бролуцизумаб был зарегистрирован для применения при нВМД в ноябре 2020 г. В Хабаровском филиале ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России мы стали использовать бролуцизумаб при лечении нВМД с декабря 2021 г. В связи с единичными российскими публикациями об использования бролуцизумаба при нВМД [24] мы сочли целесообразным представить свои первые результаты применения данного препарата.
Цель исследования: провести анализ непосредственной клинической эффективности применения препарата бролуцизумаб (Визкью®) при ХНВ у пациентов с ВМД.
Содержание статьи
Материал и методы
В исследовании приняли участие 25 пациентов (25 глаз) с нВМД. Среди них было 13 женщин, 12 мужчин. Критериями включения в исследование явились: наличие активной ХНВ, отсутствие какой-либо проводимой ранее антиангиогенной терапии. Критерии невключения: наличие в анамнезе ранее проводимой антиангио-генной терапии.
Исследование проводилось в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki — Ethical Principles for Medical Research Involving Human Subjects, 2013). Перед выполнением исследования у всех пациентов получено письменное информированное согласие.
Всем пациентам помимо стандартных методов исследования выполнялась оптическая когерентная томография (ОКТ) на приборе RS-3000 Advance2 (NIDEK, Япония). В режиме ангиографии (ангио-ОКТ) выяснялась локализация и площадь неоваскулярного комплекса, плотность и толщина новообразованных сосудов, разветвленность и перфузируемость субретинальной неоваскулярной мембраны, оценивалась их динамика после лечения. Кроме того, проводилась оценка светочувствительности сетчатки с помощью микропериметрии Maia (CenterVue, Италия).
Всем пациентам выполнялись интраокулярные инъекции Визкью® по стандартной загрузочной схеме — 3 ежемесячные инъекции. Все они выполнялись одним хирургом в условиях стерильной операционной в соответствии с инструкцией по медицинскому применению лекарственного средства (в дозе 6,0 мг / 0,05 мл).
Критерием эффективности лечения считалась положительная динамика следующих показателей: МКОЗ, ЦТС в мкм, объем макулы (ОМ) в мм3. Диагностическое обследование проводили исходно и после каждой из 3 инъекций бролуцизумаба. Срок наблюдения составил 4 мес.
Статистическая обработка данных выполнялась с использованием программы статистического анализа R версии 4.1.2. Нормальность распределений проверялась критерием Шапиро — Уилка. Нормально распределенные данные представлены в виде M±σ, где M — среднее значение, σ — стандартное отклонение. Данные, отличные от нормальных, представлены в виде Me (Q25; Q75), где Me — медиана, Q25, Q75 — 25-й и 75-й квантили соответственно. Для сравнения количественных показателей использовался модифицированный критерий суммы рангов Уилкоксона. Корректировка p-значений на множественные сравнения осуществлялась функцией p.adjust по методу Холма. Отличия считались значимыми при p<0,001.
Результаты исследования
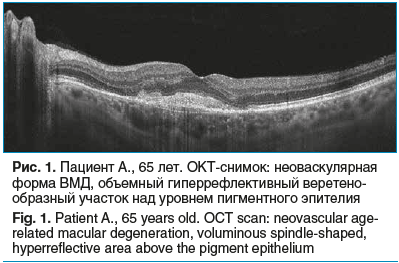
Средний возраст пациентов составил 68±5 лет (от 58 до 74 лет). При офтальмоскопии в 15 глазах исходно парафовеолярно определялись типичные офтальмоскопические признаки неоваскулярной ВМД: субретинальный серо-зеленый очаг ХНВ, множественные «твердые» друзы, ретинальные единичные множественные геморрагии. На снимках ОКТ определялось наличие объемного гиперрефлективного веретенообразного участка над уровнем пигментного эпителия (рис. 1). По данным ангио-ОКТ, во всех 15 глазах имела место петлевидная сосудистая сеть различной интенсивности в зоне, соответствующей на снимке веретенообразному участку.
Кроме того, в 5 глазах в макулярной зоне определялась экссудативная отслойка нейроэпителия площадью от 1,5 до 2 диаметров диска зрительного нерва с неоднородным гиперрефлективным содержимым. По данным ангио-ОКТ, в этих 5 глазах наблюдалась петлевидная сосудистая сеть с многочисленными ответвлениями.
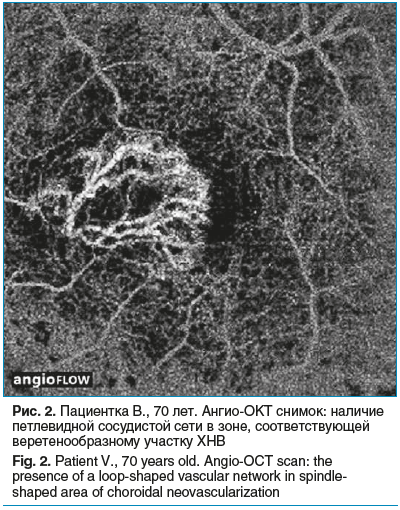
Еще у 5 пациентов при офтальмоскопии визуализировалась субретинальная геморрагия в макулярной области, друзы и атрофия пигментного эпителия. Согласно данным ОКТ в них определялась отслойка пигментного эпителия с гиперрефлективным содержимым. Ангио-ОКТ позволила выявить наличие петлевидной сосудистой сети в зоне, которая соответствует на снимке ОКТ веретенообразному участку (рис. 2).
Исходные показатели и их динамика на фоне лечения представлены в таблице.
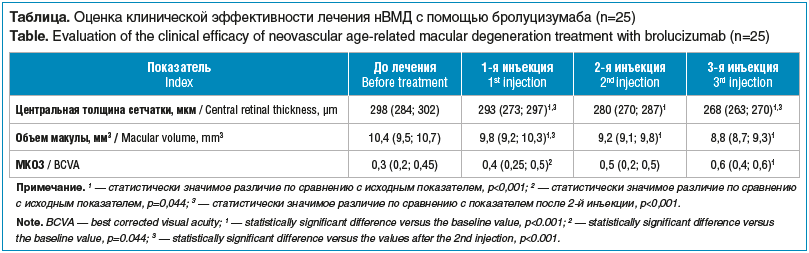
Как видно из таблицы, после 1-й инъекции бролуцизумаба наблюдалось статистически значимое снижение средних показателей ЦТС и ОМ относительно исходных данных (p<0,001). При этом наблюдалось повышение МКОЗ. После каждой инъекции регистрировали уменьшение ЦТС и ОМ и повышение МКОЗ. После 3-й инъекции исследуемого препарата отмечали статистически значимое снижение ЦТС и ОМ и повышение МКОЗ по сравнению с исходными показателями (p<0,001).
Лишь у 1 пациентки 72 лет с нВМД после 1-й инъекции произошло снижение МКОЗ с 0,1 до 0,05. При этом отмечено умеренное увеличение показателя ЦТС с 294 до 300 мкм. После 2-й инъекции данные значения показателя ЦТС сохранялись на прежнем уровне и составляли 300 мкм. Лишь после 3-й инъекции бролуцизумаба произошло снижение показателя ЦТС до 270 мкм. При этом отмечено повышение МКОЗ с 0,05 до 0,2.
Компьютерная микропериметрия макулярной зоны у всех пациентов до проведения курсов лечения регистрировала снижение световой чувствительности в среднем на 10 дБ. На фоне анти-VEGF-терапии изменения световой чувствительности были незначительны и колебались в среднем на 2,5 дБ, что не являлось статистически значимым для оценки результатов лечения и планирования дальнейшей тактики.
Уже через 1 мес. после 1-й инъекции у 22 из 25 пациентов регистрировалось прилегание нейро- и пигментного эпителия с полной резорбцией субретинальной жидкости. У 3 пациентов полная редукция отслойки нейро- или пигментного эпителия произошла только после 3 ежемесячных интравитреальных инъекций исследуемого препарата, при этом субретинальная жидкость у них не регистрировалась.
Субъективно все пациенты отмечали улучшение качества и контрастности центрального зрения в оперированных глазах.
Обсуждение
Проблема эффективного лечения неоваскулярной формы ВМД является одной из наиболее актуальных в клинической офтальмологии. Это обусловлено высокой степенью снижения зрительных функций и распространенностью данной патологии. В клинической практике широко применяются препараты, относящиеся к фармакологической группе ингибиторов VEGF, — ранибизумаб, афлиберцепт. Новый препарат Визкью® представляет собой инновационную молекулу с уникальным строением, специально разработанную для лучшего контроля нВМД [23]. Данный препарат превосходит афлиберцепт и ранибизумаб в достижении стабильного контроля активности нВМД на протяжении 2 лет [23, 25]. Согласно данным многоцентровых исследований использование этого препарата позволяет устойчиво контролировать заболевание при более длительных интервалах между инъекциями, что потенциально повышает комплаентность пациента [26].
В приведенном исследовании на небольшом клиническом материале мы проследили динамику изменений основных показателей, характеризующих нВМД, — ЦТС, ОМ, МКОЗ при стандартном загрузочном введении бролуцизумаба (3 последовательные инъекции). Практически во всех случаях после каждой инъекции отмечалось постепенное статистически значимое улучшение исследуемых показателей. При этом значения МКОЗ обнаруживали четкую тенденцию к повышению. Полученные нами данные полностью согласуются с аналогичными данными зарубежных авторов [25, 27].
В проведенном нами исследовании не отмечено каких-либо воспалительных реакций глаз. По данным исследований, их частота в реальной клинической практике может составлять около 2,4% [28]. Ограничениями нашего исследования являются небольшое число включенных случаев и короткий срок наблюдения, однако все пациенты получили обследование с помощью методов мультимодальной диагностики, и мы можем рассчитывать, что ни один, даже самый легкий, случай внутриглазного воспаления не был пропущен.
Выводы
Клинические результаты проведения 3 стандартных загрузочных инъекций нового препарата Визкью® при лечении нВМД показали, что после каждой инъекции отмечалась прогрессирующая статистически значимая редукция основных морфометрических показателей макулярной области — ЦТС и ОМ. Это сочеталось с повышением средних значений МКОЗ к 4-му месяцу наблюдения.
Для более глубоких заключений о степени эффективности данного препарата требуются долгосрочные наблюдения на большом клиническом материале. Однако уже сейчас предварительные данные позволяют говорить о хорошей эффективности данного препарата.
Сведения об авторах:
Жайворонок Наталья Сергеевна — врач-офтальмолог отделения комплексно-реабилитационного лечения Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; ORCID iD 0000-0001-5515-4099.
Коленко Олег Владимирович — д.м.н., директор Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; заведующий кафедрой офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения»; 680000, Россия, г. Хабаровск, ул. Краснодарская, д. 9; профессор кафедры общей и клинической хирургии ФГБОУ ВО ДВГМУ Минздрава России; 680000, Россия, г. Хабаровск, ул. Муравьева-Амурского, д. 35; ORCID iD 0000-0001-7501-5571.
Данилова Любовь Петровна — заведующая отделением комплексно-реабилитационного лечения, врач-офтальмолог Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; ассистент кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения»; 680000, Россия, г. Хабаровск, ул. Краснодарская, д. 9; ORCID iD 0000-0003-0665-1755.
Сорокин Евгений Леонидович — д.м.н., профессор, заместитель директора по научной работе Хабаровского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова»; 680033, Россия, г. Хабаровск, ул. Тихоокеанская, д. 211; профессор кафедры общей и клинической хирургии ФГБОУ ВО ДВГМУ Минздрава России; 680000, Россия, г. Хабаровск, ул. Муравьева-Амурского, д. 35; ORCID iD 0000‑0002-2028-1140.
Контактная информация: Жайворонок Наталья Сергеевна, e-mail: naukakhvmntk@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 22.08.2022.
Поступила после рецензирования 14.09.2022.
Принята в печать 07.10.2022.
About the authors:
Natal’ya S. Zhayvoronok — ophthalmologist of the Department of Complex Rehabilitation Treatment, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; ORCID iD 0000-0001-5515-4099.
Oleg V. Kolenko — Dr. Sc. (Med.), Director, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; Head of the Department of Ophthalmology, Institute of Advanced Training of Healthcare Specialists; 9, Krasnodarskaya str., Khabarovsk, 680000, Russian Federation; Professor of the Department of General and Clinical Surgery, Far Eastern State Medical University; 35, Murav’ev-Amurskiy str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000-0001-7501-5571.
Lyubov’ P. Danilova — Head of the Department of Complex Rehabilitation Treatment, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; assistant of the Department of Ophthalmology, Institute of Advanced Training of Healthcare Specialists; 9, Krasnodarskaya str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000-0003-0665-1755.
Evgeniy L. Sorokin — Dr. Sc. (Med.), Professor, Deputy Director for Research, Khabarovsk Branch of the S. Fedorov Eye Microsurgery Federal State Institution; 211, Tikhookeanskaya str., Khabarovsk, 680033, Russian Federation; Professor of the Department of General and Clinical Surgery, Far Eastern State Medical University; 35, Murav’ev-Amurskiy str., Khabarovsk, 680000, Russian Federation; ORCID iD 0000‑0002-2028-1140. Contact information: Natal’ya S. Zhayvoronok, e-mail: naukakhvmntk@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 22.08.2022.
Revised 14.09.2022.
Accepted 07.10.2022.
Информация с rmj.ru
