Содержание статьи
Введение
В структуре злокачественных новообразований рак желудка занимает пятое место во всем мире по распространенности с общей заболеваемостью 13,5 на 100 тыс. населения и третье место по смертности. По данным Международного агентства по изучению рака, в мире каждый год выявляют 900 тыс. новых случаев рака желудка и регистрируют около 650 тыс. смертей от данного заболевания. В РФ рак желудка занимает третье место в структуре онкологических заболеваний и чаще возникает у мужчин (15,8% против 12,4% у женщин). Онкологические результаты хирургического лечения, как самостоятельного, так и в составе комбинированного лечения, пока остаются неудовлетворительными, что связано с отсутствием скрининговых программ, обращаемостью пациентов на более поздних стадиях заболевания на фоне скрытого течения онкопроцесса (выявляемость в РФ на III–IV стадии составляет более 60%) [1]. Данная проблема не менее актуальна и в странах с развитой системой диагностики и скрининга [2].
В последнее время малоинвазивные, в том числе робот-ассистированные, технологии все более активно применяются в хирургическом лечении онкоурологической, онкогинекологической патологии, а также при онкопатологии органов желудочно-кишечного тракта (ЖКТ) [3].
Несмотря на более чем 20-летний опыт использования робот-ассистированных технологий в хирургии рака желудка с момента первого применения в 2001–2002 гг. M. Hashizume [4] и P.C. Giulianotti [5], данная методика пока не нашла отражения ни в одних клинических рекомендациях. Ряд крупных метаанализов, основанных, как правило, на одноцентровых нерандомизированных исследованиях, показали возможность, безопасность и онкологическую адекватность применения роботического комплекса в оказании хирургической помощи больным раком желудка [6]. Последний крупнейший метаанализ [7] включил 48 ретроспективных исследований, в основном из стран Азии (Южная Корея, Япония, Китай, Тайвань), а также из Италии, сравнивающих лапароскопические и робот-ассиcтированные оперативные вмешательства при различных локализациях рака желудка (общее количество пациентов составило 20 151, из них у 6175 была выполнена робот-ассисистированная гастрэктомия, у 13 976 — лапароскопическая). При анализе получены статистически значимые (р<0,05) различия по некоторым показателям. При робот-ассистированной гастрэктомии по сравнению с лапароскопической отмечены сравнительно большая продолжительность оперативного вмешательства (средневзвешенная разница (СВР) 35,72, 95% доверительный интервал (ДИ) 28,59–42,86), меньшая интраоперационная кровопотеря (СВР -21,93, 95% ДИ от -28,94 до -14,91), меньшие сроки госпитализации (СВР -0,54, 95% ДИ от -0,83 до -0,24), время до начала перорального питания (СВР -0,20, 95% ДИ от -0,29 до -0,10), отмечено значимое увеличение количества удаленных лимфатических узлов при лимфаденэктомии во время робот-ассистированных вмешательств (СВР 2,81, 95% ДИ 1,99–3,63). Статистически значимых различий в частоте послеоперационных осложнений, R0-резекций, послеоперационной летальности, частоте конверсий и 3-летней общей выживаемости при сравнении робот-ассистированных и лапароскопических оперативных вмешательств при раке желудка отмечено не было (р>0,05).
В настоящее время крайне мало опубликованных данных крупных рандомизированных клинических исследований сравнительного анализа применения робот-ассистированных технологий в хирургическом лечении рака желудка [8–10]. В одной из немногих таких работ [11] на примере оперативных вмешательств, выполненных у 283 пациентов (робот-ассистированная дистальная гастрэктомия — 141, лапароскопическая — 142), было установлено, что робот-ассистированные вмешательства при дистальном раке желудка связаны с более низкой частотой послеоперационных осложнений, меньшей выраженностью системной воспалительной реакции, лучшим качеством лимфаденэктомии, меньшим сроком пребывания в стационаре и более быстрым восстановлением функционального состояния ЖКТ.
Опыт применения роботического хирургического комплекса при хирургическом лечении рака желудка, по данным аналитического отдела компании Intuitive Surgical (Analytic department of Intuitive Surgical company, 2022), в нашей стране ограничен не более чем 300 случаями. Публикации по данной теме в отечественной литературе имеют единичный характер [12].
Цель исследования: анализ и обобщение полученного опыта выполнения робот-ассистированных оперативных вмешательств при раке желудка и демонстрация непосредственных хирургических результатов.
Материал и методы
В период с 2018 по 2022 г. в СПб ГБУЗ «Городская больница № 40» с использованием робот-ассистированных технологий было прооперировано 111 больных раком желудка, из них 60 (54,1%) мужчин, в возрасте от 33 до 78 лет. Доля пациентов с ожирением (индекс массы тела (ИМТ) ≥30 кг/м2) составила 39,2%.
Все больные были обследованы согласно стандартам стадирования, включая диагностическую лапароскопию, дополненную цитологическим анализом перитонеальных смывов на наличие свободных опухолевых клеток. Проводилась оценка соматического, нутритивного статусов (по шкале NRS-2002) и рисков операции и анестезии согласно шкале ASA (The American Society of Anesthesiologists). Для оценки коморбидного фона применяли индекс коморбидности Charlson (табл. 1).
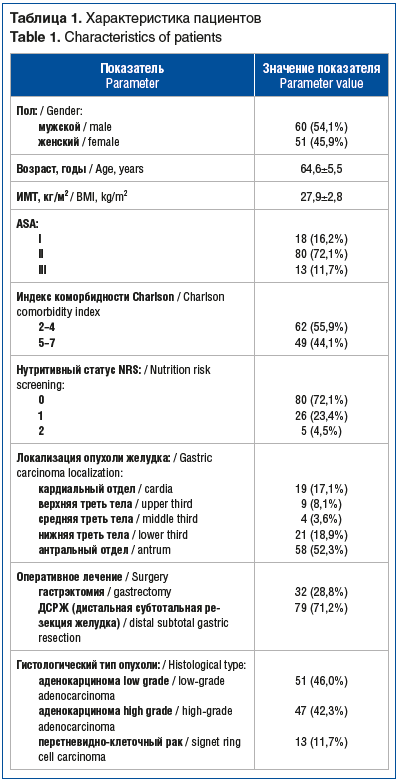
Низкий нутритивный статус у 5 пациентов потребовал проведения дополнительной коррекции в предоперационном периоде.
Всем пациентам выполнены робот-ассистированные операции по технике, подробно описанной ранее [13].
При расположении опухоли в средней и нижней трети тела желудка выполняли предельно субтотальную дистальную резекцию желудка (ДСРЖ), при опухоли в верхней трети тела и кардии — гастрэктомию. Пять (4,5%) ДСРЖ было выполнено с анастомозом по Бильрот I, 74 (66,7%) — по Бильрот II с интракорпоральным межкишечным анастомозом по Брауну. При выполнении гастрэктомий во всех случаях формировали анастомоз при помощи линейного сшивающего аппарата на отключенной по Ру петле с интракорпоральным межкишечным анастомозом.
По данным предоперационного инструментального обследования, включающего стадирующую диагностическую лапароскопию, распределение пациентов по стадиям было следующим: I стадия — 7 (6,3%), II — 60 (54,1%), III — 43 (38,7%), IV — 1 (0,9%). В рамках периоперационной комбинированной лекарственной терапии у 42 (37,8%) пациентов проводилась неоадъювантная полихимиотерапия по схемам FLOT (n=31) и mFOLFOX6 (n=11). В результате в ряде случаев отмечен значимый регресс опухолевого процесса. Распределение по стадиям по результатам послеоперационного гистологического исследования, согласно 8-му изданию классификации TNM (2017 г., UICC): IA — 27 (24,3%), IB — 17 (15,3%), IIA — 19 (17,1%), IIB — 13 (11,7%), IIIA — 18 (16,2%), IIIB — 13 (11,7%), IIIC — 4 (3,6%). Общее число пациентов с III стадией заболевания составило 35 (31,5%). В 1 случае опухоль желудка была стадирована по TNM как М1 в связи с наличием в перитонеальных смывах атипичных клеток. Данному пациенту было проведено 4 цикла по схеме FLOT, при контрольном обследовании и рестадировании отмечен значительный регресс опухоли и отсутствие свободных опухолевых клеток при повторном цитологическом анализе перитонеальных смывов, в связи с чем пациенту выполнено оперативное вмешательство в объеме ДСРЖ, и при гистологическом исследовании операционного материала отмечен полный регресс. У 5 пациентов отмечена инвазия опухоли в соседние органы и ткани (Т4b): в 2 (1,8%) наблюдениях опухоль распространялась на капсулу поджелудочной железы, по 1 (0,9%) случаю — на левую долю печени, брыжейку поперечной ободочной кишки и ножку диафрагмы.
Лимфаденэктомия, варианты анатомии по N. Michels, ICG-картирование. Всем пациентам выполнена стандартная D2-лимфаденэктомия [14] с удалением 1, 3, 4sb, 4d, 5, 6, 7, 8а, 9, 11р, 12а групп лимфатических узлов при ДСРЖ и 1, 2, 3, 4sa, 4sb. 4d, 5, 6, 7, 8а, 9, 11р, 11d, 12а — при тотальной гастрэктомии, за исключением 4 пациентов в возрасте 78–80 лет с индексом коморбидности Charlson 6–7, которым выполнена лимфаденэктомия в объеме D1+. У 24 пациентов стандартная D2-лимфаденэктомия дополнена удалением 8р и 12р групп лимфатических узлов в связи с выявленной лимфаденопатией указанных групп по данным контрастной компьютерной томографии на догоспитальном этапе и подтвержденной интраоперационно. У 9 пациентов при анализе КТ-сканов в артериальной фазе сканирования определен и подтвержден интраоперационно II тип ветвления артерий чревного ствола по N. Michels, что потребовало выделения и сохранения левой печеночной артерии, с обязательным выполнением лимфаденэктомии 7 и 9 групп лимфатических узлов. В 1 случае был выявлен IX тип ветвления по N. Michels с отхождением общей печеночной артерии от верхней брыжеечной артерии. В процессе проведения дополненной интраоперационной ICG-навигации в 7 случаях выявлено контрастирование лимфатических узлов 14 группы, что потребовало их мобилизации, удаления с последующей маркировкой. При дальнейшем морфологическом исследовании данных лимфатических узлов в 2 случаях отмечены признаки опухолевого роста, что позволило уточнить стадию заболевания и объем комбинированной терапии.
Для статистического анализа использовали программы Exel 365 (Microsoft) и SPSS Statistics Version 26 (IBM). Количественные данные были обобщены и представлены в виде среднего арифметического взвешенного со среднеквадратичной ошибкой (M±m) для нормально распределенных величин, в виде квартильных оценок (Me [Q1; Q3]) для ненормально распределенных величин, качественные — в виде абсолютных значений и долей (%). Для определения нормальности выборки применяли тест Шапиро — Уилка.
Результаты исследования
Всего выполнено 79 дистальных субтотальных резекций желудка и 32 гастрэктомии. Расширенные вмешательства были выполнены у 5 пациентов: резекция брыжейки поперечной ободочной кишки, атипичная резекция S3 левой доли печени, резекция правой ножки диафрагмы, в 2 случаях — резекция капсулы поджелудочной железы. Конверсия доступа потребовалась при выполнении дистальной субтотальной резекции, в первом случае — в связи с выраженным ожирением пациента (ИМТ 39,8 кг/м2), во втором — в связи с врастанием опухоли в капсулу поджелудочной железы и выраженной опухолевой инфильтрацией вдоль селезеночной артерии. Причиной единственного летального исхода в раннем послеоперационном периоде было ОНМК по ишемическому типу у пациента после гастрэктомии с выраженным системным атеросклерозом и исходной дисциркуляторной энцефалопатией.
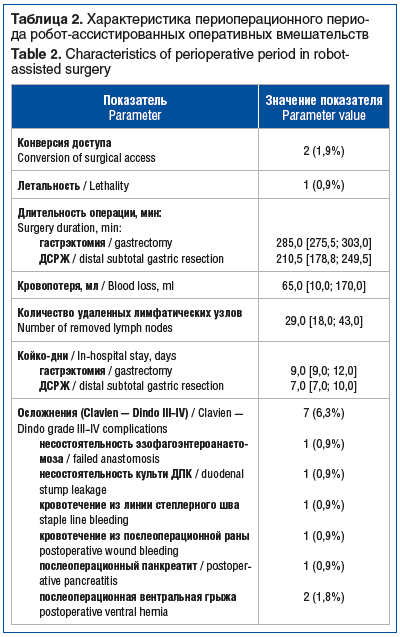
Основные показатели периоперационного периода представлены в таблице 2. Ни в одном наблюдении не потребовалась интраоперационная гемотрансфузия. Среди интраоперационных осложнений по R. Rosenthal в 3 случаях отмечены осложнения I степени, в 1 случае — II степени, не повлиявшие на ход оперативного вмешательства. В послеоперационном периоде ни в одном случае не потребовалось назначения наркотических анальгетиков. Активизацию пациентов начинали на вторые сутки после операции, пероральное питание сиппинговыми белковыми смесями проводилось со вторых суток. Активная перистальтика кишечника, отхождение газов отмечались со вторых-третьих суток.
При гистологическом исследовании у всех больных в краях резекции опухолевого роста выявлено не было (R0). В 24 (21,7%) случаях верифицирован кишечный тип опухоли по Lauren, в 58 (52,2%) — диффузный, в 29 (32%) — смешанный тип.
Для оценки осложнений в раннем послеоперационном периоде применяли шкалу Clavien — Dindo. В 7 (6,3%) случаях были зарегистрированы осложнения III–IV класса (см. табл. 2). Развившиеся в раннем послеоперационном периоде кровотечения потребовали релапароскопии и остановки путем прошивания. Несостоятельность эзофагоэнтероанастомоза удалось купировать консервативными мероприятиями — вакуумным внутрипросветным дренированием. Несостоятельность культи ДПК также удалось купировать консервативно путем длительного дренирования и формирования наружного свища с коррекцией антибактериальной терапии. Послеоперационный панкреатит возник у пациента, перенесшего резекцию капсулы поджелудочной железы в области опухолевой инвазии, купирован продленным дренированием с коррекцией противовоспалительной терапии. Послеоперационные вентральные грыжи в области срединного мини-лапаротомного разреза в позднем послеоперационном периоде потребовали планового оперативного лечения.
Среди осложнений I–II классов был отмечен рефлюкс-гастрит в 3 случаях после резекций желудка по Бильрот I, который был купирован через 6–9 мес.
Кривая обучения
Все вышеописанные робот-ассистированные оперативные вмешательства проводились тремя хирургами, имеющими многолетний опыт выполнения открытых и лапароскопических операций при раке желудка и открытых, лапароскопических и робот-ассистированных операций при колоректальном раке. Показателями выхода на «плато» кривой обучения при разработке и внедрении робот-ассистированных вмешательств при раке желудка считали сокращение продолжительности докинга до 12–15 мин и общую продолжительность оперативного вмешательства при условии стандартной анатомии и отсутствии инвазии опухоли в окружающие органы и ткани, сопоставимую с продолжительностью лапароскопического вмешательства. Данные показатели были достигнуты после выполнения 10–15 операций.
Обсуждение
Наши клинические данные подтверждают общемировой опыт возможности выполнения робот-ассистированных оперативных вмешательств при раке желудка с минимальным числом интра- и послеоперационных осложнений, которые имели место, как правило, у пожилых пациентов с выраженной сопутствующей патологией, ожирением и исходным местно-распространенным опухолевым процессом [15, 16]. Проводя сравнительный анализ наших непосредственных результатов с зарубежными данными, можно отметить сопоставимость полученных показателей: объема интраоперационной кровопотери, времени оперативного вмешательства, числа удаленных лимфатических узлов и продолжительности стационарного лечения. Частота послеоперационных осложнений, по данным нашего исследования, оказался несколько ниже — 9% против 12% по данным последнего международного метаанализа. Однако при детальном анализе осложнений III–V степени относительное число несостоятельностей анастомозов, послеоперационного панкреатита и летальности оказалось выше — 1,8, 0,9 и 0,9% соответственно по сравнению с 0,6, 0,6 и 0,4% в зарубежных исследованиях. Полученные различия могут быть обусловлены относительно небольшой выборкой [7, 15]. У пациентов, прошедших циклы неоадъювантной полихимиотерапии во время оперативного вмешательства, было отмечено более выраженное фиброзирование межфасциальных слоев на фоне местного воспалительного ответа, что затрудняло его визуализацию и повышало контактную кровоточивость тканей. Однако значимых различий в частоте послеоперационных осложнений, в качестве лимфаденэктомии в этой группе больных отмечено не было. Робот-ассистированные оперативные вмешательства у представленной группы пациентов позволили реализовать все преимущества малоинвазивных технологий: хороший косметический эффект, низкой степени выраженности болевой синдром, не потребовавший применения наркотических анальгетиков в послеоперационном периоде. Это способствовало ранней активизации пациентов, отсутствию развития тромбоэмболических осложнений, раннему началу перорального питания и восстановления функции ЖКТ. Короткий восстановительный период позволил начать проведение адъювантной лекарственной терапии у определенной категории пациентов в более ранние сроки. Отдаленные онкологические результаты в данной работе оценены не были, однако на основании выполненного объема лимфаденэктомии, выполнения резекций R0 в 100% случаев можно предположить, что при применении робот-ассистированной технологии они будут сопоставимы с результатами открытых оперативных вмешательств. К ограничениям настоящего исследования можно отнести отсутствие групп сравнения с лапароскопическими и открытыми оперативными вмешательствами при раке желудка различных локализаций, а также анализ отдаленных онкологических результатов (пятилетней общей и безрецидивной выживаемости). Планируется сбор и ретроспективный анализ данных с подготовкой к последующим публикациям.
Заключение
Оперативные вмешательства при раке желудка с использованием роботического хирургического комплекса привлекают своей технологичностью. Однако, несмотря на многолетний мировой опыт применения данной методики, нет четких данных, отраженных в клинических рекомендациях по ее использованию у той или иной категории больных в зависимости от локализации, размеров, стадии заболевания и других характеристик. Ориентируясь на наш собственный клинический опыт, можно рекомендовать использование роботического комплекса при локализованном раке желудка любой локализации без распространения на пищевод и ДПК стадии Т1–3 у пациентов любого пола и возраста с ИМТ не более 30 кг/м2 и степенью риска операции и анестезии по шкале ASA не более III. Однако технические преимущества данного комплекса могут быть реализованы в большей степени и при местно-распространенном онкопроцессе. Для получения достоверных данных требуется проведение многоцентровых рандомизированных клинических исследований.
Сведения об авторах:
Коваленко Сергей Алексеевич — врач-онколог, заведующий отделением абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000- 0002-5850-0599.
Гладышев Дмитрий Владимирович — д.м.н., заместитель главного врача по хирургии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; доцент кафедры госпитальной хирургии Военно-медицинской академии имени С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6Ж; ORCID iD 0000-0001-5318-2619.
Моисеев Михаил Евгеньевич — врач-онколог отделения абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0002-6180-6695.
Ветошкин Вячеслав Андреевич — врач-хирург операционного отделения для противошоковых мероприятий СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0000-0001-5346-9257.
Свитич Вадим Юрьевич — врач-онколог отделения абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0009-0002-2293-0527.
Гнедаш Сергей Сергеевич — врач-онколог отделения абдоминальной онкологии СПб ГБУЗ «Городская больница № 40»; 197706, Россия, г. Санкт-Петербург, г. Сестрорецк, ул. Борисова, д. 9; ORCID iD 0009-0003-4743-3014.
Контактная информация: Коваленко Сергей Алексеевич, e-mail: kowalenko78@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.02.2023.
Поступила после рецензирования 23.03.2023.
Принята в печать 17.04.2023.
About the authors:
Sergey A. Kovalenko — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-5850-0599.
Dmitry V. Gladyshev — Dr. Sc. (Med.), Deputy Chief Medical Officer of Surgery, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; Associate Professor of the Department of Hospital Surgery of the S.M. Kirov Military Medical Academy; 6 Zh, Lebedeva str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5318-2619.
Mikhail E. Moiseev — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000-0002-6180-6695.
Vyacheslav A. Vetoshkin — surgeon of the Department of Surgery for Anti-shock Measures, St. Petersburg St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0000- 0001-5346-9257.
Vadim Yu. Svitich — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0009-0002-2293-0527.
Sergey S. Gnedash — oncologist of the Department of Abdominal Oncology, St. Petersburg City Hospital No. 40; 9, Borisova str., Sestroretsk, St. Petersburg, 197706, Russian Federation; ORCID iD 0009-0003-4743-3014.
Contact information: Sergey A. Kovalenko, e-mail: kowalenko78@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.02.2023.
Revised 23.03.2023.
Accepted 17.04.2023.
Информация с rmj.ru
