Содержание статьи
Введение
Рак предстательной железы (РПЖ) — часто встречающееся злокачественное заболевание мочеполового синуса у мужчин [1–4]. Ежегодно во всем мире выявляется более 890 000 новых случаев заболевших РПЖ [5]. Заболеваемость РПЖ возросла в последние десятилетия в основном за счет активного использования тестирования на простат-специфический антиген, хотя уровень смертности от этого заболевания остается относительно стабильным в течение этого периода времени [6–9]. Среди злокачественных заболеваний у мужчин РПЖ является второй причиной смерти пациентов онкологического профиля [3]. Каждый год в мире регистрируется более 258 000 смертей от этого заболевания [5].
Заболеваемость РПЖ напрямую коррелирует с возрастом пациентов [10]. Она резко возрастает среди мужчин в возрасте 50 лет и достигает пика у мужчин старше 80 лет [11, 12]. Отягощенный семейный анамнез существенно влияет на риск развития РПЖ. Объединенные оценки риска показывают, что если у мужчины есть один родственник первой степени родства (отец или брат) с диагнозом РПЖ, то относительный риск возникновения РПЖ у этого человека составляет 2,48 (95% ДИ 2,25–2,74), повышаясь до 4,39 (95% ДИ 2,61–7,39), если таких родственников два и больше [13].
Экспериментальные и клинические данные свидетельствуют о том, что прогрессирование РПЖ зависит от ангиогенеза и лимфангиогенеза [14]. Клетки РПЖ экспрессируют индукторы ангиогенеза, фактор роста эндотелия сосудов (VEGF) и интерлейкин 8. Первые метастазы РПЖ появляются в регионарных лимфатических узлах, и количество метастазов в лимфатические узлы влияет на прогноз общей и безрецидивной выживаемости [15–18]. Метастазированию РПЖ в лимфатические узлы способствует лимфангиогенез [19]. Существуют исследования, где сообщается об ассоциации между экспрессией активаторов лимфангиогенеза, таких как VEGF-C, VEGF-D и VEGFR-3, и метастазированием в лимфатические узлы.
Вовлечение лимфатических узлов в процесс канцерогенеза, безусловно, является индикатором агрессивности многих видов рака у человека, а состояние лимфатических узлов представляет собой один из наиболее важных параметров для прогноза заболевания и терапевтических стратегий.
Цель исследования: оценить изменения в лимфатических узлах мышей при экспериментальном канцерогенезе в предстательной железе.
Материал и методы
Для создания модели канцерогенеза предстательной железы использовали 3-месячных самцов мышей линии СВА. При работе с животными соблюдали этические принципы, установленные Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 1986). Основные правила содержания и ухода за экспериментальными животными соответствовали нормативам, определенным приказом Мин-здрава России № 199н от 01.04.2016 «Об утверждении Правил надлежащей лабораторной практики».
Все животные (n=30) были разделены на 2 группы. В основную группу были включены мыши (n=15) с созданной моделью канцерогенеза простаты. Контрольную группу составили интактные мыши (n=15), с которыми манипуляции не проводились.
Для создания модели злокачественного опухолевого роста в предстательной железе мы выполнили перевивку в паренхиму простаты разведенного клеточного штамма трансплантируемой асцитной опухоли Эрлиха. Все манипуляции с животными проводили под наркозом. После перевивки опухоли все животные находились под наблюдением 18 дней. После окончания срока наблюдения животных обеих групп выводили из эксперимента. Извлекали предстательную железу и регионарные (тазовые) лимфатические узлы и фиксировали их в растворе по Теллесницкому. После стандартной гистологической проводки гистологические срезы окрашивали гематоксилином и азур II-эозином. Световую микроскопию проводили на световых микроскопах: Leica (Германия) и МБС-10 (Россия).
При изучении гистологических срезов с помощью световой микроскопии оценивали следующие морфологические структуры лимфатических узлов тазовой области: капсула, краевой и мозговой синусы, лимфоидные узелки, корковое и мозговое вещество. Также рассчитывали относительную площадь коркового и мозгового вещества, подсчитывали абсолютное количество иммунобластов и лимфоцитов в лимфатических узлах.
Статистическую обработку результатов проводили с использованием пакета программ Statistica 8.0. Описательная статистика данных проводилась с расчетом средних значений и среднеквадратичных отклонений М±σ. Для установления различий между группами использовали непараметрические критерии Краскела — Уоллиса (Н) и Манна — Уитни (U). Различия считали статистически значимыми при р≤0,05.
Результаты исследования
У мышей контрольной группы паренхима предстательной железы была представлена ацинусами, которые выстланы железистым эпителием, строма — соединительной тканью и гладкими миоцитами. У животных основной группы на момент окончания эксперимента мы наблюдали практически полное замещение железистой части простаты крупными атипичными клетками, в скудных участках стромы наблюдалась выраженная лимфоцитарная инфильтрация, что подтверждает злокачественное перерождение железы у этой группы животных.
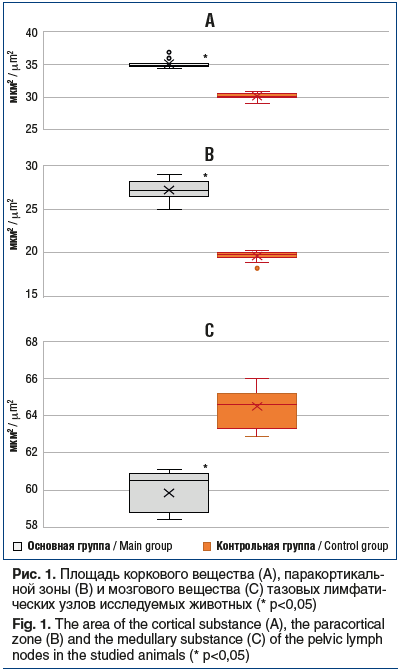
Сравнительная характеристика площади основных структурно-функциональных зон тазовых лимфатических узлов животных обеих групп представлена на рисунке 1. Мы выявили достоверные различия между экспериментальной и контрольной группами животных: средний показатель площади коркового вещества у мышей первой группы был 35,18±0,8 мкм2 и достоверно отличался от среднего показателя во второй группе — 30,1±0,83 мкм2 (p<0,05). Площадь паракортикальной зоны и мозгового вещества у животных первой группы составила 27,23±1,55 мкм2 и 59,85±1,25 мкм2 против 19,5±0,47 мкм2 и 27,23±1,55 мкм2 соответственно (p<0,05).
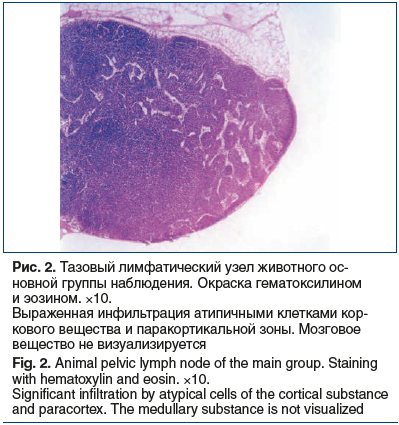
Через 2,5 нед. опухолевого роста в предстательной железе у мышей основной группы выявлена инфильтрация крупных атипичных клеток с выраженным полиморфизмом в регионарных (тазовых) лимфоузлах, особенно в области лимфатических капилляров краевого и мозгового синусов, что говорит о метастазах в регионарные лимфатические узлы (рис. 2).
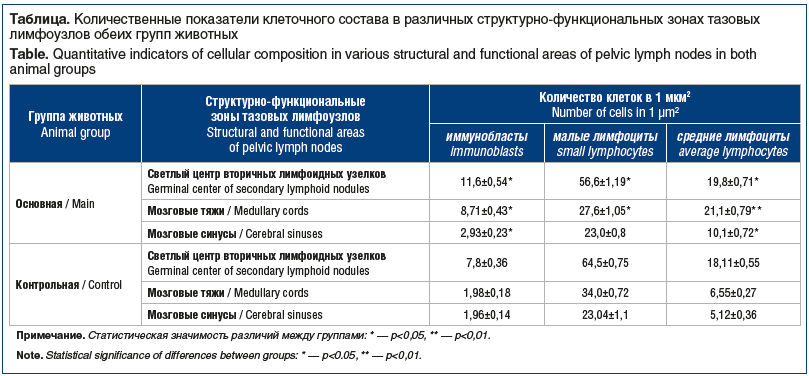
Клеточный состав самих тазовых лимфатических узлов также отличался у мышей с моделью канцерогенеза и мышей контрольной группы (см. таблицу).
Обсуждение
Миграция опухолевых клеток через стенку кровеносных и лимфатических сосудов представляет собой ключевой этап метастатического процесса при злокачественных новообразованиях. Выявление метастазов в лимфатических узлах указывает на неблагоприятный прогноз выживаемости для больных РПЖ [20]. Таким образом, выяснение лимфангиогенеза и механизма метастазирования в лимфатические узлы важно для понимания прогрессирования РПЖ, а также для разработки терапевтических вмешательств [21].
На протяжении десятилетий метастазирование через лимфатическую систему считалось пассивным процессом, в основном обусловленным естественным дренированием отслоившихся опухолевых клеток. Однако исследования последних лет показали, что опухолевые клетки и лимфатические сосуды активно взаимодействуют, что приводит к росту лимфатических сосудов (лимфангиогенезу). Это взаимодействие по-прежнему способствует доступу и последующему транспорту опухолевых клеток через лимфатические сосуды в проксимальные лимфатические узлы [22]. L. Oliveira-Ferrer et al. [23] в своем исследовании установили отрицательную корреляцию экспрессии фактора роста сосудов (VEGF-C) и лимфангиогенеза с результатами лечения пациентов со злокачественным новообразованием. Таким образом, считается, что индуцированный опухолью лимфангиогенез способствует метастазированию за счет увеличения вероятности проникновения раковых клеток во вновь образованные лимфатические капилляры. В настоящее время известно, что вещества, введенные в одну долю предстательной железы, распространяются билатерально и в регионарные лимфатические узлы с обеих сторон [24]. В исследовании C.N. Qian et al. [25] показано, что количество лимфатических узлов с метастазами значимо коррелировало с массой первичной опухоли (p=0,03) с коэффициентом корреляции 0,454.
По данным K. Stromvall et al. [24], у животных с канцерогенезом предстательной железы первые метастазы в регионарные лимфоузлы появлялись уже на 14-й день. Авторы заметили, что у животных с опухолью предстательной железы пролиферирующие и атипичные клетки были и в лимфатических фолликулах, и в парафолликулярной области, и в мозговом веществе. Увеличение массы лимфатических узлов и усиление клеточной пролиферации в них сопровождалось экспрессией фактора пролиферации Ki-67 [24]. Наше исследование показало, что на 18-й день канцерогенеза простаты тазовые лимфатические узлы у животных основной группы были изменены за счет уменьшения площади коркового вещества на 14,5% и увеличения площади паракортикальной зоны на 28,4% по сравнению с контрольной группой (p<0,05).
В стадировании РПЖ в первую очередь учитывают наличие лимфатических узлов, их анатомическое расположение, количество, размеры и структуру. Выявленные «положительные» лимфоузлы указывают на риск биохимического рецидива заболевания. Исследование механизмов метастазирования и лимфангиогенеза имеет огромное значение в прогнозе выживаемости пациентов с РПЖ [26]. Так, J.L. Boormans et al. [27] изучали гистопатологические характеристики метастазов в лимфатические узлы при РПЖ и сроки выживаемости пациентов. Медиана общего наблюдения за пациентами, включенными в это исследование, составила 77,5 мес. При однофакторном анализе авторы выявили отрицательную корреляцию выживаемости пациентов с дифференцировкой опухоли в лимфатических узлах по Глисону >7 (отношение рисков (ОР) 2,4; р<0,001), диаметром лимфатического узла (с метастазом) >3 мм (ОР 2,2; р=0,025), наличием метастазов в двух и более лимфатических узлах (ОР 2,0; р=0,003) и экстранодальным ростом опухоли в одном лимфатическом узле и более (ОР 1,9; р=0,014). Многофакторный анализ показал, что только сумма баллов по Глисону в лимфатическом узле и диаметр самого большого метастаза являются независимыми предикторами выживаемости пациента с РПЖ (ОР 1,8; р=0,021 и ОР 2,2; р=0,046 соответственно) [27].
Заключение
Настоящее экспериментальное исследование показало, что перевивка опухоли Эрлиха позволяет создать модель злокачественного перерождения предстательной железы у экспериментальных животных через 2,5 нед. В основном первые метастазы РПЖ появляются в регионарных лимфатических узлах. На 18-е сутки канцерогенеза предстательной железы структура регионарных лимфатических узлов претерпевает изменения: появляется паракортикальная гиперплазия, снижается площадь мозговых тяжей и мозгового вещества, отмечается уменьшение мозговых синусов. Наличие или отсутствие метастазов в регионарных лимфатических узлах является важным критерием распространенности РПЖ, позволяющим прогнозировать течение злокачественного процесса.
Cведения об авторах:
Асташов Вадим Васильевич — д.м.н., профессор, профессор кафедры анатомии человека ФГАОУ ВО «Российский университет дружбы народов»; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 8; ORCID iD 0000-0003-2846-1944.
Ломшаков Андрей Александрович — к.м.н., врач-уролог МУ «Поликлиника ФНПР»; 119334, Россия, г. Москва, Ленинский пр-т, д. 37; ORCID iD 0000-0001-5831-5409.
Цехмистренко Татьяна Александровна — д.б.н., профессор, профессор кафедры анатомии человека ФГАОУ ВО «Российский университет дружбы народов»; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 8; ORCID iD 0000-0003-2130-9405.
Выхристюк Ольга Филипповна — д.м.н., профессор кафедры доказательной медицины Медицинского института ФГАОУ ВО «Российский университет дружбы народов»; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 8; профессор кафедры педиатрии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-0352-9642.
Улога Михаил Васильевич — ассистент кафедры анатомии человека Медицинского института ФГАОУ ВО «Российский университет дружбы народов»; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 8; ORCID iD 0000-0002-1274-8310.
Бородина Инна Юрьевна — ассистент кафедры анатомии человека Медицинского института ФГАОУ ВО
Российский университет дружбы народов»; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 8; ORCID iD 0000-0002-8640-1379.
Толкачев Александр Олегович — м.н.с. отделения онкоурологии МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России; 125284, Россия, г. Москва, 2-й Боткинский пр., д. 3; ORCID iD 0000-0002-8630-6072.
Контактная информация: Асташов Вадим Васильевич, e-mail: vastashov3@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 28.01.2022.
Потупила после рецензирования 22.02.2022.
Принята в печать 22.03.2022.
About the authors:
Vadim V. Astashov — Dr. Sc. (Med.), Professor, Professor of the Department of Human Anatomy, Medical Institute of the Peoples’ Friendship University of Russia (RUDN University); 8 Miklukho-Maklay str., Moscow, 117198, Russian Federation; ORCID iD 0000-0003-2846-1944.
Andrey A. Lomshakov — C. Sc. (Med.), urologist of Polyclinic FNPR; 37 Leninsky Ave., Moscow, 119334, Russian Federation; ORCID iD 0000-0001-5831-5409.
Tatiana A. Tsekhmistrenko — Dr. Sc. (Bio.), Professor, Professor of the Department of Human Anatomy of the Peoples’ Friendship University of Russia (RUDN University); 8 Miklukho-Maklay str., Moscow, 117198, Russian Federation; ORCID iD 0000-0003-2130-9405.
Olga F. Vyhristyuk — Dr. Sc. (Med.), Professor of the Department of Evidence-based Medicine, Medical Institute of the Peoples’ Friendship University of Russia (RUDN University); 8 Miklukho-Maklay str., Moscow, 117198, Russian Federation; Professor of the Department of Pediatrics, Medical Faculty of Pirogov Russian National Research Medical University; 1 Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-0352-9642.
Mikhail V. Uloga — Assistant Professor of the Department of Human Anatomy, Medical Institute of the Peoples’ Friendship University of Russia (RUDN University); 8 Miklukho-Maklay str., Moscow, 117198, Russian Federation; ORCID iD 0000-0002-1274-8310.
Inna Yu. Borodina — Assistant Professor of the Department of Human Anatomy, Medical Institute of the Peoples’ Friendship University of Russia (RUDN University); 8 Miklukho-Maklay str., Moscow, 117198, Russian Federation; ORCID iD 0000-0002-8640-1379.
Alexander O. Tolkachev — Junior Fellow of the Department of Oncourology, P. A. Hertsen Moscow Oncology Research Institute — the branch of the National Medical Research Radiological Centre; 3, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ORCID iD 0000-0002-8630-6072.
Contact information: Vadim V. Astashov, e-mail: vastashov3@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 28.01.2022.
Revised 22.02.2022.
Accepted 22.03.2022.
.
Информация с rmj.ru
