Введение
Рак предстательной железы (РПЖ) в нашей стране занимает первое место в структуре распространенности онкологических заболеваний среди мужчин, составляя на 2023 г. 19,1% от всех злокачественных новообразований у мужского населения [1]. Почти 2/3 случаев впервые выявленного РПЖ относятся к локализованным формам (I–II стадия заболевания) [2], «золотым стандартом» лечения которых является радикальная простатэктомия или лучевая терапия [3], воздействующая на весь объем простаты, что связано со значительным нарушением качества эрекции, мочеиспускания и функции кишечника [4, 5]. Так, например, по данным исследования C. Corsini et al. [5], включающего более 2,5 тыс. пролеченных пациентов с локализованным РПЖ, через 1 год у 13% пациентов после робот-ассистированной радикальной простатэктомии и у 6% пациентов после лучевой терапии отмечалось недержание мочи, у 14 и 34% соответственно — ургентные позывы к дефекации, у 73 и 77% соответственно — эректильная дисфункция.
Чтобы избежать или отсрочить возникновение связанных с активным лечением осложнений для мужчин с РПЖ низкого риска, был разработан протокол активного наблюдения, который предполагает отсроченное выполнение операции или лучевой терапии после прогрессирования заболевания, выявляемого путем рутинного мониторинга [3]. Тем не менее основными недостатками активного наблюдения является риск упустить возможность полного удаления опухоли, а также значительный психоэмоциональный стресс, связанный с наличием нелеченного онкологического заболевания [6].
В качестве гибридной методики, включающей в себя таргетное лечение пораженных участков простаты при продолжении активного наблюдения, является фокальная брахитерапия [7], объем которой может варьировать от селективного облучения одного очага или целой доли простаты без охвата всей железы [8]. На сегодняшний день фокальная брахитерапия может быть использована в режиме монотерапии как метод первичного лечения РПЖ, а также в режиме сальважной терапии как самостоятельно, так и в комбинации с внешней лучевой терапией после рецидива ранее пролеченного РПЖ [9, 10]. Как и в случае классической методики, фокальная брахитерапия может выполняться с использованием и высокодозного, и низкодозного подхода [11].
По данным последнего метаанализа E. Gutiérrez-Valencia et al. [12], опубликованного в марте 2025 г., эффективность фокальной брахитерапии в режиме монотерапии при 24 и 60 мес. наблюдения составила 97 и 82% соответственно, в то время как в случае сальважной фокальной брахитерапии — 67 и 35% соответственно. Одновременно с этим указывалось на низкую токсичность фокальной брахитерапии как в раннем, так и в позднем периоде.
Фокальная брахитерапия обладает рядом дозиметрических преимуществ перед стандартной брахитерапией целой железы как в режиме монотерапии [13, 14], так и при сальважном применении [15, 16]. Так, по данным R. Banerjee et al. [13], при проведении фокальной брахитерапии половины простаты, 1/3 ее объема и 1/6 ее объема доза, получаемая 0,1 см3 органов в зоне риска (D0,1cc) для мочевого пузыря, составила 81,8, 54,5 и 37,3% от предписанной соответственно. При этом для классической брахитерапии целой железы значение D0,1cc было гораздо больше и составляло 82,3% от предписанной дозы. Аналогичная закономерность отмечалась и для показателей D1,0cc и D2,0сс как в отношении мочевого пузыря, так и в отношении прямой кишки и уретры. При сравнении дозиметрических показателей сальважной классической брахитерапии целой железы и сальважной фокальной терапии также отмечалась меньшая лучевая нагрузка на организм при применении последней. По данным V. Guimas et al. [15], кумулятивная биологическая эквивалентная доза, получаемая прямой кишкой, при данных методиках составляет 258,1 и 172,6 Гр соответственно (p<0,01), а при использовании гидрогелевых спейсеров — 83,9 и 63,3 Гр соответственно (р=0,04).
Отмеченные дозиметрические преимущества отражаются в лучшей безопасности фокальной брахитерапии по сравнению с классическим вариантом облучения целой простаты. Так, по данным метаанализа L.M. Andring et al. [17], фокальная брахитерапия по сравнению со стандартной сопряжена с меньшей частотой генитоуринарной токсичности 3-й степени (4 и 12% соответственно) и меньшей частотой гастроинтестинальной токсичности 3-й степени (0 и 3% соответственно). Таким образом, тема фокальной брахитерапии при лечении РПЖ как первичного метода лечения локализованного РПЖ на сегодняшний день приобретает все большую популярность, однако исследования, посвященные данному вопросу, несколько ограниченны и включают небольшое количество пациентов. В связи с этим целью настоящего исследования стала оценка дозиметрических и функциональных показателей фокальной низкодозной брахитерапии у пациентов с локализованным РПЖ низкого и среднего риска прогрессирования.
Содержание статьи
Материал и методы
Дизайн исследования и характеристика включенных пациентов
В исследование были включены пациенты, которым выполнялась фокальная низкодозная брахитерапия простаты (I-125) в период с 2018 по 2020 г. Исследование было одобрено этическим комитетом. Пациенты подписывали информированное согласие. Критериями включения в исследование было наличие РПЖ низкого и промежуточного риска1. К группе низкого риска относятся пациенты с уровнем простатспецифического антигена (ПСА) <10 нг/мл, сТ1-Т2а и ISUP 1-й степени (3 + 3=6 по Глисону). К группе промежуточного риска (благоприятный прогноз) относятся пациенты:
-
с ПСА <10 нг/мл, сТ1-2b и ISUP 2-й степени (3 + 4=7 по Глисону);
-
с ПСА 10–20 нг/мл, сТ1-Т2b и ISUP 1-й степени (3 + 3=6 по Глисону);
-
с ПСА <10 нг/мл, сТ1-Т2b и ISUP 1-й степени (3 + 3=6 по Глисону).
-
К группе промежуточного риска (неблагоприятный прогноз) относятся пациенты:
-
с ПСА 10–20 нг/мл, сТ1-Т2b и ISUP 2-й степени (3 + 4=7 по Глисону);
-
с сТ1-Т2b и ISUP 3-й степени (4 + 3=7 по Глисону).
Очаговое поражение простаты подтверждалось наличием очагового поражения по результатам магнитно-резонансной томографии (МРТ) органов малого таза как на диффузионно-взвешенных изображениях, так и на Т2-взвешенных изображениях при совпадении с положительными результатами биопсии из данных очагов и отсутствии положительных биоптатов в других участках простаты. В случае отсутствия очагового поражения простаты по результатам МРТ фокальное поражение подтверждалось результатами положительной биопсии из одного участка или доли простаты.
Всем пациентам до выполнения фокальной низкодозной терапии оценивался объем простаты, тип мочеиспускания по результатам урофлоуметрии с расчетом максимальной скорости мочеиспускания (Qmax), измерялся объем остаточной мочи. 78,6% пациентов до выполнения низкодозной брахитерапии проводилась андрогенная депривационная терапия, однако все виды терапии были прекращены не менее чем за 3 мес. до выполнения операции.
Длительность наблюдения за пациентами составила 6 мес. с контрольными точками 0 (до проведения брахитерапии), 14 дней после, 3 и 6 мес. (после). За время наблюдения у всех пациентов осуществлялся контроль ПСА (0, 14 дней, 3 мес. и 6 мес.), контроль качества мочеиспускания по опроснику «Международная оценка симптомов простаты» (International Prostate Symptom Score, IPSS) в контрольные точки 0, через 3 и 6 мес., контроль качества жизни по опроснику «Качество жизни» (Quality of Life, QoL) (0, 3 и 6 мес.), контроль качества эрекции по опрос-нику «Международный индекс эректильной функции» (МИЭФ-5) (0, 3 и 6 мес.).
Методика выполнения фокальной низкодозной брахитерапии
Имплантация зерен I-125 выполнялась под эпидуральной или общей анестезией. После выполнения обезболивания пациента укладывали в положение на спине. Мочевой пузырь катетеризируется катетером Фолея 16–18 Ch. Баллон катетера раздувается физиологическим раствором до объема 10–20 см3. В полость мочевого пузыря вводится рентгеноконтрастный раствор для выполнения цистографии. Органы мошонки фиксируются широким пластырем так, чтобы исключить риск их повреждения во время операции. Промежность обрабатывается дезинфицирующим раствором. Операционное поле обкладывается стерильным бельем. Ассистент вводит ультразвуковой датчик в прямую кишку и фиксирует его на пошаговом устройстве. На нем же устанавливается координатный шаблон. Перемещением ультразвукового датчика вперед и назад добиваются совпадения исходного и текущего изображения «0». Проверяют соответствие всех срезов. При необходимости выполняется коррекция посредством раздувания баллона в прямой кишке и/или изменения угла наклона датчика. Проводятся повторные сканирования предстательной железы от основания до верхушки до получения полной идентичности исходных и полученных УЗ-картинок.
Далее в соответствии с дозиметрическим планом и учетом расположения опухоли проводится имплантация радиоактивных источников I-125. При имплантации зерен в самые латеральные верхние координаты иногда возникают проблемы, связанные с тем, что эти части железы закрыты лонной дугой и игла упирается в кость. В таких случаях эти иглы внедряются в последнюю очередь. Для того чтобы обойти препятствие, изменяют угол наклона датчика с 5 до 15–20° и вводят иглы в координаты согласно плану. Однако из-за риска повреждения стенки прямой кишки подобная техника допустима только для рядов, расположенных ближе к верхушке предстательной железы. По окончании операции выполняется рентгенография малого таза с целью послеоперационного контроля расположения источников. Кожа промежности обрабатывается раствором антисептика, операционное поле закрывается асептической наклейкой. Пациент переводится в послеоперационную палату. Назначаются антибактериальные препараты. Уретральный катетер оставляют на 1–2 дня. После удаления уретрального катетера в течение 5 дней пациент мочится через марлю в специально подготовленную емкость.
В день манипуляции или на следующий день пациенту выполняются компьютерная томография органов малого таза (рис. 1) и постимплантационный дозиметрический анализ. При отсутствии осложнений пациент может быть выписан под амбулаторное наблюдение урологом и онкологом на следующий день после удаления уретрального катетера.
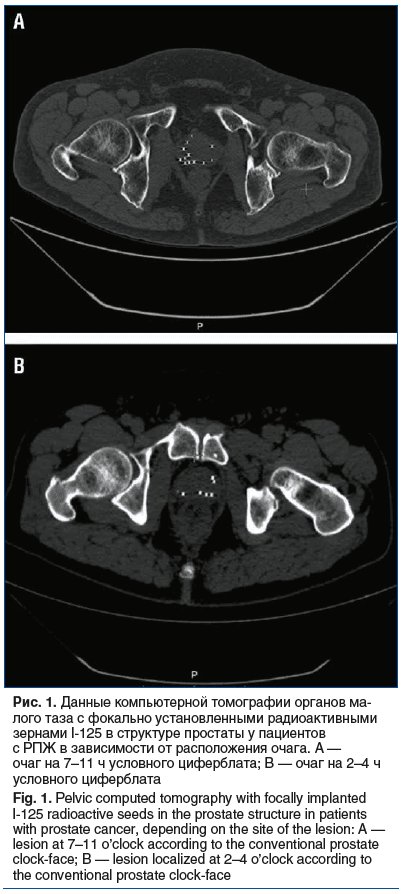
Оценка дозиметрических показателей и осложнений
При оценке лучевой нагрузки на простату и органы, находящиеся в зоне риска, рассчитывались следующие дозиметрические показатели:
доза облучения, получаемая 90% объема опухоли (D90 опухоли);
доза облучения, получаемая 90% объема простаты (D90 простаты);
процент объема простаты, получающей 100% предписанной дозы (V100, %);
процент объема простаты, получающей 150% предписанной дозы (V150, %);
объем прямой кишки, покрытый 100% предписанной дозы (V100, см3);
объем прямой кишки, покрытый 150% предписанной дозы (V150, см3).
Генитоуринарные и гастроинтестинальные токсические реакции были оценены при помощи стандартизированный системы классификации для оценки тяжести побочных реакций (Common Terminology Criteria for Adverse Events, CTCAE), версия 5.02. Токсические реакции оценивались через 3 и 6 мес. после выполнения фокальной низкодозной брахитерапии.
Статистический анализ данных
Статистическая обработка данных выполнялась с использованием программного обеспечения RStudio (версия 2024.12.1+563) на языке программирования R.
Количественные переменные были представлены в виде медианы и межквартильного интервала (Q1-Q3). Номинальные переменные были представлены в виде абсолютных значений (n) и процентного распределения (%).
Изучаемые показатели в каждом повторном измерении (IPSS, QoL, МИЭФ-5, ПСА) были представлены в виде средних значений, рассчитанных методом наименьших квадратов (LS-средние) и их 95% доверительных интервалов (ДИ). Для оценки влияния времени на динамику изменения изучаемых параметров выполнялось построение линейных моделей со смешанными эффектами для каждого повторного измерения каждого параметра (linear mixed effects models) с последующим выполнением дисперсионного анализа данных моделей (ANOVA). Время после выполнения фокальной низкодозной брахитерапии оказывало статистически значимое влияние на динамику изменения показателей при p<0,05 в ходе дисперсионного анализа. Для попарного сравнения изучаемых показателей между всеми повторными измерениями были рассчитаны их разницы (Δ) с 95% ДИ для Δ. Разница между повторными измерениями считалась статистически значимой при p<0,05.
Результаты исследования
Всем 70 пациентам, включенным в настоящее исследование, была выполнена таргетная фокальная низкодозная брахитерапия. Средний возраст пациентов по медиане составил 67,0 (64,0–73,0) года. У всех пациентов отмечалось унилатеральное поражение простаты, причем у 5 (5,1%) пациентов — без очагового поражения простаты по результатам МРТ. Средний объем простаты по медиане составил 30 см3. У 90% (n=63) пациентов не отмечалось затруднений при мочеиспускании, урофлоуметрическая кривая имела необструктивный тип. Установили, что 47 (67,1%) пациентов относились к группе низкого риска, в то время как 23 (32,9%) — к группе промежуточного риска. Описательная характеристика включенных в исследование пациентов показана в таблице 1.

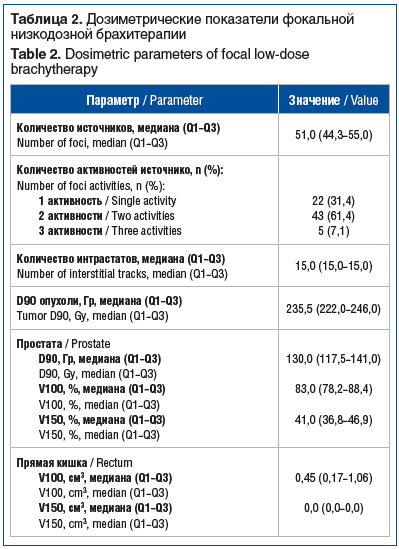
Интра- и послеоперационные дозиметрические показатели фокальной низкодозной брахитерапии показаны в таблице 2. Среднее количество источников, используемых для одного пациента, по медиане составило 51 (44,3–55,0). Доза, получаемая 90% объема опухоли (D90 опухоли), составила 235,5 Гр, в то время как аналогичный показатель для простаты был ниже, 130,0 Гр, указывая тем самым на таргетное воздействие ионизирующего излучения на опухоль. Значения V100 и V150 для простаты составили по медиане 83 и 41% соответственно, что также говорит о наличии менее выраженной лучевой нагрузки, не покрывающей весь объем органа. При оценке дозиметрических показателей прямой кишки оказалось, что показатель V100 для прямой кишки составил по медиане 0,45 см3, в то время как ни один участок прямой кишки не получил 150% и более от предписанной дозы.
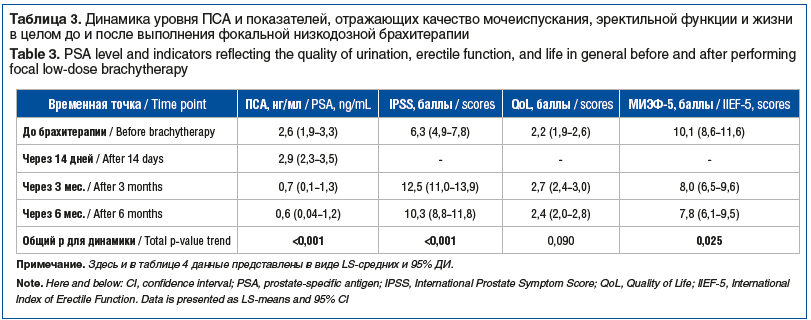
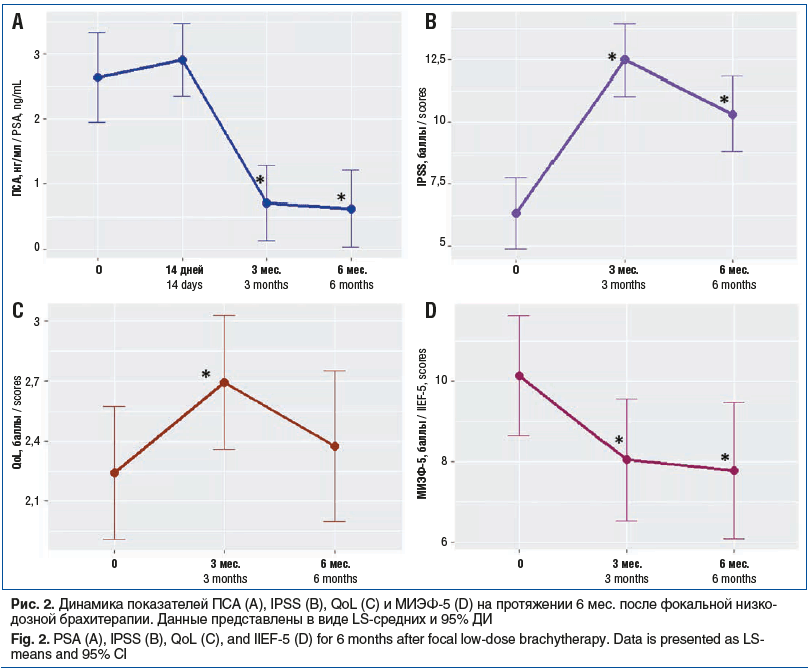
Как видно из нижепредставленной таблицы 3, общая динамика оцениваемых нами параметров на протяжении 6 мес. наблюдения оказалась статистически значимой для ПСА, IPSS и МИЭФ-5 (р<0,001, p<0,001 и р=0,025 соответственно). Общая динамика QoL на протяжении 6 мес. наблюдения была статистически незначимой (р=0,090), что указывает на отсутствие изменения качества жизни пациентов на протяжении 6 мес. после фокальной низкодозной брахитерапии.
Для более детальной оценки динамики изучаемых параметров нами было выполнено их попарное сравнение между различными временными точками. Результаты попарного сравнения представлены в таблице 4. Как видно из представленных таблиц 3 и 4, уровень ПСА через 14 дней после выполнения брахитерапии несколько вырос, однако данный прирост был статистически незначимым (р=0,467). Через 3 и 6 мес. после выполнения процедуры отмечалось статистически значимое снижение уровня ПСА на 1,9 и 2,0 нг/мл соответственно.
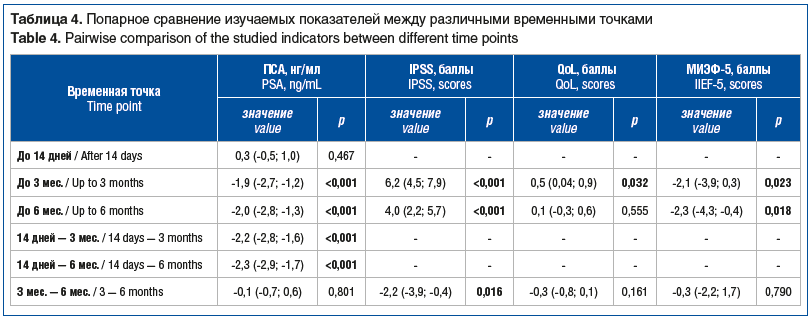
В отношении качества мочеиспускания, оцененного при помощи шкалы IPSS, через 3 мес. после выполнения брахитерапии было отмечено некоторое ухудшение (увеличение по IPSS на 6,2 балла, р<0,001). Однако от 3-го к 6-му месяцу наблюдения качество мочеиспускания несколько улучшилось, что проявлялось снижением количества баллов по шкале IPSS на 2,2 (р=0,016). Как следствие, качество жизни пациентов через 3 мес. также ухудшилось, что проявлялось увеличением баллов по шкале QoL на 0,5 по сравнению со значением до выполнения брахитерапии (р=0,032). Однако через 6 мес. качество жизни вернулось к исходному уровню, сопоставимому с дооперационным (уровень значимости различий показателей QoL между точками до брахитерапии и через 6 мес. после составил 0,555).
Качество эректильной функции, оцененное при помощи опросника МИЭФ-5, через 3 и 6 мес. после фокальной низкодозной брахитерапии снизилось на 2,1 и 2,3 балла соответственно (р=0,023 и р=0,018), составив 8,0 и 7,8 балла соответственно при исходных 10,1 балла. Таким образом. у подавляющего большинства пациентов исходно отмечалась эректильная дисфункция тяжелой степени, которая осталась после выполнения операции.
Динамика показателей ПСА, IPSS, QoL и МИЭФ-15 на протяжении 6 мес. после брахитерапии показана на рисунке 2.
В ходе оценки безопасности фокальной низкодозной брахитерапии было показано, что ранние генитоуринарные токсические реакции отмечались в 84,3% случаев (59 пациентов), причем все они относились к 1-й степени по CTCAE. Поздние генитоуринарные токсические реакции возникали в 36,2% случаев (25 пациентов) и также относились к 1-й степени по CTCAE. Ранние гастроинтестинальные токсические реакции отмечались у 1,4% пациентов (1 пациент) и классифицировались как осложнения 1-й степени по CTCAE (рис. 3А). Поздних гастроинтестинальных токсических реакций не выявлялось. Осложнений 2-й степени и выше после выполнения фокальной низкодозной брахитерапии как в раннем, так и в позднем послеоперационном периоде зафиксировано не было.
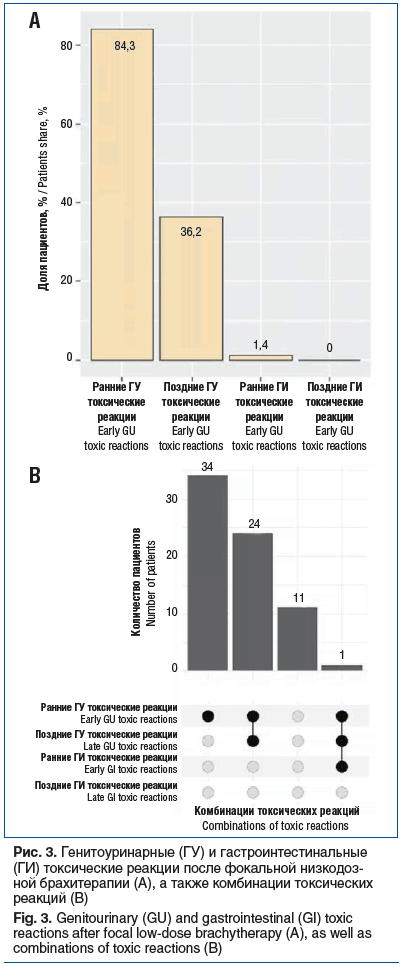
На рисунке 3B представлено распределение одновременного наличия у одного и того же пациента нескольких типов токсических реакций (наличие данного вида токсической реакции обозначено черным кругом, а совместное наличие 2 и более токсических реакций — черными кругами, соединенными черными линиями). Как видно из рисунка 3В, у 34 (48,6%) пациентов отмечались только ранние генитоуринарные токсические реакции, в то время как у 24 (34,3%) пациентов — как ранние, так и поздние генитоуринарные токсические реакции. У 11 (15,7%) пациентов не отмечалось токсических реакций и у 1 (1,4%) пациента были одновременно зафиксированы ранние и поздние генитоуринарные токсические реакции и ранние гастроинтестинальные токсические реакции.
Обсуждение
Эволюция методик визуализации способствовала широкому распространению органосохраняющих стратегий лечения онкологических заболеваний, примером которых является фокальная брахитерапия при РПЖ. Согласно реестру клинических исследований (ClinicalTrials.gov) на конец мая 2025 г. идет набор пациентов в 11 проектов, посвященных изучению различных аспектов фокальной брахитерапии при РПЖ3. Из них 8 клинических исследований нацелены на оценку эффективности фокальной брахитерапии как первичного метода лечения РПЖ у пациентов низкого и промежуточного низка в режиме монотерапии. Тем самым это отражает актуальность и потребность дополнительных данных и, соответственно, настоящей работы для заключения о целесообразности внедрения фокальной брахитерапии в рутинную клиническую практику у четко отобранных категорий пациентов.
В рамках настоящей работы, выполненной с привлечением 70 пациентов с РПЖ низкого и промежуточного риска, было показано, что фокальная низкодозная брахитерапия обладает отличным профилем безопасности, не приводя к развитию осложнений 2-й степени и выше. Помимо этого, в течение 6 мес. наблюдения методика отличается отсутствием влияния на качество жизни пациентов и выраженным снижением уровня ПСА с 2,6 до 0,6 нг/мл. Похожие данные отмечаются и в большинстве работ, посвященных изучению фокальной брахитерапии как первичного метода лечения пациентов с локализованным РПЖ [18, 19]. Так, M.H. Ta et al. [18] показали, что через 6 мес. после операции уровень ПСА снизился на 67,5%, сохраняясь на таком уровне на протяжении 24 мес. наблюдения. По данным E. Anderson et al. [19], ПСА после выполнения фокальной низкодозной брахитерапии у пациентов низкого и промежуточного риска снижается в среднем на 72,1% (95% ДИ 21,9–95,1%). Аналогичные данные относительно снижения ПСА были характерны и для фокальной высокодозной брахитерапии [20–22]. Это указывает на хорошие онкологические результаты изучаемой методики у отобранных категорий пациентов.
Доказано, что объем простаты, получающей лучевую нагрузку, прогрессивно снижается от брахитерапии целой железы к гемибрахитерапии и таргетной фокальной брахитерапии РПЖ [17, 23, 24]. При этом в ходе выполнения фокальных методик отмечается значительное снижение лучевой нагрузки на оставшийся объем здоровой ткани простаты [25, 26]. Так, R. Laing et al. [25] показали, что при выполнении гемифокальной низкодозной брахитерапии процент объема простаты, получающей 100% от предписанной дозы (V100) для таргетной доли простаты, составил 93,1%, в то время как для контралатеральной интактной доли — 24,6%. Аналогичная закономерность отмечалась и для средней дозы, получаемой 90% (D90) ткани простаты: для таргетной доли D90 составила 153,8 Гр, в то время как для контралатеральной интактной доли D90 оказалась в 3 раза ниже, 47,5 Гр. Похожие данные были получены и в рамках настоящего исследования. Нами было показано, что при таргетной низкодозной брахитерапии D90 для опухоли по медиане составила 235,5 (222,0–246,0) Гр, в то время как для простаты — почти в 2 раза ниже, 130,0 (117,5–141,0) Гр, подчеркивая тем самым фокальное облучение интересующей зоны простаты.
Дозиметрические преимущества фокальной низкодозной брахитерапии отражаются и в отсутствии выраженных токсических реакций при выполнении данной методики как при сальважном применении [27], так и в случае первичного лечения РПЖ [28]. Так, согласно данным H. Kunogi et al. [28], у пациентов низкого и промежуточного риска после выполнения фокальной низкодозной брахитерапии не отмечалось ни одной гастроинтестинальной токсической реакции 1-й степени и выше в течение 36 мес. наблюдения. У 3 (16%) пациентов из 19 отмечались генитоуринарные токсические реакции 2-й степени в виде учащенного мочеиспускания. Однако данные жалобы исследователи связывали не с непосредственным выполнением операции, а с наличием инфравезикальной обструкции в связи с гиперплазией простаты, поскольку данные жалобы присутствовали и до проведения брахитерапии. Помимо этого, после фокальной брахитерапии не отмечалось и вновь возникшей эректильной дисфункции [28]. Похожие результаты были получены E. Anderson et al. [19]. Исследователи показали, что у пациентов низкого и промежуточного риска после фокальной низкодозной брахитерапии не выявляется ни одной токсической реакции 3-й степени. Одновременно с этим в 29,2% случаев в течение первых 3 мес. отмечались симптомы нарушенного мочеиспускания, классифицированные как 2-я степень по CTCAE. Ректальная токсичность возникала только в позднем послеоперационном периоде в 16,7% случаев (1-я степень) и постепенно уменьшалась к последнему визиту пациентов (медиана наблюдения 19 мес.). При этом 45,8% пациентов отмечали снижение эректильной функции, однако только 33,3% отметили дальнейшее ухудшение в течение 19 мес. наблюдения. При этом нарушения качества эрекции успешно корректировались путем назначения стандартной медикаментозной терапии [19]. Полученные в настоящем исследовании результаты подтвердили данные зарубежных исследователей. Нами еще раз было доказано, что фокальная низкодозная брахитерапия обладает низкой частотой выраженных токсических реакций как в раннем, так и в позднем периоде. Ни у одного из пациентов нашего исследования не было зафиксировано токсической реакции 2-й степени и выше. Ранние генитоуринарные токсические реакции 1-й степени возникали в 84,3% случаев, сохраняясь более 3 мес. только у 36,2% пациентов. Ранние гастроинтестинальные токсические реакции 1-й степени возникали только у 1 (1,4%) пациента, в то время как в позднем периоде ни у одного из пациентов не выявлялось гастроинтестинальных токсических реакций.
Отсутствие выраженных токсических реакций после низкодозной фокальной брахитерапии проявлялось практически неизменным качеством жизни пациентов, оцененным при помощи опросника QoL. Нами было показано, что если до выполнения операции пациенты оценивали свое качество жизни в среднем на 2,2 балла, то через 6 мес. — на 2,4 балла при отсутствии статистически значимого различия данных изменений (р=0,555). Однако одновременно с этим у пациентов отмечалось некоторое снижение качества мочеиспускания, оцененного по шкале IPSS. Если до брахитерапии пациенты набирали в среднем 6,3 балла по IPSS, то через 6 мес. после — 10,3 балла, переходя тем самым из категории незначительных нарушений в категорию умеренных. Аналогичная динамика отмечалась и для качества эректильной функции, где количество баллов по МИЭФ-5 уменьшилось с 10,1 до 7,8, оставаясь при этом в категории эректильной дисфункции тяжелой степени. Похожая на настоящее исследование работа по сравнению параметров, характеризующих качество мочеиспускания и эректильной функции до и после выполнения фокальной брахитерапии, была проведена M.H. Ta et al. [18]. На выборке из 39 человек с РПЖ низкого и промежуточного риска исследователи показали, что значение IPSS через 2 мес. после операции значительно повышается с 6,7 до 12,5 балла (р=0,003), а затем происходит плавное снижение различий, которые к 6-му месяцу становятся статистически незначимыми (6,7 и 8,5 балла соответственно, р=0,140). В отношении качества эрекции, оцененной при помощи опросника МИЭФ-5, исследователи показали, что при выполнении фокальной брахитерапии через 2 мес. также отмечается выраженное снижение качества эрекции, что проявляется снижением баллов по МИЭФ-5 с 18 до 14,3 (р=0,034). Такая разница сохраняется вплоть до 6 мес. после операции, однако затем различия становятся статистически незначимыми, хотя в абсолютных значениях баллов по МИЭФ-5 их количество все еще остается ниже, чем до проведения фокальной брахитерапии [18].
Заключение
Таким образом, полученные нами результаты свидетельствуют о целесообразности использования фокальной низкодозной брахитерапии у пациентов с локализованным РПЖ низкого и промежуточного онкологического риска. Данная методика обладает рядом дозиметрических преимуществ и связана со снижением лучевой нагрузки на оставшийся объем простаты и на соседние органы, находящиеся в зоне риска. Это сопряжено с благоприятным профилем безопасности фокальной низкодозной брахитерапии, которая характеризуется отсутствием выраженных гастроинтестинальных и генито-уринарных токсических реакций. Помимо этого, фокальная низкодозная брахитерапия ассоциирована с хорошими функциональными и онкологическими результатами, а также с отсутствием изменения качества жизни пациентов. Важно отметить, что для повышения эффективности и безопасности данного типа вмешательства следует учитывать необходимость четкого отбора пациентов с дальнейшей оценкой отдаленных результатов лечения.
Сведения об авторах:
Павлов Андрей Юрьевич — д.м.н., профессор, главный врач ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002- 2905-7735
Дзидзария Александр Гудисович — д.м.н., заведующий отделением урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0001-5789-375X
Цыбульский Алексей Дмитриевич — д.м.н., старший научный сотрудник отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-1647-6180
Володин Максим Сергеевич — врач-аспирант отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86.
Володина Ирина Викторовна — врач-аспирант отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 00000002-3327-6025
Контактная информация: Володина Ирина Викторовна, e-mail: i.horoshevskaya@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.06.2025.
Поступила после рецензирования 27.06.2025.
Принята в печать 22.07.2025.
About the authors:
Andrey Yu. Pavlov — Dr. Sc. (Med.), Professor, Chief Medical Officer, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2905-7735
Alexander G. Dzidzaria — Dr. Sc. (Med.), Deputy Director of the Department of Urology with Oncology Beds and Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5789-375X
Alexey D. Tsybulsky — Dr. Sc. (Med.), Senior Researcher at the Department of Urology with Oncology Beds and
Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1647-6180
Maxim S. Volodin — postgraduate doctor at the Department of Urology with Oncology Beds and Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation.
Irina V. Volodina — postgraduate doctor at the Department of Urology with Oncology Beds and Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-3327-6025
Contact information: Irina V. Volodina, e-mail: i.horoshevskaya@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.06.2025.
Revised 27.06.2025.
Accepted 22.07.2025.
1EAU Guidelines. Prostate cancer. 2025. (Electronic resource.) URL: https://uroweb.org/guidelines/prostate-cancer (access date: 15.05.2025).
2Common Terminology Criteria for Adverse Events (CTCAE). Version 5.0. Published: November 27,2017.
3Clinicaltrials.gov (Electronic resource). URL: https://clinicaltrials.gov/search?cond=Prostate%20Cancer&intr=Focal%20brachytherapy&… (access date 01.03.2025).
Информация с rmj.ru
