Железодефицитные состояния беременных и их медикаментозная коррекция
Содержание статьи
Введение
Железодефицитная анемия (ЖДА) в современных условиях представляет собой определенную проблему в связи с очень широким распространением в мире (около 30% всех жителей Земли) и нарушением органов и систем, развивающимся на фоне дефицита железа. Железо — важнейший микроэлемент, участвующий как в обеспечении нормального функционирования ферментных систем клеток, так и в процессах жизнеобеспечения всего организма.
ЖДА является распространенным осложнением при беременности и оказывает неблагоприятное влияние на состояние матери и плода, что обусловлено снижением содержания железа в сыворотке крови и костном мозге и, как следствие, снижением его депонирования [1].
В мире ЖДА страдают около 600 млн человек (29,7% населения), из них 50 млн составляют беременные, которые имеют манифестный дефицит железа (МДЖ), частота которого варьирует от 24,9 до 51,7%. В России встречаемость ЖДА у беременных достигает 43,6%. Частота латентного дефицита железа у беременных составляет 93%. Эта проблема достаточно актуальна, поскольку, по имеющимся сведениям, к концу беременности ЖДА развивается практически у всех беременных [2].
Согласно информации ВОЗ анемией беременных необходимо считать снижение гемоглобина (Hb) <110 г/л и гематокрита (Ht) <33%. По определению некоторых исследований, проведенных научно-исследовательскими центрами США, у беременных в I и III триместрах анемией следует считать снижение Hb ниже 110 г/л, а во II триместре — ниже 105 г/л.
Согласно рекомендациям ВОЗ используют следующую классификацию анемии у беременных: анемия легкой степени тяжести — Hb 90–110 г/л; анемия средней степени тяжести — Hb 89–70 г/л; анемия тяжелой степени — Hb менее 70 г/л.
МДЖ при беременности возникает из-за нарушения равновесия между расходованием железа, которое возрастает при гестации, и его поступлением извне. При дефиците железа у беременных возникает гемическая гипоксия, которая является пусковым механизмом для развития вторичных метаболических нарушений как у беременных, так и у плода.
У беременных с тяжелой формой ЖДА развивается циркуляторная гипоксия, которая вызывает дистрофические изменения в сердце, нарушая его сократительную способность, а также в миометрии, что приводит к гипоплазии ворсин хориона и, как следствие, дальнейшему развитию фетоплацентарной недостаточности. Изменения при ЖДА, приводящие к нарушениям гомеостаза у беременных, способствуют развитию акушерских осложнений, таких как выкидыши, преждевременные роды, плацентарная недостаточность, гипотрофия плода, слабость родовой деятельности, кровотечения, частота которых находится в прямой корреляции со степенью тяжести анемии [3, 4].
Тяжелая анемия, диагностированная в I триместре, увеличивает риск задержки психического развития, низкой оценки новорожденного по шкале Апгар, гипоксии плода, задержки внутриутробного роста, патологии желудочно-кишечного тракта (ЖКТ) и других систем; в III триместре тяжелая анемия коррелирует с высоким уровнем материнской смертности (5,4%) и вероятностью перинатальной гибели плода (6,3%).
Дефицит железа связан также с риском ряда осложнений во время родов: кровотечениями вследствие гипотонии матки (13%), гнойно-септическими осложнениями (12%).
Только истинная анемия беременных обусловливает типичную клиническую картину и влияет на течение беременности и родов. Анемия беременных протекает тяжелее, чем анемия, возникшая до гестации [5, 6]. При возникновении анемии во время беременности отмечается резкое и значительное ухудшение общего состояния женщины.
Клинические проявления железодефицитных состояний включают 2 основных синдрома: анемию и сидеропению. Клиническая картина развивается обычно при анемии средней тяжести и проявляется жалобами на общую слабость, быструю утомляемость, периодические головокружения, головные боли, тахикардию, одышку при выполнении физических нагрузок, а иногда и в покое, извращение вкусовых предпочтений, нарушение глотания с ощущением инородного тела в горле.
При оценке объективного статуса больных определяется бледность кожи и слизистых оболочек, их иктеричность, сухость покровов, появление трещин, мышечная слабость, ангулярный стоматит, атрофия сосочков языка, ломкость ногтей, сухость, ломкость и выпадение волос [7–9].
На современном этапе прогресс в фармакологии предоставил большой выбор лекарственных препаратов на фармацевтическом рынке. Эффективным способом снижения материнской и перинатальной смертности, а также акушерских осложнений является адекватная терапия ЖДА. Особый интерес в этом отношении представляет один из эффективных препаратов для лечения МДЖ — Тардиферон. Одна таблетка с пролонгированным действием, покрытая пленочной оболочкой, содержит железа сульфат (II), количество которого эквивалентно 80 мг элементарного железа. В основу таблетки входит полимерный стабильный комплекс, содержащий активное двухвалентное железо. Пролонгированное высвобождение железа из данного комплекса происходит за счет матричной структуры препарата в двенадцатиперстной кишке и дистальном отделе тонкой кишки. Хорошая переносимость препарата со стороны ЖКТ связана с отсутствием местного раздражающего действия на слизистую оболочку желудка и кишечника. Прием препарата Тардиферон обеспечивает пролонгированное высвобождение железа в ЖКТ в зоне максимального всасывания и поддержание повышенного уровня железа в сыворотке крови до 12 ч [10].Препарат обладает хорошей биодоступностью (10–15%) по сравнению с препаратами трехвалентного железа, что связано с низкой растворимостью последних в щелочной среде двенадцатиперстной кишки. Препарат Тардиферон можно применять в течение всего срока беременности в соответствии с рекомендациями, изложенными в инструкции по применению [10].
Собственные результаты
Нами проведено исследование эффективности лечения ЖДА у беременных препаратом Тардиферон.
В течение 2019 г. под наблюдением находились 45 беременных с ЖДА легкой степени тяжести. Женщины имели как одноплодную, так и многоплодную беременность и получали препарат, содержащий сульфат железа II с пролонгированным высвобождением (Тардиферон).
Критериями включения беременных в исследование послужили: содержание Hb в пределах от 90 до 110 г/л, сывороточного железа (СЖ) 12,5 мкмоль/л и ниже, сывороточного ферритина (СФ) ≤20 мкг/л, что соответствует анемии легкой степени тяжести, и гестационный срок 28–32 нед.
Критерии исключения: гиперчувствительность к препаратам железа, гемолитическая анемия, апластическая анемия, пернициозная анемия и другие противопоказания к применению препарата Тардиферон.
У всех женщин был проведен сбор анамнеза заболевания, гинекологический осмотр, оценка общего статуса. У каждой беременной до начала лечения и через 4 нед. проводили лабораторный мониторинг для определения гематологических и феррокинетических параметров: Hb, Ht, эритроцитов, СЖ, СФ, трансферрина, а также коэффициента насыщения трансферрина железом (КНТ).
Возраст беременных колебался от 23 до 37 лет и в среднем составил 29,8 года. Исходное содержание Hb в основной группе было от 90 до 110 г/л и в среднем составило 91,7 г/л.
Всем женщинам был назначен препарат Тардиферон в дозировке 80 мг (1 таблетка) 1 р./сут курсом 30 дней, после чего оценивались показатели гемограммы. Эффективность препарата оценивали по динамике гематологических показателей и показателей обмена железа. Определяли наличие побочных эффектов и степень их выраженности.
Статистическую обработку результатов проводили с помощью программы MS Exсel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической статистики (t-test Cтьюдента). При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
У беременных, получавших препарат пролонгированного действия Тардиферон, было выявлено достоверное увеличение значений показателей крови (Hb, эритроцитов, Ht) и показателей обмена железа: уровня СЖ, СФ, КНТ (табл. 1).
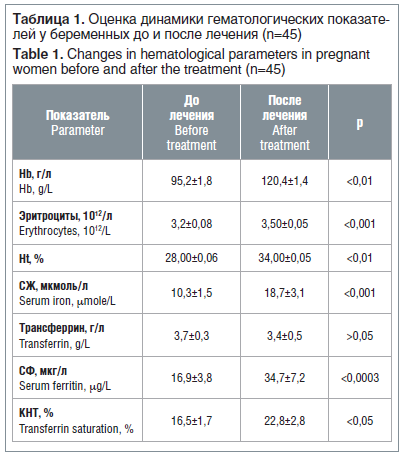
Проводили оценку динамики показателей Hb и СФ как основных показателей тяжести ЖДА.
Увеличение средних значений гемограммы на фоне терапии составило для Hb 26,5%, Ht — 21,4%, эритроцитов — 9,4%, что соответствует удовлетворительному результату лечения.
Таким образом, у беременных с анемией на фоне терапии препаратами железа происходит нормализация гематологических показателей, что приводит к улучшению снабжения тканей кислородом и положительному клиническому эффекту (улучшение самочувствия после терапии, повышение переносимости физических нагрузок). Применение солевых препаратов железа может вызывать токсичность и нежелательные побочные явления: обстипации, боли в эпигастрии, диарею, тошноту, металлический привкус. Стоит отметить, что, по данным опроса беременных во время проводимой терапии, наличие побочных эффектов в виде запоров и нарушения дефекации, не требующие отмены препарата, отметили 15,6% (7 человек) опрошенных женщин, что свидетельствует о хорошей переносимости, обеспечивающей высокую приверженность лечению.
Заключение
Полученные данные свидетельствуют, что препарат двухвалентного железа с пролонгированным действием Тардиферон является препаратом выбора у пациенток с дефицитом железа и ЖДА в акушерско-гинекологической практике для коррекции анемии. Препарат имеет высокий уровень безопасности, характеризуется хорошей переносимостью со стороны ЖКТ, не взаимодействует с компонентами пищи и применяемыми одновременно хелатными лекарственными средствами и эффективно купирует анемический и сидеропенический синдромы у женщин, страдающих анемией легкой степени тяжести [11, 12]. Выгодное соотношение эффективности и цены, доступность, удобство приема препарата обеспечивают высокую приверженность пациенток лечению, что позволяет добиться высоких клинических результатов антианемической терапии. Фармакологические свойства Тардиферона, подтвержденные клиническими исследованиями [13], обеспечивают ряд преимуществ: высокую эффективность лечения анемии и относительно хорошую переносимость. Таким образом, терапия ЖДА у беременных ферропрепаратами является высокоэффективной, приводит к нормализации показателей гемограммы, улучшению общего состояния пациенток, снижению акушерских и неонатальных осложнений.
Благодарность/Acknowledgement
Публикация осуществлена при поддержке компании «Пьер Фабр Медикамент» в соответствии с внутренней политикой и действующим законодательством РФ. «Пьер Фабр Медикамент», его работники либо представители не принимали участия в написании настоящей статьи, не несут ответственности за содержание статьи, а также не несут ответственности за любые возможные относящиеся к данной статье договоренности либо финансовые соглашения с любыми третьими лицами. Мнение «Пьер Фабр Медикамент» может отличаться от мнения автора и редакции.
Сведения об авторах:
Коротких Ирина Николаевна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии № 1, ORCID iD 0000-0001-6525-5934;
Литвиненко Олеся Валерьевна — студентка 6 курса лечебного факультета, ORCID iD 0000-0003-0950-9148.
ФГБОУ ВО ВГМУ им. Н.Н. Бурденко Минздрава России. 394036, Россия, г. Воронеж, ул. Студенческая, д. 10.
Контактная информация: Коротких Ирина Николаевна, e-mail: korotkikh_1950@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 12.10.2019.
About the authors:
Irina N. Korotkikh — MD, PhD, Professor, Head of the Department of Obstetrics and Gynecology No. 1, ORCID iD 0000-0001-6525-5934;
Olesya V. Litvinenko — medical student, ORCID iD 0000-0003-0950-9148.
N.N. Burdenko Voronezh State Medical University. 10, Studencheskaya str., Voronezh, 394036, Russian Federation.
Contact information: Irina N. Korotkikh, e-mail: korotkikh_1950@mail.ru. Financial Disclosure: author has no a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 12.10.2019.
Информация с rmj.ru



