Железа (III) гидроксид олигоизомальтозат 1000: Новый высокодозный вариант парентеральной терапии препаратами железа
Philip A. Kalra1, Klaus Bock2, Morten Meldal3
1-Отделение нефрологии Сальфордской Королевской больницы, Сальфорд, Великобритания.
2-Химический факультет, Университет Копенгагена, Копенгаген, Дания.
3-Центр нанотехнологий, Университет Копенгагена, Копенгаген, Дания.
РЕЗЮМЕ
Железа (III) гидроксид олигоизомальтозат 1000 (Monofer®) представляет собой новую, не содержащую декстран форму парентерального железа, утвержденную в настоящее время в 22 странах ЕС. Железа (III) гидроксид олигоизомальтозат 1000 состоит из железа и углеводного фрагмента, в котором железо тесно связано с матричной структурой, обеспечивающей контролируемое и медленное его высвобождение в железо-связывающие белки, предотвращая токсичность. Углевод – олигоизомальтоза (1000 Да) – имеет линейную химическую структуру с низкой иммунологической активностью. Поэтому нет необходимости в тестовой (пробной) дозе и препарат можно вводить в максимальной дозе 20 мг/кг в течение 30-60 минут за одно посещение. Таким образом, железа (III) гидроксид олигоизомальтозат 1000 предлагает самый широкий диапазон доз по сравнению с другими препаратами парентерального железа, представленными на рынке. В связи с гибкостью дозы, возможность проведения полной коррекции дефицита железа за одно посещение делает железа (III) гидроксид олигоизомальтозат 1000 очень удобным как для медицинского работника, так и для пациента. Клинические исследования показывают, что железа (III) гидроксид олигоизомальтозат 1000 является эффективным и хорошо переносимым препаратом для лечения железодефицитной анемии с благоприятным профилем безопасности. Кроме того, железа (III) гидроксид олигоизомальтозат 1000 не вызывает гипофосфатемию.
Ключевые слова: Высокие дозы; железодефицитная анемия, железа (III) гидроксид олигоизомальтозат; лечение железом.
Введение
Возможность введения высоких доз железа играет важную роль в лечении железодефицитной анемии (ЖДА) в клинических ситуациях с высокой потребностью в железе: хроническая болезнь почек (ХБП), хронические кровопотери, связанные с воспалительными заболеваниями кишечника или другими желудочно-кишечными заболеваниями, беременность и потери крови во время операции. Во многих случаях парентеральное железо предоставляет вероятность быстрой коррекции железа, превосходящую прием препаратов внутрь. Особенно заметно преимущество при лечении анемии, связанной с хроническими заболеваниями, когда пациенты или не отвечают на прием препаратов железа, или всасывание железа заблокировано; в случаях с выраженным дефицитом железа, поскольку максимальная мощность всасывания для перорального железа очень ограничена; в ситуациях, когда пациенты лечатся эритропоэз-стимулирующими
агентами (ЭСА).
Имеющиеся в настоящее время препараты парентерального железа включают высокомолекулярный декстран железа (Dexferrum®), низкомолекулярный декстран железа (Cosmofer®/ Infed®), глюконат железа (Ferrlecit®), сахарат железа (Venofer®), ферумокситол (Feraheme®), железа карбоксимальтозат (Ferinject®/Injectafer®) и железа (III) гидроксид олигоизомальтозат 1000 (Monofer®). Эти препараты считаются эквивалентными по эффективности, но большинство из них имеет ограничения в дозировке, введению (продолжительность и частота) и профилю безопасности. Высокомолекулярный декстран железа был связан с повышенным риском анафилаксии/анафилактоидных реакций и не используется в Европе1-5. Эти побочные эффекты значительно меньше у низкомолекулярного декстрана железа1-4, однако он требует введения тестовой дозы и продолжительной инфузии (от четырех до шести часов для больших доз)6. Железа глюконат, железа сахарат и ферумокситол (доступен только в США и применяется только у больных с ХБП) могут быть введены только в умеренных дозах, так как они ограничены максимальной общей разовой дозой 125 мг, 200 мг и 510 мг, соответственно7-9. Кроме того, лечение железа сахаратом в Европе требует введения тестовой дозы8, и сопровождается острым увеличением протеинурии при еженедельной инфузии дозы 100 мг10,11. Введение железа глюконата также
сопровождается мягкой транзиторной протеинурией у больных ХБП11 .
Железа карбоксимальтозат не требует тестовой дозы и его можно вводить в дозах 20мг/кг, максимально до 1000 мг за одно введение . Но железа карбоксимальтозат вызывал при инфузии гипофосфатемию неизвестной этиологии. Клиническое значение гипофосфатемии неизвестно. Новейший препарат для парентерального введения, железа (III) гидроксид олигоизомальтозат 1000 (Monofer®), был введен в Европе в 2010 году. Целью разработки железа (III) гидроксид олигоизомальтозата 1000 было создание эффективного препарата парентерального железа с благоприятным профилем безопасности, без тестовой дозы и без ограничений дозы для оптимизации гибкости применения и удобства пользователя. Железа (III) гидроксид олигоизомальтозат 1000 отвечает этим требованиям: его можно вводить в максимальной дозе 20 мг/кг, без пробной дозы, за 30-60 минут в течение одного посещения. Благодаря предлагаемой гибкости дозы, возможность полной коррекции запасов железа за одну инфузию делает его весьма удобным как для медицинских специалистов, так и для пациентов. В настоящем обзоре описаны физико-химические характеристики, фармакологические, фармакокинетические и иммуногенные свойства, доклинические и клинические данные, и анализ затрат по лечению железа (III) гидроксид олигоизомальтозатом 1000.
Физико-химические характеристики железа (III) гидроксид олигоизомальтозата 1000
Железа (III) гидроксид олигоизомальтозат 1000 состоит из железа и углеводного фрагмента. Углевод олигоизомальтозат 1000 состоит преимущественно из 3-5 единиц глюкозы, относится к изомальто-олигосахаридам и образуется путем гидролиза декстрана с последующим его фракционированием и химической модификацией, чтобы получить продукт с требуемой молекулярной массой. В дальнейшем олигоизомальтозат 1000 выделяют после химического взаимодействия восстанавливающих остатков сахаров, чтобы избежать осложнений из-за окислительно-восстановительных реакций или деградации альдегидной группы в аномерном центре. Отсутствие восстанавливающего сахара предотвращает любые сложные окислительно-восстановительные реакции и, тем самым, деградацию комплексов железамолекулярной массой. В дальнейшем олигоизомальтозат 1000 выделяют после химического взаимодействия восстанавливающих остатков сахаров, чтобы избежать осложнений из-за окислительно-восстановительных реакций или деградации альдегидной группы в аномерном центре. Отсутствие восстанавливающего сахара предотвращает любые сложные окислительно-восстановительные реакции и, тем самым, деградацию комплексов железа16. Помимо различия в молекулярной массе между декстранами у железа декстрана и олигоизомальтозата 1000, последний также полностью свободен от каких-либо разветвлений структуры, как свидетельствует 13С-и 1Н-ЯМР спектроскопический анализ, и не содержит восстанавливающих остатков сахаров15 . Таким образом, хотя олигоизомальтозат 1000 изготавливается путем химической модификации и гидролизом декстрана, он не является декстраном. Химическая структура олигоизомальтозата 1000 значительно отличается от структуры декстрана, в которой б-(1,3)-связанные ветви молекулы закручены вокруг основной цепи б-(1,6)-связанного полимера плотной спиральной структурой15 . В то же время изомальтозат (1000) имеет чисто линейные олигомеры структуры б-(1,6)-связанных глюкопиранозных остатков, в среднем повторяющихся 5,2 раза, и не содержит восстанавливающих сахарных остатков.
Электронная микроскопия16 определяет наноструктуру железа олигоизомальтозата 1000 в виде шара, в то время как 13С-ЯМР и связанное с ним молекулярное моделирование показало, что он имеет матричную структуру, в которой атомы железа преимущественно связаны и диспергированы в матрице. Поскольку масса каждого компонента известна, можно рассчитать, что в молекуле олигосахарида связаны между собой примерно 10 атомов железа. Пока еще не доказано, составляют ли они один координированный фрагмент оксида железа, или это небольшие группы скоординированного оксида железа. Матрица железа олигоизомальтозата 1000 состоит из следующих друг за другом слоёв линейного олигоизомальтозата 1000 с атомами железа, помещенными в полости между и внутри молекул олигосахара15. Матричная структура способствует контролируемому и медленному высвобождению железа, которое соединяется с железо-связывающими белками с минимальным риском токсичности свободного железа (рис. 1). Это уникальная структура отличается от других продуктов железа, которые описаны в виде чистого ядра из железа, окруженного оболочкой углеводов. Формирование такой молекулярной матричной структуры возможно из-за короткой, линейной и неионной структуры олигоизомальтозата 1000, сочетающейся с производственной технологией комплексирования железа и олигоизомальтозата 1000.
Железо сильно связано в молекуле железа олигоизомальтозата 1000; оценка раствора железа олигоизомальтозата 1000, эквивалентного вводимому пациентам, показала очень низкие концентрации свободного железа, близкие к порогу чувствительности метода (рис. 2). Похожая низкая концентрация свободного железа была обнаружена для ферумокситола, в то время как концентрации свободного железа в растворах декстрана железа и железа карбоксимальтозата были значительно выше15. Измерение лабильного железа выявило, что новые препараты железа (железа карбоксимальтозат, ферумокситол и железа (III) гидроксид олигоизомальтозат 1000) имеют низкое содержание лабильного железа по сравнению с более старыми препаратами (декстран железа << железа сахарат и глюконат железа)15 . Иммуногенные свойства (III) гидроксид олигоизомальтозата 1000 (III) гидроксид олигоизомальтозата 1000
Анафилактоидные/анафилактические реакции могут развиваться на все парентеральные соединения железа, и были отмечены относительно часто при использовании старых препаратов высокомолекулярного декстрана железа. Патогенетические механизмы этих реакций не совсем ясны, но, вероятно, они происходят как за счет специфической, так и неспецифической иммунной реакции с углеводным носителем, играющим важную роль для этих реакций16. Таким образом, одной из важных целей разработки железа (III) гидроксид олигоизомальтозата 1000 было создание продукта с низким риском анафилактоидных/анафилактических реакций. Для достижения этой цели был создан углеводный носитель с низким иммуногенным потенциалом. В составе железа (III) гидроксид олигоизомальтозата 1000 находится углевод-носитель, олигоизомальтозат 1000, основанный на химической модификации олигомеров и созданный для предотвращения вызываемых декстраном анафилактических реакций.
Поскольку хорошо известно, что гомополимеры глюкозы имеют очень низкий иммуногенный потенциал17, при создании продукта любые остаточные ответвления, которые были .-связаны с 3′-положением основной цепи, были удалены, а восстанавливающий остаток сахара химически преобразован количественно в невосстанавливающую группу.
Таким образом, с теоретической точки зрения, иммуногенный потенциал железа (III) гидроксид олигоизомальтозата 1000, как ожидается, будет очень низким, в связи с чем при создании протокола первых клинических исследований железа (III) гидроксид олигоизомальтозата 1000 решили, что тестовая доза не потребуется. Эти исследования поддерживают теоретическое обоснование низкой иммуногенной активности, и поэтому железа (III) гидроксид олигоизомальтозат 1000 был одобрен для использования без тестовой дозы.
Фармакологические и фармакокинетические свойства железа (III) гидроксид олигоизомальтозата 1000
После внутривенного введения железа (III) гидроксид олигоизомальтозат 1000 быстро поглощается клетками ретикулоэндотелиальной системы (РЭС), особенно печени и селезенки, откуда железо медленно высвобождается. Период полураспада в плазме составляет 5 ч для железа в системном кровотоке и 20 ч — суммарно для связанного и находящегося в системном кровотоке железа. Циркулирующее железо утилизируется клетками РЭС, которые расщепляют комплекс на железо и олигоизомальтозу. Железо немедленно связывается и хранится, в основном, в виде ферритина. Оно пополняет гемоглобин и обедненные запасы железа. Незначительное количество железа выводится с мочой и фекалиями. Из-за размера наночастиц (20,5 нм), железа (III) гидроксид олигоизомальтозат 1000 не выводится через почки. Углеводный компонент – олигоизомальтозата 1000 – либо метаболизируется, либо выводится в неизмененном виде через почки14 .
Для оценки фармакокинетики было проведено открытое, перекрестное, одноцентровое исследование у 12 больных (5 мужчин/7 женщин) с воспалительными заболеваниями кишечника18 . Пациентам однократно или двукратно вводили железа (III) гидроксид олигоизомальтозат 1000 в виде разовой болюсной дозы 100 мг или 200 мг с четырехнедельным интервалом между двумя дозами. Скорость введения составляла максимум 50 мг железа/мин. Фармакокинетические переменные были проанализированы на содержание общего железа (ОЖ), олигоизомальтозат-связанного железа (ИСЖ) и трансферрин-связанного железа (ТСЖ) согласно однопуловой модели. ОЖ и ТСЖ были измерены на химическом анализаторе Advia с помощью угольной атомной абсорбционной спектрометрии и фотометрии, соответственно. ИСЖ определяли как разницу между ТСЖ из ОЖ при условии, что не было выявлено свободное железо и что количество ферритина незначимо, то есть железо присутствовало в плазме только в форме ОЖ, ТСЖ и ИСЖ. Зависимость концентрации от времени для ИСЖ и ОЖ показала фармакокинетику первого порядка с небольшими отклонениями для доза-линейности. Параметры фармакокинетики для ИСЖ были близки к ОЖ (табл. 1). Таким образом, ОЖ может быть использовано в качестве маркера фармакокинетики железа (III) гидроксид олигоизомальтозата 1000 в будущих фармакокинетических исследованиях. Только около 1% от вводимой дозы было экскретировано с мочой. Один пациент был исключен из исследования после получения дозы 100 мг из-за боли в животе и лихорадки. Никаких серьезных побочных эффектов (СНЯ) зафиксировано не было18 .
В настоящее время продолжаются несколько фармакокинетических исследований с более высокими дозами железа (III) гидроксид олигоизомальтозата 1000 в разных группах пациентов (клинические протоколы: NCT01213979, NCT01280240, NCT01213992, NCT01469078 и NCT01213680).
Эффективность и профиль безопасности железа (III) гидроксид олигоизомальтозата 1000
В недавнем прошлом эффективность и безопасность железа (III) гидроксид олигоизомальтозата 1000 в лечении ЖДА были исследованы в двух клинических исследованиях III фазы у пациентов с ХБП и хронической сердечной недостаточностью 19,20
(ХСН) . Первичной конечной точкой этих исследований было установить профиль безопасности железа (III) гидроксид олигоизомальтозата 1000, эффективность была вторичной конечной точкой. Оба исследования были открытыми, несравнительными, многоцентровыми, где пациенты были шестикратно обследованы в течение восьминедельного периода исследования. По усмотрению исследователя железа (III) гидроксид олигоизомальтозат 1000 вводили одним из двух способов. Либо как четыре повторяющиеся внутривенные болюсные инъекции 100-200 мг железа на одно введение в начале и затем через 1, 2, и 4 недели (последняя доза может быть введена в виде общей оставшейся дозы, если общая расчетная потребность в железе превышала 800 мг). Либо в виде одноразовой высокодозной коррекции железа в начале исследования (инфузия общей дозы (ИОД)). Если требуемая ИОД превышала 20 мг железа/кг, доза была разделена на два посещения, и вводилась с интервалом в одну неделю. Тестовая доза не применялась. Общая рассчитанная потребность в железе и назначенная кумулятивная доза для каждого пациента определялись, исходя из значения гемоглобина 130 г/л с использованием формулы Ganzoni, которая отражает массу тела, разность между фактическим и целевым гемоглобином и требуемый уровень запасов железа (обычно 500 мг)й уровень запасов железа (обычно 500 мг)21. Оценка безопасности проводилась по типу и частоте нежелательных явлений (НЯ) и серьезных нежелательных явлений (СНЯ), изменений жизненно важных признаков, включая электрокардиограмму (ЭКГ), и клинические лабораторные анализы (биохимия: натрий, калий, креатинин, альбумин, мочевина, билирубин и аланинтрансфераза, гематология: лейкоциты, подсчет лейкоформулы и тромбоцитов) через 1, 2, 4 и 8 недель после инициального уровня. Оценка эффективности включала лабораторный мониторинг влияния лечения на уровень гемоглобина, коэффициент насыщения трансферрина (КНТ) и уровень ферритина через 1, 2, 4 и 8 недель после базового уровня. Кроме того, в исследование ХСН было включено сывороточное железо, которое контролировалось в тех же точках времени, шкала линейной аналоговой оценки, вопросник определения качества жизни через 4 и 8 недель после базового уровня. Шкала линейной аналоговой оценки является утвержденным инструментом оценки качества жизни, состоящим из 100-мм линейной аналоговой шкалы, определяющей уровень энергии пациента, способность выполнять повседневную нагрузку и общее качество жизни.
Железа (III) гидроксид олигоизомальтозат 1000 у пациентов с хронической болезнью почек
Исследование проводилось в 15 центрах в трех европейских странах (шесть -в Дании, семь -в Швеции и два -в Великобритании). В общей сложности были включены 182 пациента с ХБП (128 мужчин/54 женщины): на гемодиализе (n=161) и в додиализной стадии (n=21). Подавляющее большинство пациентов получали гемодиализ. Пациенты, как правило, получали лечение ЭСА (n =82%), и дозировка ЭСА поддерживалась постоянной в течение исследования. Пациенты либо были переведены с имевшейся парентеральной терапии железом (n=144), либо не лечились препаратами железа (n=38). Среднее значение ±SD возраста составило 63,3±13,8 лет (диапазон 21-91 лет). Пациенты, не получавшие лечения парентеральным железом на момент включения в исследование, имели исходный гемоглобин 99,1±9,0 г/л и ферритин -231±154 мкг/л, а пациенты, которые были переведены (конвертированы) с других препаратов железа, имели исходный гемоглобин 114,9±10,3 г/л и ферритин -380±195 мкг/л. Среднее значение±SD общей накопленной дозы железа на одного пациента составляло 529±283 мг19 . В общей сложности было выполнено 584 введения препарата (523 болюсно по 100 мг, 17 болюсно 100-200 мг и 44 ИОД) с одной дозой до 1800 мг22.
Девятнадцать НЯ возможно были связаны с исследуемым препаратом. Не было никаких различий по частоте НЯ, описанных у пациентов с болюсными дозами или ИОД. Три пациента (1,6%) имели более одного НЯ, связанного с приемом препарата: один пациент отмечал два эпизода тошноты; другой пациент имел диарею, гриппоподобное состояние, гипергидроз, боль в суставах и низкий ферритин; у третьего пациента зафиксирована геморрагическая киста в правой почке и зуд. Два из НЯ, которые были определены лечащим врачом как возможно связанные с лечением, соответствовали критериям для СНЯ. Это были сепсис с золотистым стафилококком и нестабильная стенокардия. Две смерти (одна по неизвестной причине и другая -вследствие пневмонии), были расценены как несвязанные с исследуемым препаратом. Не описано острых анафилактических/анафилактических реакций или аллергической реакции замедленного типа. Не было никаких клинически значимых изменений со стороны жизненно важных органов или рутинных клинических лабораторных исследований безопасности.
Через 8 недель у пациентов, не получавших до начала исследования парентерального железа, гемоглобин увеличился с базового уровня 99,2±9,0 г/л до 111,2 г/л±14,7 (р<0,001); у пациентов, получавщих поддерживающую терапию железом, гемоглобин незначительно увеличивался или оставался стабильным и при исходном значении 114,9±10,3 г/л достигал 117,5±11,7 г/л через 8 недель, (р=0,05). Среднее значение ±SD максимального увеличения гемоглобина в общей популяции ХБП составило 7,9±9,9 г/л (р<0,001). КНТ и ферритин также значительно увеличились по сравнению с исходными через 8 недель (р<0,001). Был сделан вывод, что назначение железа (III) гидроксид олигоизомальтозата 1000 пациентам с ХБП в виде повторных болюсных инъекций или ИОД без тестовой дозы, было безопасным, хорошо переносилось, и приводило к улучшению показателей обмена железа и анемии19 . Железа (III) гидроксид олигоизомальтозат 1000 у пациентов с хронической сердечной недостаточностью
Исследование проводилось в семи центрах в двух европейских странах (четыре – в Дании, три – в Швеции). В общей сложности были включены 20 больных с ХСН (10 мужчин/10 женщин) с умеренной степенью тяжести анемии. Ни один из пациентов не получал лечения ЭСА.
Средний возраст составил 75 лет (диапазон 61-88 лет). Исходный гемоглобин составил 108,2±7,6 г/л, ферритин 180±184 мкг/л. Все 20 пациентов получили однократную высокодозную инфузию со средним временем введения 59,8 минут (диапазон 50-67 минут) в средней дозе 868 мг (диапазон 650-1000 мг).
Не было сообщено ни одного случая летального исхода, острой анафилактической/анафилактоидной или замедленной аллергической реакции. Не было выявлено никаких клинически значимых изменений в обычных (рутинных) клинических лабораторных исследованиях безопасности или в жизненно важных функциях. Клинически значимые изменения ЭКГ наблюдались в 13 случаях, но это не было проявлением новой болезни или прогрессирования заболевания, а объяснены анамнезом соматических заболеваний пациентов.
Гемоглобин возрастал при каждом визите по сравнению с исходным уровнем, однако рост был незначительным из-за небольшого числа наблюдений. По сравнению с базовым значением, ферритин значительно возрастал во время всех визитов, в то время как статистическое увеличение железа и КНТ наблюдалось через неделю после начала исследования. Все оценки качества жизни значимо улучшились через четыре недели после начала исследования: эмпирическое значение «уровня энергии» увеличилось на 49%, «возможность проявлять повседневную активность» -на 38%, а «общее качество жизни» -на 23%. Через восемь недель результаты возросли на 34%, 20% и 13%, для каждого из этих параметров, соответственно, но статистическая значимость была достигнута только для «энергетического уровня». Несмотря на отсутствие контрольной группы в дизайне исследования и небольшой размер выборки, авторы пришли к выводу, что железа (III) гидроксид олигоизомальтозат 1000 хорошо переносился и улучшил качество жизни у всех 20 пациентов с ХСН. 1000 хорошо переносился и улучшил качество жизни у всех 20 пациентов с ХСН.
Высокодозная инфузия железа (III) гидроксид олигоизомальтозата 1000
Как уже обсуждалось, железа (III) гидроксид олигоизомальтозат 1000 может быть введен в больших дозах без тестовой дозы вследствие его низкой иммунологической активности и низкого риска токсичности свободного железа. Были выполнены три субанализа безопасности и эффективности параметров исследований у пациентов с ХПН и ЗСН, которые получали высокодозную инфузию23-25 .
Первый анализ включал 19 гемодиализных пациентов с ХБП и анемией. Все 19 пациентов получили однократно высокодозную инфузию со средней дозой 986 мг (диапазон: 463-1800 мг) в течение 30-60 минут. В общей сложности 19 НЯ были зарегистрированы у 9 пациентов (47%), но ни одно из них авторы исследования не связали с изучаемым препаратом. Не было выявлено острой анафилактической/анафилактоидной или отсроченной аллергической реакции, также как существенных изменений в клинических лабораторных исследованиях или характеристиках жизненно важных функций. Маркеры эффективности терапии ЖДА значимо улучшились23 .
Второй анализ включал 21 пациента, находящегося на додиализной стадии с ХБП и анемией. Было доложено об одном СНЯ, связанном с исследуемым препаратом. Это был приступ стенокардии у 80-летнего пациента с ХБП, имевшего в анамнезе стенокардию. Приступ произошел через 10-11 дней после того, как пациент получил 1400 мг железа (III) гидроксид олигоизомальтозата 1000. Анамнез болезни пациента и отсроченное время возникновения приступа стенокардии свидетельствуют о весьма маловероятной связи СНЯ с железа (III) гидроксид олигоизомальтозатом 1000. Не было выявлено острой анафилактической/анафилактоидной или отсроченной аллергической реакции, также как существенных изменений в клинических лабораторных исследованиях или характеристиках жизненно важных функций. Маркеры эффективности терапии ЖДА значимо улучшились25 .
Третий анализ состоял из вышеперечисленных 40 пациентов с ХБП и 20 больных с ХСН. В общей сложности 58 из 60 пациентов имели одну высокодозную инфузию, и только у двух пациентов с ХБП потребовалось два приема для того, чтобы восполнить их потребности в железе. Средняя доза была 975 мг (диапазон: 462-1800 мг) для пациентов с ХБП и 868 мг (диапазон: 650-1000 мг) для пациентов с ХСН. Было доложено об одном СНЯ, приступе стенокардии, о котором указано выше. Не было выявлено острой анафилактической/анафилактоидной или отсроченной аллергической реакции, также как существенных изменений в клинических лабораторных исследованиях или характеристиках жизненно важных функций. Маркеры эффективности терапии ЖДА значимо улучшились24 .
В заключение надо сказать, что железа (III) гидроксид олигоизомальтозат 1000, вводимый в высоких дозах, безопасен для больных ХБП и ХСН, хорошо переносится и эффективен в улучшении маркеров ЖДА.
Железа (III) гидроксид олигоизомальтозат 1000 и нефротоксичность
Было высказано предположение, что парентеральное железо может оказывать прямое токсическое действие на клетки почечных канальцев, которое может привести к почечной потере фосфатае токсическое действие на клетки почечных канальцев, которое может привести к почечной потере фосфата26,27. В 2004 году Zager и др. сообщили об исследовании сравнения нефротоксичности железа сахарата, железа глюконата, декстрана железа и железа (III) гидроксид олигоизомальтозата 1000 в широком диапазоне доз (от 30 до 1000 железа мкг/мл)28 . Препараты железа были добавлены в изолированные проксимальные отделы канальцев почек мыши и культуру проксимальных канальцев клеток почки человека. Повреждение клеток оценивали по высвобождению лактатдегидрогеназы, уменьшению АТФ (аденозин-трифосфат), выделению клеточного цитохрома С, и/или электронной микроскопии. Препараты железа различались по тяжести токсичности in vitro в 30 раз. Самая высокая токсичность наблюдалась у железа сахарата, самая низкая -у декстрана железа и железа (III) гидроксид олигоизомальтозата 1000 (железа сахарат> глюконат железа >> декстран железа= железа (III) гидроксид олигоизомальтозат 1000). Большие различия можно объяснить разницей в способности железа получать внутриклеточный доступ. По данным просвечивающей электронной микроскопии, наноструктуры декстрана железа и железа (III) гидроксид олигоизомальтозата 1000 большие и глобулярные, в то время как железа сахарат и железа глюконат являются лучше растворимыми и значительно отличаются по форме наноструктуры: они мельче и более удлиненные15 .
Аналогичные данные обнаружены в корреляциях токсичности железа in vivo у мышей, которая включала увеличение почечного малонового диальдегида, почечного ферритина и экспрессии гемоксигеназы-1. Эти изменения также проявлялись in vivo параллельно клубочковому поглощению железа (выявлено для железа сахарата и железа глюконата, но не для декстрана железа и железа (III) гидроксид олигоизомальтозата 1000)28 .
Железа (III) гидроксид олигоизомальтозат 1000 и сывороточный фосфат
Поскольку было установлено, что использование некоторых парентеральных препаратов железа связано с гипофосфатемией13,26,27,29-32 , то в нескольких продолжающихся клинических исследованиях изучается влияние железа (III) гидроксид олигоизомальтозата 1000 на сывороточный фосфат, а также выполнен промежуточный анализ фосфата как часть этих протоколов. В настоящее время этот промежуточный анализ включает 25 онкологических больных (NCT01145638 – протокол онкологического исследования) и 50 пациентов с недиализной стадией ХБП (NCT01102413 -протокол NDD-CKD исследования), получавших железа (III) гидроксид олигоизомальтозат 1000.
Анализ фосфата входит в состав фазы III двух проспективных открытых рандомизированных сравнительных исследований. В общей сложности 350 пациентов с диагнозом немиелоидного рака и 350 NDD-CDK пациентов с почечной анемией в настоящее время рандомизированы в соотношении 2:1 на группы для внутривенного введения железа (III) гидроксид олигоизомальтозата 1000 (группа А) или орального приема сульфата железа (группа Б). Пациенты в группе А равномерно разделены на две подгруппы (A1 и A2). Группа А1 получала внутривенно железа (III) гидроксид олигоизомальтозат 1000 в полной замещающей дозе железа в виде инфузии максимум 1000 мг железа (III) гидроксид олигоизомальтозата 1000 в течение 15 минут до достижения полного восполнения запасов железа. Группа A2 получала болюсные инъекции 500 мг железа (III) гидроксид олигоизомальтозата1000 в течение 2 минут, один раз в неделю до достижения полного восполнения запасов железа. Группа B получала внутрь 200 мг сульфата железа ежедневно в течение 8-12 недель. Для каждого отдельного пациента продолжительность исследования составляла 8-10 недель для NDD-CKD исследования и 24-26 недель в онкологическом исследовании. Сывороточный фосфат определялся до назначения железа и при каждом визите. В начале онкологического исследования уровень сывороточного фосфата составлял 4,0±0,9 мг/дл в группе A1 и A2, и 3,6±0,6 мг/дл в группе В, а в NDD-CKD исследовании уровень сывороточного фосфата был 4,5±0,9 мг/дл в группе A1 и A2, и 4,3±0,9 мг/дл в группе В.
Группа B получала внутрь 200 мг сульфата железа ежедневно в течение 8-12 недель. Для каждого отдельного пациента продолжительность исследования составляла 8-10 недель для NDD-CKD исследования и 24-26 недель в онкологическом исследовании. Сывороточный фосфат определялся до назначения железа и при каждом визите. В начале онкологического исследования уровень сывороточного фосфата составлял 4,0±0,9 мг/дл в группе A1 и A2, и 3,6±0,6 мг/дл в группе В, а в NDD-CKD исследовании уровень сывороточного фосфата был 4,5±0,9 мг/дл в группе A1 и A2, и 4,3±0,9 мг/дл в группе В.
При промежуточном анализе не было никаких существенных изменений в сывороточном фосфате в любой из групп, получавших лечение внутривенно, как в онкологическом, так и в NDD-исследовании. Средние (95% ДИ) значения фосфата для трех групп показаны на рис. 3 (онкологическое исследование) и рис. 4 (NDD-CKD исследование). В других исследованиях уровни фосфата ниже 2 мг/дл рассматривались как индикатор гипофосфатемии13,32. В исследованиях по железа (III) гидроксид олигоизомальтозату 1000 у 3 из 75 пациентов произошло снижение фосфата со значением чуть ниже 2 мг/дл после лечения. Первым был NDD-CKD пациент, получивший инфузию 1000 мг железа (III) гидроксид олигоизомальтозата 1000. Пациент имел уровень фосфата 1,8 мг/дл через три недели после начала исследования. Вторым был онкологический пациент, также получавший инфузию 1000 мг. Этот пациент имел уровень фосфата 1,9 мг/дл через одну и четыре недели после начала исследования. Третьим был онкологический пациент с двумя болюсными инъекциями (500 мг + 250 мг железа (III) гидроксид олигоизомальтозата 1000). Пациент уже имел низкий уровень фосфата на отборочном визите (2,0 мг/дл), и через четыре недели после начала исследования его уровень составил 1,9 мг/дл. У всех трех пациентов уровень фосфата нормализовался при последующих посещениях и не было зарегистрировано никаких
неблагоприятных воздействий.
Предварительные данные свидетельствуют, что вряд ли будет обнаружен клинически значимый гипофосфатемический эффект, связанный с лечением железа (III) гидроксид олигоизомальтозатом 1000.
Было высказано предположение, что гипофосфатемия, связанная с парентеральными препаратами железа, может быть опосредована путем фактора роста фибробластов 23 (FGF23) 29,33-35 , однако, еще предстоит выяснить причину различий в гипофосфатемическом эффекте, наблюдаемом у различных парентеральных препаратов железа, и клинические исследования должны быть продолжены.
Анализ затрат по лечению железа (III) гидроксид олигоизомальтозатом 1000
В клиническом центре Великобритании провели анализ затрат по лечению железа (III) гидроксид олигоизомальтозатом 1000 и железа карбоксимальтозатом по сравнению со стандартными процедурами (переливание крови, железа сахарат, низкомолекулярный декстран железа) путем сравнения затрат на лечение, включающее расходы на услуги медицинской сестры, связанные с введением препарата, оборудование для инфузии и транспортировку пациентов36, 37. Лечение включало три уровня доз общего железа: 600 мг, 1000 мг и 1600 мг для каждого из трех препаратов железа. Данный анализ показал, что лечение железа (III) гидроксид олигоизомальтозатом 1000 может обеспечить значительную суммарную экономию по сравнению с переливанием крови, железа сахаратом и железа карбоксимальтозатом при всех трех уровнях дозы (рис. 5). Для доз 600 мг и 1000 мг железа
(III) гидроксид олигоизомальтозат 1000 был также дешевле, чем низкомолекулярный декстран железа, но более дорог в дозе 1600 мг. Однако низкомолекулярный декстран железа вводят в течение шести часов, что неудобно для пациента и снижает продуктивность (производительность отделения)36,37. Эти данные свидетельствуют, что железа (III) гидроксид олигоизомальтозат 1000 может иметь ценовое преимущество по сравнению с другими препаратами парентерального железа, в основном потому, что высокие дозы могут быть введены в течение короткого времени инфузии и без тестовой дозы.
Дальнейшая клиническая программа для железа (III) гидроксид олигоизомальтозата 1000
Существенная дополнительная программа клинических исследований была инициирована для дальнейшего изучения полного клинического и фармакоэкономического профиля железа (III) гидроксид олигоизомальтозата 1000. Эта программа включает в себя текущие и планируемые контролируемые исследования сравнительной эффективности и безопасности в гастроэнтерологии, нефрологии, онкологии, гинекологии, хирургии, и при дефиците железа без анемии (клинические протоколы: NCT01145638, NCT01102413, NCT01222884, NCT01017614, NCT01410435, NCT01213979 , NCT01280240, NCT01213992, NCT01469078 и NCT01213680). Планируется обширная фармакологическая программа клинического применения доз 100 мг, 200 мг, 500 мг и 1000 мг в отдельных терапевтических популяциях. В сущности, эта обширная программа предназначена для будущего, так как она нацелена на безопасность и удобство быстрых, высоких доз монотерапии и уменьшает скорость инфузии до 2 мин для высокодозных болюсов и до 15 минут для инфузий высоких доз в текущих клинических исследованиях. Кроме того, программа применяет как традиционные, так и инновационные конечные точки в отношении эффективности, а также фокусируется на фармакоэкономических преимуществах.
Заключение
Новые препараты железа в идеале должны быть способны предоставлять широкий спектр дозирования, чтобы позволять за одно посещение восполнять запасы железа без требования тестовой дозы, быстро вводиться, и давать минимальные возможные побочные эффекты, в том числе низкое высвобождение лабильного железа и незначительный риск анафилаксии. Кроме того, они должны быть удобны для пациента и медицинского работника, и экономически эффективны для системы здравоохранения. Намерение при создании железа (III) гидроксид олигоизомальтозата 1000 было продиктовано необходимостью выполнения эти требования. Что и было достигнуто путем осаждения железа при высокой концентрации в матрице изомальтозатного олигосахарида, свободного от декстрана гомополимера из частиц глюкозы с благоприятными освобождающими свойствами и низкой иммуногенностью. Железа (III) гидроксид олигоизомальтозат 1000 показал эффективность в лечении ЖДА, очень низкий иммуногенный потенциал, очень низкое содержание лабильного и свободного железа, и, вероятно, он не вызывает гипофосфатемию. Железа (III) гидроксид олигоизомальтозат 1000 – единственный парентеральный препарат железа, который может быть введен без необходимой в других случаях тестовой дозы в виде быстрой инфузии высоких доз и в дозах, превышающих 1000 мг. Таким образом, железа (III) гидроксид олигоизомальтозат 1000 является экономически эффективным парентеральным препараом железа с высокой гибкостью дозы и возможностью предоставления полного восполнения запасов железа за одно посещение, оптимизируя тем самым удобство применения для медицинского работника и пациента. Железа (III) гидроксид олигоизомальтозат 1000 – единственный парентеральный препарат железа, который может быть введен без необходимой в других случаях тестовой дозы в виде быстрой инфузии высоких доз и в дозах, превышающих 1000 мг. Таким образом, железа (III) гидроксид олигоизомальтозат 1000 является экономически эффективным парентеральным препараом железа с высокой гибкостью дозы и возможностью предоставления полного восполнения запасов железа за одно посещение, оптимизируя тем самым удобство применения для медицинского работника и пациента.
Заявление о конфликте интересов. Профессор P.Kalra получил гонорар за лекции и консультативное участие Совета директоров от Pharmacosmos, Vifor, и Takeda/ Профессор K.Bock получил гонорар от Pharmacosmos за консультативную работу. Профессор М.Meldal заявляет об отсутствии конфликтов интересов.
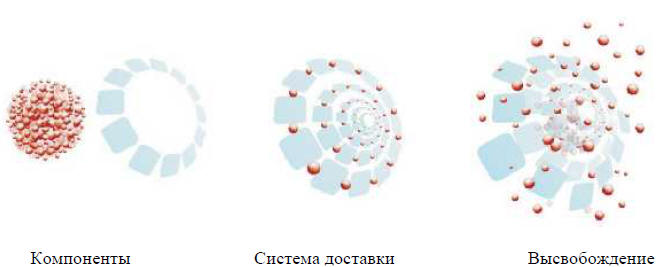
Рисунок 1. Матричная структура железа (III) гидроксид олигоизомальтозата 1000, способствующая контролируемому и медленному высвобождению железа.
Результаты представлены без поправки на pH. Предел определения -0,002%. (Модифицировано из Jahn et al., 2011 (ссылка16)).
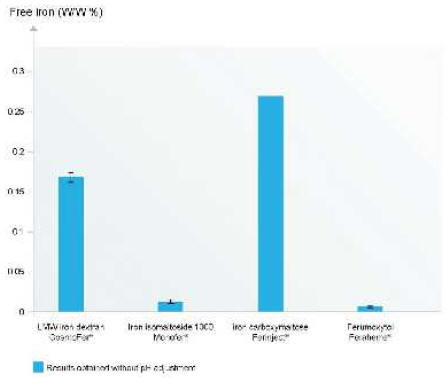
Рисунок 2. Сравнительное содержание свободного железа в высокодозных препаратах железа для внутривенного применения
Таблица 1. Средние геометрические (CV в %) для фармакокинетических параметров изомальтозат-связанного железа (ИСЖ), общего железа (ОЖ) и трансферрин-связанного железа (ТСЖ)
![]()
Группа А1 получала инфузии железа (III) гидроксид олигоизомальтозата 1000, группа А2 получала болюсное введение железа (III) гидроксид олигоизомальтозата 1000, группа В получала пероральный железа сульфат (Фармакосмос, A/S).

Рисунок 3. Средние (95% Cl) значения фосфата у онкологических пациентов в течение 24недельного периода исследования.
Группа А1 получала инфузии железа (III) гидроксид олигоизомальтозата 1000, группа А2 получала болюсное введение железа (III) гидроксид олигоизомальтозата 1000, группа В получала пероральный железа сульфат (данные файла, Фармакосмос, A/S).
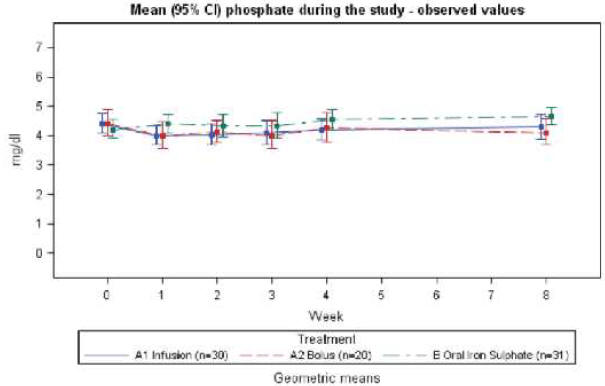
Рисунок 4. Средние (95% Cl) значения фосфата у пациентов с NDD-ХБП в течение 8недельного периода исследования.

Рисунок 5. Сравнение различий стоимости (%) для железа (III) гидроксид олигоизомальтозата по сравнению с железа сахаратом, низкомолекулярным декстраном и железа карбоксимальтозатом, назначаемых в трех различных дозировках (600 мг, 1000 мг и 1600 мг).
Положительная разница в стоимости свидетельствует об экономии средств при назначении железа (III) гидроксид олигоизомальтозата 1000. Анализ включал расходы на лечение с учетом затрат на работу медицинской сестры, стоимость расходных материалов для инфузии (введения), транспортировку пациента. (Модифицировано по Bhandari, 2011 (ссылка 37)). (введения), транспортировку пациента. (Модифицировано по Bhandari, 2011 (ссылка 37)).
Сайт препарата Монофер — www.monofer.ru
Список литературы.
1. McCarthy JT, Regnier CE, Loebertmann CL, Bergstralh EJ. Adverse events in chronic hemodialysis patients receiving intravenous iron dextran–a comparison of two products. Am J Nephrol 2000;20:455-62
2. Fletes R, Lazarus JM, Gage J, Chertow GM. Suspected iron dextran-related adverse drug events in hemodialysis patients. Am J Kidney Dis 2001;37:743-9
3. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. On the relative safety of paren-teral iron formulations. Nephrol Dial Transplant 2004;19:1571-5
4. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug events associated with parenteral iron. Nephrol Dial Transplant 2006;21:378-82
5. Fishbane S. Safety in iron management. Am J Kidney Dis 2003;41(5 Suppl):18-26
6. Low molecular weight iron dextran (Cosmofer®) summary of product characteristics, dated 27 January 2010
7. Ferrlecit® product monography, dated 6 November 2009
8. Iron sucrose (Venofer®) summary of product characteristics, dated 30 March 2011
9. Ferumoxytol (Feraheme) prescribing information, dated June 2011
10. Agarwal R, Rizkala AR, Kaskas MO, Minasian R, Trout JR. Iron sucrose causes greater proteinuria than ferric gluconate in non-dialysis chronic kidney disease. Kidney Int 2007;72:638-42
11. Agarwal R, Leehey DJ, Olsen SM, Dahl NV. Proteinuria induced by parenteral iron in chronic kidney disease–a comparative randomized controlled trial. Clin J Am Soc Nephrol 2011;6:114-21
12. Ferric carboxymaltose (Ferinject®) summary of product characteristics, dated 25 Octo-ber 2011
13. FDA Advisory Committee Briefing Document, Drug Safety and Risk Management Committee, 1 February 2008. Division of Medical Imaging and Hematology Products and Office of Oncology Drug Products and Office of New Drugs, New Drug Application (NDA) 22-054 for Injectafer (Ferric Carboxymaltose) for the treatment of iron defi-ciency anemia in patients with heavy uterine bleeding or postpartum patients.
14. Iron Isomaltoside 1000 (Monofer®) summary of product characteristics, dated 26 March 2010
15. Jahn MR, Andreasen HB, Futterer S, Nawroth T, Schunemann V, Kolb U, et al.A comparative study of the physicochemical properties of iron isomaltoside 1000 (Monofer®), a new intravenous iron preparation and its clinical implications. Eur J Pharm Biopharm 2011;78:480-91
16. Macdougall IC. Evolution of iv iron compounds over the last century. J Ren Care 2009;35 Suppl 2:8-13
17. Goldsby R.A., Kindt T.J., Osborn B.A. Immunology. 5th ed. NY: WH Freeman and Co; 2003
18. Nordfjeld K, Andreasen H, Thomsen LL. Pharmacokinetics of iron isomaltoside 1000 in patients with inflammatory bowel disease. Drug Des Devel Ther 2012;6:43-51
19. Wikstrom B, Bhandari S, Barany P, et al. Iron isomaltoside 1000: a new intravenous iron for treating iron deficiency in chronic kidney disease. J Nephrol 2011;24:589-96
20. Hildebrandt PR, Bruun NE, Nielsen OW, et al. Effects of administration of iron isomaltoside 1000 in patients with chronic heart failure. A pilot study. TATM 2010;11:131-7
21. Ganzoni AM. Intravenous iron-dextran: therapeutic and experimental possibilities. Schweiz Med Wochenschr 1970;100:301-3
22. Wikstrom B, Bhandari S, Barany P, Kalra PA, Ladefoged S, Wilske J. Monofer, a novel intravenous iron oligosaccharide for treatment of iron deficiency in patients with chronic kidney disease (CKD). Poster No.M560, World Congress of Nephrology, May 22-26 2009,
Milan, Italy Poster No.M560, World Congress of Nephrology, May 22-26 2009, Milan, Italy
23. Wikstrom B, Bhandari S, Barany P, et al. High single dose infusion of iron isomaltoside 1000 (Monofer®) in hemodialysis patients. Poster at the World Congress of Nephrology, 2011
24. Kalra PA, Bhandari S, Hildebrandt PR, Thomsen LL. High dose infusion of iron isomaltoside 1000 (Monofer®) in CKD and CHF patients. Poster No.Su571 at XLVII ERA-EDTA Congress, Munich, Germany, 25-28 June, 2010
25. Kalra PA, Bhandari S, Thomsen LL. One visit iron repletion with iron isomaltoside 1000(Monofer®) in pre-dialysis CKD patients. Poster No.SA-PO 2349, ASN 43rd Annual Meeting, Denver Colorado, November 2010
26. Sato K, Nohtomi K, Demura H, et al. Saccharated ferric oxide (SFO)-induced osteomal-acia: in vitro inhibition by SFO of bone formation and 1,25-dihydroxy-vitamin D produc-tion in renal tubules. Bone 1997;21:57-64
27. Sato K, Shiraki M. Saccharated ferric oxide-induced osteomalacia in Japan: iron-induced osteopathy due to nephropathy. Endocr J 1998;45:431-9
28. Zager RA, Johnson AC, Hanson SY. Parenteral iron nephrotoxicity: potential mechanisms and consequences. Kidney Int 2004;66:144-56
29. Schouten BJ, Hunt PJ, Livesey JH, Frampton CM, Soule SG. FGF23 elevation and hypophosphatemia after intravenous iron polymaltose: a prospective study. J Clin Endocrinol Metab 2009;94:2332-7
30. Schouten BJ, Doogue MP, Soule SG, Hunt PJ. Iron polymaltose-induced FGF23 elevation complicated by hypophosphataemic osteomalacia. Ann Clin Biochem 2009;46(Pt 2):167-9
31. Okada M, Imamura K, Iida M, Fuchigami T, Omae T. Hypophosphatemia induced by intravenous administration of Saccharated iron oxide. Klin Wochenschr 1983;61:99-102
32. Van Wyck DB, Mangione A, Morrison J, Hadley PE, Jehle JA, Goodnough LT. Large-dose intravenous ferric carboxymaltose injection for iron deficiency anemia in heavy uterine bleeding: a randomized, controlled trial. Transfusion 2009;49:2719-28
33. Durham BH, Joseph F, Bailey LM, Fraser WD. The association of circulating ferritin with serum concentrations of fibroblast growth factor-23 measured by three commercial assays. Ann Clin Biochem 2007;44(Pt 5):463-6
34. Imel EA, Peacock M, Gray AK, Padgett LR, Hui SL, Econs MJ. Iron modifies plasma FGF23 differently in autosomal dominant hypophosphatemic rickets and healthy humans. J Clin Endocrinol Metab 2011;96:3541-9
35. Shimizu Y, Tada Y, Yamauchi M, et al. Hypophosphatemia induced by intravenous administration of saccharated ferric oxide: another form of FGF23-related hypophosphatemia. Bone 2009;45:814-6
36. Bhandari S. A hospital-based cost minimization study of the potential financial impact on the UK health care system of introduction of iron isomaltoside 1000. Ther Clin Risk Manag 2011;7:103-13
37. Bhandari S. Update of a comparative analysis of cost minimization following the introduction of newly available intravenous iron therapies in hospital practice. Ther Clin Risk Manag 2011;7:501-9
Correspondence to:
Dr Philip A. Kalra
Department of Renal Medicine, Salford Royal Hospital Salford, United Kingdom
E-mail: philip.kalra@srft.nhs.uk
материал с сайта MedLinks.ru