Желчный рефлюкс: современные теория и практика
Н.Б. Губергриц, Г.М. Лукашевич, П.Г. Фоменко, Н.В. Беляева
Донецкий национальный медицинский университет им. М. Горького, Украина
В пособие приведены современные литературные данные об этиологии, патогенезе, диагностике, лечении дуоденогастрального, дуоденогастроэзофагеального желчных рефлюксов, которые приводят к развитию рефлюкс-гастрита и рефлюкс-эзофагита.
Авторы проанализировали эндоскопические и гистологические особенности этих патологических состояний. При изложении лечения особое внимание уделено Урсофальку – референтому препарату уросдезоксихолевой кислоты. Приведены результаты доказательных исследований.
Авторы:
Губергриц Наталья Борисовна — д.м.н., профессор, зав. кафедрой внутренней медицины им. А.Я. Губергрица Донецкого национального медицинского университета им. М. Горького (Украина)
Лукашевич Галина Михайловна – к.м.н., ассистент кафедры внутренней медицины им. А.Я. Губергрица Донецкого национального медицинского университета им. М. Горького (Украина)
Фоменко Павел Геннадьевич – к.м.н., доцент кафедры внутренней медицины им. А.Я. Губергрица Донецкого национального медицинского университета им. М. Горького (Украина)
Беляева Надежда Владимировна – к.м.н., ассистент кафедры внутренней медицины им. А.Я. Губергрица Донецкого национального медицинского университета им. М. Горького (Украина)
Оглавление
Каждому удовольствию в жизни, в том числе пищеварению, сопутствует свой привкус горечи.
Ш.Т. Лаво, французский грамматик
Физиологический и патологический желчные рефлюксы
Можно ли всецело согласиться с высказыванием Ш. Т. Лаво (см. эпиграф)? По нашему мнению, в философском смысле он прав: за любое удовольствие нужно чем-то расплачиваться. А вот то, что пищеварению обязательно должна сопутствовать горечь во рту, принять не можем. Основная причина горечи во рту — заброс желчи в верхние отделы пищеварительного тракта и в ротовую полость, т.е. дуоденогастроэзофагеальный рефлюкс (ДГЭР) [7].
Следует признать, что дуоденогастральный рефлюкс (ДГР) может быть как патологическим, т.е. возникать при расстройствах пищеварения с нарушениями моторики, так и физиологическим [23]. В лаборатории И. П. Павлова его сотрудник П. А. Арбеков описал забрасывание в желудок вводимого в двенадцатиперстную кишку (ДПК) жира [1]. В.Н. Болдырев наблюдал регургитацию дуоденального содержимого, при которой панкреатическая липаза попадает в желудок и уже в нем участвует в начальном переваривании жира (рис. 1) [30].
![Рис. 1. Физиологический ДГР (по F. Н. Netter, 2001 [79])](https://medblog.su/wp-content/uploads/2018/08/zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 1. Физиологический ДГР (по F. Н. Netter, 2001 [79])
Ряд авторов считают ДГР защитным механизмом, который позволяет противостоять активизации дремлющей инфекции Helicobacter pylori (Нр). При ослабевании ДГР повышается риск пептической язвы ДПК [5, 13, 22, 37]. Другие авторы, напротив, считают ДГР фактором возникновения и прогрессирования этого заболевания [10, 11, 34, 60]. Еще классики гастроэнтерологии считали ДГР важным патогенетическим механизмом язвенной болезни [9], да и в настоящее время существует термин «билиогенная язва» для обозначения патогенеза заболевания у больных, перенесших холецистэктомию, и/или с выраженным ДГР [33]. Первая точка зрения (протективная роль ДГР) поддерживается результатами суточной интрагастральной рН-метрии 233 больных язвенной болезнью ДПК и 100 здоровых добровольцев, инфицированных Нр [13]. Показано, что ДГР постоянно присутствует у здоровых людей и занимает около 40% времени суток, усиливаясь ночью. У больных с язвенной болезнью ДПК средняя продолжительность рефлюкса вдвое меньше, чем у здоровых людей: для них характерно отсутствие его ночной активации и ограничение преимущественно антральным отделом желудка [13].
И если ДГР, гастроэзофагеальный рефлюкс (ГЭР) в ряде случаев можно считать физиологическими, то ДГЭР — всегда патологический [4].
При патологическом ДГР развивается желчный рефлюкс-гастрит (гастрит типа С), при ДГЭР — желчный рефлюкс-эзофагит [19, 39, 40].
Рефлюкс-гастрит несколько чаще диагностируют у мужчин, чем у женщин, — соотношение составляет 1,5:1. Причем заболевание более характерно для пациентов старше 40 лет. У мужчин 40-60 лет частота рефлюкс-гастрита в два и более раз выше, чем у женщин того же возраста, а после 60 лет эта частота становится сходной у мужчин и у женщин [56].
Клинико-патогенетическая характеристика
Выделяют три принципиальных механизма формирования желчного рефлюкса [4]:
- несостоятельность сфинктерного аппарата — дуоденальное содержимое может свободно достигать желудка и пищевода через пилорический и нижний пищеводный сфинктеры;
- антродуоденальная дисмоторика — нарушение координации между антральным, пилорическим отделами желудка и ДПК, которые управляют направлением тока дуоденального содержимого;
- ликвидация естественного антирефлюксного барьера.
ДГР развивается из-за недостаточности пилорического жома, которая, в свою очередь, чаще является следствием анатомических изменений после оперативных вмешательств (гастрэктомии, резекции желудка, гастроэнтеростомии, энтероэнтеростомии, ваготомии). Частой причиной ДГР становится дуоденостаз и связанная с ним дуоденальная гипертензия [4, 17]. Это объясняет высокую частоту ДГР и ДГЭР после холецистэктомии и при внешнесекреторной недостаточности поджелудочной железы (ПЖ).
По данным С. С. Vere et al., которые обследовали 230 больных с рефлюкс-гастритом, он был в 72,6% случаев диагностирован после оперативных вмешательств на желудке, в т. ч. после резекции по Бильрот І (52,6%), после резекции по Бильрот II (14,35%), а также после пилоропластики и наложения гастроэнтероанастомоза. В 7,42% случаев ДГР развился после билиарной хирургии: в 5,69% — после холецистэктомии и в 1,73% — после наложения билиарных анастомозов [56].
Средний период времени от выполнения оперативного вмешательства до диагностики щелочного рефлюкс-гастрита составил 14,9 года после оперативных вмешательств на желудке и 15,3 года после хирургии на желчных путях. Рефлюкс-гастрит в первом случае чаще развивался у мужчин, во втором случае — у женщин [56].
Другими факторами риска ДГР, по данным С. С. Vere et al., были рефрактерный асцит (0,86%), сахарный диабет (0,43%), постпапиллярная кишечная обструкция (0,43%), дуоденальная язва (0,43%). Кроме того, был диагностирован один случай рефлюкс-гастрита у пациента с острым панкреатитом, но причинно-следственная связь в этой ситуации не была доказана. В 20% случаев никаких факторов риска рефлюкс-гастрита выявлено не было [56].
Следует также отметить, что среди больных, включенных в исследование С. С. Vere et al., злоупотребление алкоголем имело место в 44,78%, ежедневное употребление кофе — в 45,22%, курение — в 50,46% случаев, причем половина курильщиков выкуривали более 20 сигарет в день. 22,17% пациентов получали нестероидные противовоспалительные средства. По результатам уреазного дыхательного теста, инфекция Нр была диагностирована в 32,0% случаев [56].
Обратимся к патогенезу ДГР и ДГЭР после холецистэктомии.
В связи с утратой сократительной функции желчного пузыря (ЖП) нарушается гастродуоденальная моторика. Дело в том, что ЖП выполняет роль своеобразного «насоса», при сокращении которого происходит не только выброс желчи, но и поддержание нормального интрадуоденального давления. При отсутствии этого «насоса» развивается дуоденостаз и дискоординация гастродуоденального моторного комплекса, поэтому для постхолецистэктомического синдрома характерны ГЭР, ДГР и даже ДГЭР (рис. 2 а, б, в) [15].
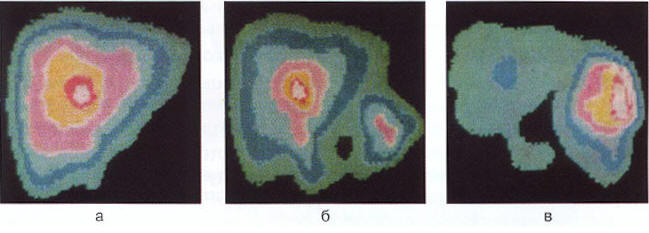
Рис. 2. Недостаточность сфинктера Одди у больного с холестерозом холедоха и фатерова соска (ЖП удален в связи с калькулезным холестерозом). Билисцинтиграфия: выраженный дуоденогастральный рефлюкс. Сцинтиграммы на 15, 30 и 45 минутах после введения радиофармпрепарата
Следующая принципиальная позиция, определяющая клинические проявления постхолецистэктомического синдрома, — кишечный дисбиоз из-за утраты концентрационной функции ЖП и адекватного выброса желчи в ДПК во время еды, вследствие чего развивается нарушение пассажа желчи в кишечник и расстройство пищеварения. Изменение химического состава желчи и хаотическое ее поступление в ДПК нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к микробному обсеменению ДПК, ослаблению роста и функционирования нормальной кишечной микрофлоры, расстройству печеночно-кишечной циркуляции и снижению общего пула желчных кислот. Под влиянием микрофлоры желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки ДПК, тонкой и толстой кишки с развитием дуоденита, рефлюкс-гастрита, энтерита и колита. Дуоденит сопровождается дуоденальной дискинезией и, в первую очередь, дуоденальной гипертензией с усилением дуоденогастральных рефлюксов и забросом содержимого в общий желчный проток и проток ПЖ [15].
При синдроме избыточного бактериального роста в кишке накапливаются продукты жизнедеятельности бактерий, гниения и брожения, т.е. развиваются метеоризм и дистензионные боли, усугубляется ДГР [15].
Традиционно симптомами ДГЭР и ГЭР считают горечь во рту, изжогу, отрыжку [25]. За ощущение горького вкуса отвечают сопряженные с G-белками рецепторы типа T2R, локализующиеся не только в ротовой полости, но и в верхних дыхательных путях, в которых они выполняют роль барьера на пути распространения инфекционных агентов [25, 43]. И. В. Козлова с соавт. провели анкетирование 625 больных, перенесших холецистэктомию. Авторы показали, что через 1-3 года после операции абдоминальная боль отмечалась достоверно чаще, чем до операции. Горечь во рту была у 65,1% опрошенных, изжога — у 58,1%. При этом горечь во рту больные отмечали чаще, чем до операции (54,8%). В сроки более 3 лет после холецистэктомии боли в эпигастральной области зафиксированы у 31,4% больных, боли опоясывающего характера — у 49%, горечь во рту — у 66,7%, тошнота-у 43,1% и отрыжка-у 39,2% больных. Авторы считают, что одной из основных причин жалоб больных после холецистэктомии является повышение частоты ДГР, диагностированного с помощью рН-метрии [21, 25].
В исследовании G. Aprea et al. [77], в котором изучали особенности симптоматики и морфологическую характеристику слизистой оболочки желудка у лиц пожилого возраста, перенесших холецистэктомию, через 6 месяцев после операции желчный гастрит был диагностирован у 58% пациентов. Боли в эпигастральной области, тошнота, рвота желчью, ощущение распирания вверху живота, тяжесть после еды, изжога и часто возникавшая отрыжка были выявлены у всех больных до холецистэктомии. Объяснение этой симптоматики комплексное, хотя авторы напоминают, что три симптома — абдоминальную боль, тошноту и рвоту желчью — традиционно оценивают именно как «билиарные» симптомы, ассоциированные с желчнокаменной болезнью (ЖКБ). Более чем у 1/3 пациентов описанные симптомы сохранились спустя полгода после выполнения лапароскопической операции, что, возможно, связано со сформировавшимся ДГР и билиарным гастритом [25, 77].
Как было указано выше, в патогенезе ДГР и ДГЭР большое значение имеет дуоденальная гипертензия. Этот синдром формируется не только после холецистэктомии, но и при ЖКБ, других органических и функциональных патологических состояниях, в частности, при панкреатической недостаточности [17].
Не углубляясь в физиологические взаимосвязи между ДПК и ПЖ, скажем лишь, что обеспечена надежная зависимость между наличием в ДПК нутриентов и внешней секрецией ПЖ. Так, если в ДПК находятся негидролизованные или недостаточно гидролизованные нутриенты, которые поступили из желудка, то к ПЖ поступает команда: «Подайте-ка пищеварительные ферменты в просвет ДПК!». Эта команда осуществляется через стимуляцию S- и І-клеток слизистой ДПК белками, жирами и ионами Н+. Когда необходимое количество ферментов, бикарбонатов, объема панкреатического секрета поступит в ДПК и произойдет достаточный гидролиз нутриентов, стимуляция ПЖ ослабевает. От нее в межпищеварительном периоде ДПК не требует ферментов или требует минимальное количество.
А что же происходит при хроническом панкреатите (ХП), т.е. при панкреатической недостаточности? Естественно, что при уменьшении количества функционально активных ацинарных клеток ПЖ (атрофия, фиброз) она не может обеспечить поступление в ДПК нужного количества ферментов, т. е. такого, которое необходимо для полного гидролиза нутриентов. Негидролизованные нутриенты задерживаются в ДПК в надежде компенсировать недостаток ферментов временем, т.е. в ожидании того, что панкреатические ферменты, поступающие в сниженном количестве, но в течение длительного времени, все же обеспечат необходимый гидролиз компонентов химуса. Именно таким путем формируются дуоденостаз и хроническая дуоденальная гипертензия (ХДГ) при ХП с внешнесекреторной недостаточностью ПЖ. Клинический результат — тяжесть, боль, распирание, дискомфорт в верхних отделах живота, т.е. диспепсия. Кроме того, дуоденостаз рефлекторным путем вызывает возбуждение рвотного центра для снижения давления в ДПК, что приводит к тошноте и рвоте, не приносящей облегчения, т. к. раздражение центра продолжается.
Рефлекторному возбуждению рвотного центра способствуют также растяжение стенок главного панкреатического протока (характерно для обструктивного панкреатита), общего желчного протока (например, в случае ЖКБ при билиарном ХП), интоксикация, типичная для выраженного обострения панкреатита. В результате тошнота усиливается, увеличивается вероятность рвоты. Исходя из описанных выше патогенетических механизмов боли и диспепсии, становится совершенно очевидным, что основной путь ее устранения — назначение современных ферментных препаратов. Эвакуировавшись в ДПК из желудка вместе с химусом, мини-микросферы ферментного препарата обеспечат быстрый и полный гидролиз компонентов этого химуса в ДПК, что будет способствовать ликвидации дуоденостаза. Если же использовать таблетированные ферментные препараты, то вследствие асинхронизма они задержатся в желудке, а химус, попавший в ДПК, по-прежнему будет «ожидать» ферменты, чтобы гидролизоваться и уйти дальше в тонкую кишку. Конечно, исходя из патогенеза, уменьшению выраженности тяжести в эпигастрии, тошноты, рвоты также способствуют обеспечение беспрепятственного оттока желчи и панкреатического секрета, уменьшение интоксикации при купировании обострения ХП.
При развитии дуоденостаза у больных с ХП он нередко является причиной не только компенсированной, но и суб- и даже декомпенсированной ХДГ. При этом рефлюкс в вирсунгианов проток приводит к усугублению ХП (энтерокиназа, попадая в ПЖ, вызывает внутриорганную активацию трипсиногена); рефлюкс в общий желчный проток приводит к развитию холецистита; рефлюкс в желудок, а затем и в пищевод — к формированию рефлюкс-гастрита, желчного ДГЭР. Далее последний упорный рефлюкс способствует формированию диафрагмальной грыжи, которая встречается при ХП достаточно часто. Конечно, рефлюксные явления клинически «выливаются» в отрыжку, изжогу, а в ряде случаев возникают пищеводные боли.
Таким образом, в патогенезе клинических проявлений панкреатической недостаточности важную роль играет дуоденостаз. Неслучайно даже в научно-медицинской литературе дуоденостаз называют «дуоденальным демоном» (рис. 3) [8, 76]. Синдром ХДГ или «дуоденального демона» проявляется целым рядом расстройств: тяжестью в эпигастрии, отрыжкой, изжогой, тошнотой, рвотой, метеоризмом, нарушениями стула. Однако этим симптомокомплекс не ограничивается. Он часто дополняется явлениями психосоматической астенизации, снижением умственной продуктивности и физической работоспособности, апатией ко всему, что не входит в орбиту узко личностных интересов, с мрачной оценкой жизненных перспектив [8, 76]. Для ХДГ характерна также головная боль по типу мигрени («дуоденальная мигрень»), патогенез которой, вероятно, носит нервно-рефлекторный характер в ответ на активацию вагальных и нервных симпатических афферентных импульсов при растяжении ДПК [38].
![Рис. 3. Синдром «дуоденального демона» (по Л. И. Буторовой, 2005 [8])](https://medblog.su/wp-content/uploads/2018/08/1533681004_558_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 3. Синдром «дуоденального демона» (по Л. И. Буторовой, 2005 [8])
Важно учитывать, что наличие ДГР может провоцировать и поддерживать ГЭР. Это может происходить двумя путями [4]:
- повышение интрагастрального давления и, таким образом, увеличение риска ГЭР;
- присоединение новых компонентов, таких как дуоденальное содержимое с желчными кислотами и панкреатическими энзимами, что потенциально вредно для слизистой оболочки пищевода.
При рефлюкс-гастрите повреждающее действие на слизистую желудка оказывают желчные кислоты, лизолецитин и трипсин. О. Я. Бабак так описывает механизм повреждения этой слизистой: «Желчные кислоты, обладающие детергентными свойствами, способствуют солюбилизации липидов мембран поверхностного эпителия. Такой эффект зависит от концентрации, уровня конъюгации и гидроксилирования желчных кислот и, что очень важно, от рН желудочного содержимого». При низких значениях последнего слизистую оболочку повреждают только тауриновые конъюгаты, другие конъюгаты в таких условиях преципитируют. Напротив, при высоких значениях рН, что особенно характерно для культи резецированного желудка, неконъюгированные и дигидроксильные желчные кислоты обладают значительно большими повреждающими свойствами, чем конъюгированные и тригидроксильные [3, 80, 94, 96]. Определенную роль в повреждении желудочного эпителия играет и лизолецитин, образующийся при дуоденальном гидролизе лецитина панкреатической фосфолипазой А. Известно, что поверхность слизистой оболочки гидрофобна. Это связано с абсорбцией поверхностно-активных фосфолипидов наружной мембраной эпителиоцитов. В условиях эксперимента было показано, что такая гидрофобность резко снижается после кратковременной инкубации кусочка слизистой оболочки в среде, содержащей дезоксихолат натрия: это объясняют действием желчных кислот на фосфолипиды клеточных мембран [46, 100].
Что касается повреждения слизистой пищевода при ДГЭР, то наиболее хорошо изучено значение желчных кислот, которые, по-видимому, играют основную роль в патогенезе повреждения пищевода при ДГЭР. Установлено, что конъюгированные желчные кислоты, в первую очередь тауриновые конъюгаты, и лизолецитин оказывают более выраженное повреждающее действие на слизистую оболочку пищевода при кислом рН, что определяет их синергизм с соляной кислотой в патогенезе эзофагита. Неконъюгированные желчные кислоты и трипсин более токсичны при нейтральном и слабощелочном рН [25,78]. Токсичность неконъюгированных желчных кислот обусловлена преимущественно их ионизированными формами, которые легче проникают через слизистую оболочку пищевода.
Клинические проявления рефлюкс-гастрита и гастроэзофагеальной рефлюксной болезни (ГЭРБ), ассоциированные с ДГЭР, неспецифичны. Часто рефлюкс-гастрит протекает бессимптомно, но возможна жгучая боль в эпигастрии, тошнота, рвота с примесью желчи, проявления демпинг-синдрома. При ДГЭР в большинстве случаев жалобы также отсутствуют. Ряд больных отмечают регургитацию, горечь во рту, изжогу, дисфагию, одинофагию, рвоту желчью, боль за грудиной. При развитии пищевода Барретта симптоматика неспецифична. Известно, что измененный цилиндрический эпителий пищевода менее чувствителен к раздражителям, чем сквамозный (естественный эпителий пищевода). В связи с этим у трети пациентов с пищеводом Барретта нет симптомов ГЭРБ, а в остальной части случаев эти симптомы выражены незначительно [4].
Интересно, что у одних больных после гастрэктомии ДГЭР проявляется горечью во рту, у других — изжогой [32, 35]. Понятно, что при ДГЭР дуоденальное содержимое смешивается с желудочным, и жалобы, вероятно, зависят от рН полученной смеси и от особенностей восприятия больного [94]. Независимо от ощущений больного, установлен эффект синергизма в развитии повреждений пищевода между кислотным рефлюксом и ДГР [78].
J. Е. Richter и М. F. Vaezi [86, 99] отмечают, что в отличие от «классического» кислого рефлюкса, проявляющегося изжогой, регургитацией и дисфагией, ассоциация ДГЭР с соответствующей симптоматикой выражена слабее. Чаще, чем при кислом рефлюксе, выявляют симптомы диспепсии. Пациенты могут предъявлять жалобы на боль в эпигастральной области, усиливающуюся после еды, иногда достигающую значительной интенсивности, тошноту, рвоту желчью. Эта клиника в большей части случаев дополняется горечью во рту [25].
При ДГЭР возможно развитие внепищеводных проявлений. В частности, в эксперименте и в клинике продемонстрировано формирование фарингита и ларингоспазма [82, 83]. В другом эксперименте показано, что таурохолевая и хенодезоксихолевая кислоты повреждают слизистую гортани у крыс [78, 99]. Проявления со стороны дыхательной системы при ДГЭР отмечают чаще, чем при кислом рефлюксе, хотя таких исследований немного [12, 25]. Высказывают гипотезу о том, что билиарный рефлюкс имеет значение в развитии рака гортани у больных после гастрэктомии или резекции желудка по Бильрот II [85, 86]. Опубликованы данные о связи между билиарным рефлюксом и некоронарогенными болями в грудной клетке [89].
Диагностика
Эндоскопические изменения, которые выявляются при рефлюкс-гастрите, представлены в таблице 1 и на рис. 4-8.
Наиболее характерные гистологические изменения при рефлюкс-гастрите приведены в таблице 2 и на рис. 9-14.
Таблица 1. Эндоскопические проявления рефлюкс-гастрита (по С. С. Vere et al., 2005 [56])
| Эндоскопические признаки | Частота,% |
| Гиперемия слизистой желудка |
64,43 |
| Наличие желчи в желудке |
57,83 |
| Утолщение складок слизистой |
9,55 |
| Эрозии |
5,22 |
| Атрофия слизистой |
5,22 |
| Петехии |
2,17 |
| Кишечная метаплазия |
0,43 |
| Полипы в желудке |
0,43 |
![Рис. 4. Рефлюкс-гастрит после резекции желудка по Бильрот II (по С. С. Vereetal., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681004_211_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 4. Рефлюкс-гастрит после резекции желудка по Бильрот II (по С. С. Vereetal., 2005 [56])
![Рис. 5. Рефлюкс-гастрит после резекции желудка по Бильрот I (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681004_57_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 5. Рефлюкс-гастрит после резекции желудка по Бильрот I (по С. С. Vere et al., 2005 [56])
![Рис. 6. Рефлюкс-гастрит после наложения холедоходуоденоанастомоза (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681004_169_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 6. Рефлюкс-гастрит после наложения холедоходуоденоанастомоза (по С. С. Vere et al., 2005 [56])
![Рис. 7. Слизистая желудка гиперемирована, застойная, имбибирована желчью (по В. Й. Кімакович із співавт., 2003 [16])](https://medblog.su/wp-content/uploads/2018/08/1533681005_266_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 7. Слизистая желудка гиперемирована, застойная, имбибирована желчью (по В. Й. Кімакович із співавт., 2003 [16])
![Рис. 8. Рефлюкс-гастрит после резекции желудка по Бильрот II. Слизистая культи желудка ярко-красная, легко ранима при контакте (по В. Й. Кімакович із співавт., 2003 [16])](https://medblog.su/wp-content/uploads/2018/08/1533681005_190_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 8. Рефлюкс-гастрит после резекции желудка по Бильрот II. Слизистая культи желудка ярко-красная, легко ранима при контакте (по В. Й. Кімакович із співавт., 2003 [16])
Таблица 2. Гистологические изменения слизистой желудка при рефлюкс-гастрите (по С. С. Vere et al., 2005 [56])
| Гистологические изменения | Частота,% |
| Хроническое воспаление | 84,06 |
| Фовеолярная гиперплазия | 40,44 |
| Кишечная метаплазия | 34,83 |
| Острое воспаление | 16,08 |
| Инфекция Нр | 16,08 |
| Хронический атрофический гастрит | 13,46 |
| Полипы | 13,46 |
| Дисплазия | 11,23 |
| Доброкачественное изъязвление | 7,86 |
| Отек | 6,74 |
| Неоплазия | 2,24 |
![Рис. 9. Хронический атрофический гастрит. Минимальное интерстициальное воспаление и перигландулярный фиброз (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681005_635_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 9. Хронический атрофический гастрит. Минимальное интерстициальное воспаление и перигландулярный фиброз (по С. С. Vere et al., 2005 [56])
![Рис. 10. Кишечная метаплазия. Обширные области кишечной метаплазии с выраженным воспалением (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681005_905_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 10. Кишечная метаплазия. Обширные области кишечной метаплазии с выраженным воспалением (по С. С. Vere et al., 2005 [56])
![Рис. 11. Кишечная метаплазия (ограниченные области) (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681005_366_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 11. Кишечная метаплазия (ограниченные области) (по С. С. Vere et al., 2005 [56])
![Рис. 12. Изолированная метаплазия железистого эпителия (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681005_875_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 12. Изолированная метаплазия железистого эпителия (по С. С. Vere et al., 2005 [56])
![Рис. 13. Изолированная метаплазия железистого эпителия и низкая степень воспаления в lamina propria (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681006_515_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 13. Изолированная метаплазия железистого эпителия и низкая степень воспаления в lamina propria (по С. С. Vere et al., 2005 [56])
![Рис. 14. Воспаление и метаплазия железистого эпителия (по С. С. Vere et al., 2005 [56])](https://medblog.su/wp-content/uploads/2018/08/1533681006_796_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
О. Я. Бабак подтверждает, что для рефлюкс-гастрита типичны фовеолярная гиперплазия и отек слизистой, а также отмечает пролиферацию гладкомышечных клеток в собственные пластинки на фоне умеренного воспаления. Фовеолярную гиперплазию определяют как экспансию слизистых клеток. При рефлюкс-гастрите она охватывает исключительно поверхностный эпителий и этим отличается от гастрита типа В (хеликобактерного), для которого характерна гиперплазия не только поверхностного, а и ямочного эпителия слизистой оболочки желудка. Эпителий становится резко уплощенным, базофильным, насыщенным РНК и почти не содержащим слизи. В клетках эпителия отмечаются грубая вакуолизация цитоплазмы, пикноз ядер, некробиоз и некроз, который считается началом образования эрозий. Со временем нарастают атрофические изменения, сопровождающиеся прогрессированием пролиферативных процессов и развитием дисплазии различной степени выраженности, что увеличивает риск малигнизации [2, 4, 36].
Выраженность изменений слизистой желудка обычно не соответствует степени ее колонизации Нр. Предложена формула для оценки этих морфологических изменений — индекс билиарного рефлюкса (BRI), который равен: (7 х отек собственной пластинки слизистой оболочки [в баллах]) + (3 х кишечная метаплазия) + (4 х хроническое воспаление) — (6 х Helicobacter pylori). При BRI>14 с чувствительностью 70% и специфичностью 85% рефлюкс желчи превышает 1 ммоль/л [25, 45].
Следует отметить, что такой эндоскопический признак, как наличие желчи в желудке, не всегда следует относить именно к рефлюкс-гастриту. Некоторые авторы справедливо, на наш взгляд, считают, что ДГР может быть спровоцирован самой процедурой эндоскопии [16, 56].
Что касается рефлюкс-эзофагита, то ДГЭР может приводить к развитию тяжелого эзофагита, метаплазии пищеводного эпителия и даже аденокарциномы, развивающейся на фоне последней [85, 86]. С. A. Gutschow et al. [64] также убедительно продемонстрировали роль ДГЭР в сочетании с кислым рефлюксом в патогенезе цилиндрической метаплазии пищеводного эпителия, пищевода Барретта и аденокарциномы пищевода. Интересно, что результаты экспериментального исследования, выполненного на гастрэктомированных крысах, свидетельствуют о доминировании не железистого, а плоскоклеточного рака пищевода на фоне ДГЭР [25, 88]. Пример эндоскопической картины при ДГЭР представлен на рис. 15.
![Рис. 15. Выраженный ДГЭР. В пищеводе содержимое со значительной примесью желчи (по В. Й. Кімакович із співавт., 2003 [16])](https://medblog.su/wp-content/uploads/2018/08/1533681006_113_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 15. Выраженный ДГЭР. В пищеводе содержимое со значительной примесью желчи (по В. Й. Кімакович із співавт., 2003 [16])
Целый ряд авторов считает экспозицию дуоденального содержимого в пищеводе фактором развития пищевода Барретта и рака пищевода [55, 66, 75, 90]. С другой стороны, желчный рефлюкс присутствует у четверти больных [94], а по данным Е. В. Онучиной с соавт., — даже у 48,4% пациентов с пищеводом Барретта [29].
Представляет интерес исследование К. Н. Chen et al. [66], в котором экспериментальных животных разделили на четыре группы в зависимости от диеты: с низким содержанием растительных жиров, с низким содержанием животных жиров, с высоким содержанием растительных жиров и с высоким содержанием животных жиров. Вначале оценивали состав желчных кислот в желчи в каждой группе животных с помощью жидкостной хроматографии. Поскольку только потребление большого количества животных жиров вызывало изменения в составе желчных кислот, то затем были отобраны именно животные с таким питанием, а также для сравнения — животные с диетой с низким содержанием растительных жиров для проведения эзофагоеюностомии с целью моделирования желчного рефлюкса. Кроме того, сравнивали последующие морфологические изменения между группами животных в течение 30 недель после операции.
В группе животных с высоким содержанием животных жиров был отмечен значительно более высокий уровень формирования пищевода Барретта, чем в группе с низким содержанием растительных жиров. Заболеваемость аденокарциномой пищевода в группе с высоким содержанием животных жиров была также несколько выше, чем в группе с низким содержанием растительных жиров. Высокое содержание животных жиров в рационе привело к изменению состава желчных кислот и к увеличению концентрации конъюгатов таурина в желчи [66].
Пожалуй, основным методом диагностики ДГР и ДГЭР является суточная интрагастральная и внутрипищеводная рН-метрия. ДГР определяется как любое увеличение рН тела желудка выше 5, не связанное с приемом пищи. ДГР считают выраженным, если эпизоды рефлюксов превышают 10% времени мониторирования. О. А. Сторонова с соавт. представили примеры результатов рН-метрии при желчном рефлюксе. На рис. 16 представлена рН-метрическая кривая больной, которая обратилась с жалобами на изжогу, развившуюся через несколько месяцев после гастрэктомии. Больная самостоятельно принимала антисекреторные препараты (ингибиторы протонной помпы — ИПП) без видимого положительного эффекта. Причина была в том, что после гастрэктомии возникновение изжоги связано с желчным рефлюксом, что было подтверждено данными рН-граммы: рН в среднем составляет 8, что соответствует желчи (рН желчи: пузырная — 6,5-7,3, печеночная -7,5-8,2) и панкреатическому соку (его рН -7,5-9,0) [35].
![Рис. 16. рН-грамма пациентки, перенесшей гастрэктомию (эзофагоеюноанастомоз) (по О. А. Стороновой с соавт., 2012 [35])](https://medblog.su/wp-content/uploads/2018/08/1533681006_195_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 16. рН-грамма пациентки, перенесшей гастрэктомию (эзофагоеюноанастомоз) (по О. А. Стороновой с соавт., 2012 [35])
На рис. 17 представлена рН-грамма пациента, который предъявлял жалобы на дискомфорт в эпигастрии, периодическую изжогу. При рН-метрии в теле желудка определяется нормацидность и продолжительные выраженные ДГР, особенно ночью и утром.
![Рис. 17. рН-грамма тела желудка пациента с ДГР в ночные и утренние часы (по О. А. Стороновой с соавт., 2012 [35])](https://medblog.su/wp-content/uploads/2018/08/1533681006_404_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 17. рН-грамма тела желудка пациента с ДГР в ночные и утренние часы (по О. А. Стороновой с соавт., 2012 [35])
Некислотные рефлюксы являются одной из причин персистирования симптомов во время проведения антисекреторной терапии [59, 93]. При использовании для диагностики комбинации внутрипищеводных рН-метрии и билиметрии у больных с резистентностью к ИПП в 62% случаев найден или желчный, или смешанный (желчь+кислота) рефлюкс [101]. Как было сказано выше, желчный рефлюкс усиливает повреждения слизистой пищевода, связанные с кислотным рефлюксом и приводит к сохранению симптомов ДГЭР при лечении ИПП, т. е. даже в отсутствии кислоты в пищеводе [31, 58, 62].
В настоящее время для диагностики используют импеданс-рН-мониторирование, которое сделало возможным регистрацию всех эпизодов рефлюксов независимо от характера рефлюктата (газ, жидкость, смешанный рефлюктат) и от его рН. Это дало возможность дифференцировать кислотные (рН<4), слабокислотные (рН 4-7) и слабощелочные (рН>7) рефлюксы [31].
Следует допускать и то, что иногда неадекватная антисекреторная терапия увеличивает пропорцию слабокислотных рефлюксов среди общего количества рефлюксных эпизодов. Например, М. F. Vela et al. с помощью рН-импеданса у больных с рефрактерностью к дневной дозе ИПП продемонстрировали изменение характера рефлюксов до начала и во время терапии. Если до приема ИПП регистрировались преимущественно кислотные рефлюксы, то во время терапии — в основном слабокислотные, а количество рефлюксов не изменилось. То есть, ИПП, оказывая супрессивное воздействие на протонные помпы, трансформируют кислотные рефлюксы в некислотные [92]. Более чем 90% рефлюксных эпизодов, развивающихся во время проведения терапии ИПП, являются слабокислотными [31, 42]. Это подтверждено и в другом исследовании с использованием импеданс-рН-метрии. Показано, что 68 эпизодов изжоги у больных с резистентной к ИПП ГЭРБ связаны со слабокислотными рефлюксами [57]. При этом слабокислотные рефлюксы вызывают такие же жалобы (изжогу, регургитацию), как и кислотные рефлюксы [31, 92].
В настоящее время в клиническую практику внедряется новый метод фиброоптической спектрофотометрии, основанный на определении абсорбционного спектра билирубина («Bilitec 2000»). Этот метод предназначен именно для диагностики ДГР и ДГЭР [25].
Сочетание внутрипищеводной рН-метрии и автоматического исследования рефлюктата применяют для оценки профиля забрасываемых в пищевод желчных кислот в сопоставлении с рН. Продемонстрировано, что общая концентрация желчных кислот в пищеводе при эрозивном эзофагите составляет 124 ммоль/л, а при пищеводе Барретта и/или стриктуре — выше 200 ммоль/л, тогда как в контроле — 14 ммоль/л. У больных с ГЭРБ и пищеводом Барретта в 80% случаев обнаруживали смешанный рефлюктат, а при эрозивном эзофагите такой рефлюктат выявляли только в 40% случаев. Пул желчных кислот был в основном представлен холевой, таурохолевой и гликохолевой кислотами. При лечении ИПП соотношение неконъюгированные/конъюгированные желчные кислоты смещалось в пользу неконъюгированных [25, 78].
Реже для диагностики желчного рефлюкса применяют рентген-исследование, при котором выявляют регургитацию бария из ДПК в желудок. Еще реже применяют электрогастроеюнографию [4].
Лечение
Лечение патологических состояний, связанных с желчным рефлюксом, начинают с диеты. При этом учитывают влияние пищевых продуктов на секрецию желчи. Однако эффект диеты сомнителен [47, 63].
Основными препаратами лечения ГЭРБ остаются ИПП. Однако при наличии ДГЭР наряду с ИПП должны быть назначены прокинетики и препараты урсодезоксихолевой кислоты (УДХК) [19]. Применяют также антациды, холестирамин, сукральфат, баклофен [6, 25, 35, 51, 84, 99].
УДХК (Урсофальк) занимает значительное место и эффективна не только в лечении билиарного сладжа, но и целого ряда других заболеваний ЖП, желчных путей и печени.
Выделенная более ста лет назад УДХК в практической медицине стала применяться с середины 70-х годов прошлого века после описания ее способности десатурации желчи и растворения холестериновых камней.
По мере накопления клинического опыта были получены другие эффекты положительного влияния УДХК на внутрипеченочную циркуляцию желчи, метаболизм гепатоцитов и слизистую оболочку верхней половины пищеварительного тракта, что значительно расширило показания к ее применению.
В настоящее время УДХК используется при ЖКБ, холестатических заболеваниях печени, вирусных, алкогольных гепатитах, неалкогольном стеатогепатите, холестерозе ЖП, рефлюкс-гастритах и других состояниях.
В печени из холестерина синтезируются холевая и хенодезоксихолевая кислоты (первичные желчные кислоты). Из них в кишечнике в результате реакций деконъюгации и дегидроксилирования под влиянием кишечной флоры образуются деоксихолевая и литохолевая кислоты (вторичные желчные кислоты). УДХК — третичная гидрофильная желчная кислота, которая образуется из хенодезоксихолевой кислоты. УДХК составляет не более 5% от общего пула желчных кислот, содержащихся в желчи. Гидрофобные свойства желчных кислот и связанная с ними токсичность нарастают в следующем порядке: холевая кислота → УДХК → хенодезоксихолевая кислота → деоксихолевая кислота → литохолевая кислота. Такая связь гидрофобности и токсичности желчных кислот обусловлена тем, что гидрофобные кислоты липофильны, что обеспечивает их проникновение в липидные слои, в т. ч. в клеточные мембраны и мембраны митохондрий, что вызывает нарушение их функций и гибель [24, 41].
Более высокая полярность УДХК коррелирует с меньшей тенденцией к образованию мицелл, чем объясняют отсутствие токсичности этой кислоты. При назначении в дозе 13-15 мг/кг/сут. УДХК замещает токсичные желчные кислоты и составляет около половины пула желчных кислот в желчи [24, 27].
Механизмы действия УДХК (рис. 18) [6, 18].
![Рис. 18. Механизмы действия УДХК [97]](https://medblog.su/wp-content/uploads/2018/08/1533681007_777_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 18. Механизмы действия УДХК [97]
Литолитический эффект:
- снижение литогенности желчи вследствие формирования жидких кристаллов с молекулами холестерина, предупреждение образования и растворение холестериновых камней.
Антихолестатический эффект:
- подавление секреции токсических желчных кислот в желчь за счет конкурентного захвата рецепторами в подвздошной кишке;
- стимуляция экзоцитоза в гепатоцитах путем активации кальций-зависимой а-протеинкиназы, что вызывает уменьшение концентрации гидрофобных желчных кислот.
Холеретический эффект [20]:
- индукция бикарбонатного холереза, усиливающего выведение гидрофобных желчных кислот в кишечник;
- вытеснение пула токсических гидрофобных желчных кислот за счет конкурентного захвата рецепторами в подвздошной кишке.
Цитопротективный эффект:
- встраивание УДХК в фосфолипидный слой клеточной мембраны с ее стабилизацией и повышением устойчивости к повреждающим факторам.
Дифференцированное влияние на регенерацию гепатоцитов [49, 65]:
- стимуляция митоза гепатоцитов и регенерации печени после резекции печени у экспериментальных животных;
- торможение пролиферации клеток гепатомы у человека.
Модуляция апоптоза [52, 71, 74, 87]:
- снижение концентрации кальция в клетках, предотвращающее выход цитохрома С из митохондрий, в свою очередь блокирующего активацию каспаз и апоптоз холангиоцитов;
- торможение апоптоза гепатоцитов при холестатических заболеваниях печени;
- антиапоптотический эффект УДХК не ограничивается только печенью, но имеет место и в центральной нервной системе;
- в слизистой толстой кишки УДХК влияет на апоптоз противоположно — стимулирует его.
Иммуномодулирующий эффект:
- уменьшение экспрессии молекул HLA 1-го класса на гепатоцитах и HLA 2-го класса на холангиоцитах, что снижает их аутоиммунность; снижение продукции провоспалительных цитокинов (ИЛ-1, ИЛ-6, у-интерферона) [26].
Противовоспалительный эффект [44, 54, 67, 68, 69, 70]:
- снижение исходно повышенного уровня эозинофилов и содержания простагландина Е2 в крови у пациентов с первичным билиарным циррозом;
- уменьшение активности фосфолипазы А2 в крови больных сЖКБ;
- торможение высвобождения воспалительных медиаторов из тучных клеток при воспалительных заболеваниях кишечника.
Антитоксический эффект в отношении центральной нервной системы и печени [87, 91]:
- торможение индуцированного гипербилирубинемией апоптоза астроцитов (в экспериментах на животных);
- мобилизация транспортных систем нейронов центральной нервной системы, ответственных за элиминацию из нее токсических желчных кислот;
- нейропротекторное действие;
- индукция CYP3A4 в печени.
Гипохолестеринемический эффект:
- снижение всасывания холестерина в кишечнике, синтеза холестерина в печени и экскреции холестерина в желчь.
Противоопухолевый эффект [95]:
- предотвращение специфичных для рака толстой кишки клеточных (Ras)-мутаций;
- блокирование активации «диких» типов Ras;
- подавление экспрессии на раковых клетках циклооксигеназы-2;
- стимуляция апоптоза в слизистой толстой кишки.
Приведенный выше перечень не вместил всех свойств УДХК. На рис. 18 эффекты Урсофалька отражены более полно.
Назначение УДХК способствует повышению ее концентрации в рефлюктате и желудочном соке. В результате уменьшается повреждение слизистой рефлюктатом [73], в то время как противовоспалительные и иммуномодулирующие свойства УДХК полезны в отношении уменьшения выраженности симптомов. Кроме того, УДХК способствует нормализации моторики пищеварительного тракта [72]. Этот эффект очень уместен для подавления ДГР и ДГЭР.
В последнее время доказан еще один механизм действия УДХК при билиарном рефлюкс-эзофагите. Изучается патогенетическая роль желчных кислот и кассеты гена фактора транскрипции CDX-2 в канцерогенезе при пищеводе Барретта: экспрессия mRNA протеина CDX-2 и фактора роста эндотелия сосудов (VEGF) повышена. Она еще больше увеличивается при ацидификации пищевода и при забросе дезоксихолевой кислоты при пищеводе Барретта. G. Burnat показал, что при рефлюксе УДХК дальнейшего роста экспрессии mRNA CDX-2 и VEGF не происходит, что снижает риск малигнизации [48]. При приеме УДХК изменяется процентное соотношение желчных кислот и снижается тяжесть эзофагита. Цитопротективный эффект УДХК послужил основанием для применения ее при гастрите и эзофагите, обусловленном ДГР и ДГЭР. Вытеснение пула гидрофобных желчных кислот и предотвращение индуцированного ими апоптоза эпителиоцитов ведет к редукции клинической симптоматики и эндоскопических признаков повреждения слизистой оболочки желудка и пищевода [6, 50, 58]. Подобный эффект имеет место и при лечении пожилых больных [14, 29, 53].
В двойном слепом исследовании больным с рефлюкс-гастритом и диспептическими жалобами назначали УДХК по 150 мг 2 раза в день в течение 14 дней. Результаты лечения УДХК были значительно лучше, чем плацебо [61].
В другом двойном слепом плацебо-контролируемом исследовании 26 пациентов с диспепсией были разделены на две группы: пациенты первой группы получали УДХК по 300 мг в день в течение 20 дней, пациенты второй группы получали плацебо. Значительное уменьшение жалоб достигнуто у 55% больных первой группы, тогда как во второй группе подобный результат имел место только у 21% больных (рис. 19) [98].
![Рис. 19. Значительное уменьшение выраженности симптомов у больных с рефлюкс-гастритом при лечении УДХК по сравнению с плацебо (по L. Aggio et al., 1986 [98])](https://medblog.su/wp-content/uploads/2018/08/1533681007_257_zhelchnyj-reflyuks-sovremennye-teoriya-i-praktika.jpg)
Рис. 19. Значительное уменьшение выраженности симптомов у больных с рефлюкс-гастритом при лечении УДХК по сравнению с плацебо (по L. Aggio et al., 1986 [98])
P. Pazzi et al. назначали УДХК в дозе 300 мг в день в течение месяца одной группе пациентов с рефлюкс-гастритом, в то время как остальные больные получали плацебо. В группе УДХК получено уменьшение выраженности симптомов на 50% (использовали шкалу тяжести симптомов), а в группе плацебо подобный эффект зарегистрирован только у 1/10 больных. Клиническое улучшение в группе УДХК коррелировало с эндоскопической картиной [81].
P. Ventura et al. в двойном слепом плацебо-контролируемом исследовании получили уменьшение или полное исчезновение диспептических жалоб у 80,4% больных, получавших УДХК по 250 мг 2 раза в день в течение 2 месяцев [100].
Е.В. Онучина с соавт. провели исследование, подтвердившее эффективность УДХК в лечении больных с пищеводом Барретта. Авторы обследовали 62 больных с длиной метаплазии менее 3 см. Методом рандомизации больные были разделены на две группы. Больные первой группы получали омепразол в суточной дозе 40 мг, а больные второй группы омепразол в той же дозе сочетали с приемом УДХК в суточной дозе 10 мг/кг. Результаты оценивали через пять лет. Комбинированная терапия омепразолом и УДХК способствовала положительной динамике, которая заключалась в отсутствии метаплазии у 32,3% больных, тогда как в группе омепразола такой результат достигался достоверно реже — только у 6,5% пациентов. Частота диагностики эрозивного эзофагита в группе омепразола снизилась с 80,6% до 51,6% (недостоверно), тогда как в группе комбинированной терапии — с 86,7% до 16,1% (р<0,001). Вероятность персистирования пищеводных жалоб на фоне монотерапии ИПП была в 2,8 раза, а боли в эпигастрии в 6,0 раз выше по сравнению с группой больных с пищеводом Барретта, получавших омепразол и УДХК. К моменту завершения исследования в группе с УДХК внепищеводные жалобы и тяжесть в эпигастрии вообще отсутствовали, тогда как в группе принимавших только ИПП частота таких жалоб составила соответственно 16,1 % и 22,6%. В группе ИПП+УДХК неопластическую прогрессию не регистрировали ни в одном случае. В то же время у 16,1% больных из группы ИПП на фоне кишечной метаплазии обнаружили развитие дисплазии. Эти данные убедительно демонстрируют эффективность УДХК в лечении больных с пищеводом Барретта [29].
Безусловно, в ряде случаев при рефрактерности к консервативному лечению возникает необходимость в эндоскопических и оперативных вмешательствах для уменьшения выраженности ДГЭР и ликвидации вызванных им осложнений, в частности, метаплазии пищеводного эпителия [25, 51].
Какой препарат УДХК наиболее эффективен и безопасен?
Урсофальк неслучайно является референтным препаратом УДХК в странах Европы, Северной и Южной Америки. Такой статус препарата базируется на качестве субстанции, обширной доказательной базе препарата, достижении максимального эффекта за оптимальные сроки (рис. 20). Все другие препараты УДХК при регистрации в соответствующих странах мира должны представить доказательства о фармакологической и клинической эквивалентности Урсофальку. Подавляющая часть исследований по эффективности и безопасности УДХК в Европе проведена с применением Урсофалька (более 4000 научных работ). Важно, что исследования по возможным новым областям применения Урсофалька продолжаются [28].

Рис. 20. Урсофальк — референтный препарат УДХК подавляющей части стран мира
А. Изменения состава желчи после приема Урсофалька
Б. Изменения состава желчи после приема японского препарата УДХК
Урсофальк производится в Германии с 1979 г. Аналоги препарата отличаются от Урсофалька по эффективности, безопасности и вероятности побочных эффектов.
Сравнение различных препаратов УДХК представлено в табл. 3.
Таблица 3. Сравнение различных препаратов УДХК (по С. В. Морозову с соавт., 2011 [28])
|
Параметр |
Урсофальк (Германия) |
Другие препараты УДХК |
Практическое значение |
| Срок годности / стабильность субстанции (поданным инструкции) |
5 лет |
2-4 года |
УДХК в Урсофальке более стабильна, что свидетельствует о более современной технологии производства |
| Форма выпуска | — капсулы 250 мг
— суспензия 250 мг/5 мл — таблетки 500 мг (регистрируются в России) |
Только капсулы |
|
| Число научных исследований (поданным Medline)* |
3850 |
Единичные |
Большинство клинических эффектов УДХК было доказано именно для Урсофалька |
| Референтный препарат УДХК в Евросоюзе** |
Да |
Нет |
|
* http://www. ncbi.nlm.nih.gov/pubmed/
** EU Harmonised Birth Dates, related Data Lock Points, allocated P-RMSs, June 2009
В заключение хотелось бы привести слова царя Соломона: «Чаша жизни была бы пресной, если в ней не было бы хоть капли горечи». Главное, чтобы эта горечь не привела к патологическим процессам. Будем надеяться на УДХК, которая тоже горька, как желчная кислота, но зато полезна.
Литература
- Арбеков П. А. Об условиях забрасывания кишечных жидкостей (желчи, панкреатического и кишечного соков) в желудок : диссертация … доктора медицины / П. А. Арбеков. -СПб: Типография П. П. Сойкина, 1904. — 130 с.
- Аруин Л. И. Морфологическая диагностика болезней желудка и кишечника/Л. И.Аруин, Л. Л. Капуллер, В. А. Исаков. — М. : Триада-Х, 1998. — 496 с.
- Бабак О. Я. Гастроэзофагеальная рефлюксная болезнь / О. Я. Бабак, Г. Д. Фадеенко. -К.: Интерфарма, 2000. — 175 с.
- Бабак О. Я. Желчный рефлюкс: современные взгляды на патогенез и лечение / О. Я. Бабак // Сучасна гастроентерологія. — 2003. — № 1. — С. 28-30.
- Бордин Д. С. Дуоденогастральный рефлюкс и показатели вегетативного тонуса у больных язвенной болезнью двенадцатиперстной кишки / Д. С. Бордин, Г. С. Беляева // Гастробюллетень : материалы 2-й объединенной Всероссийской, всеармейской научной конференции. — 2000. — № 1-2. — Прил. 1. — 13 с.
- Буеверов А. О. Возможности клинического применения урсодезоксихолевой кислоты / А.О. Буеверов // Consilium Medicum. — 2005.-Т. 7, № 6. — С. 460-463.
- Буеверов А. О. Дуоденогастроэзофагеальный рефлюкс как причина рефлюкс-эзофагита/ А.О. Буеверов, Т. Л. Лапина // Фарматека. — 2006.- № 1.-С. 1-5.
- Буторова Л. И. Синдром дуоденальной гипертензии; клиническое значение и лечение/ Л. И. Буторова // Двенадцатиперстная кишка в норме и патологии: современное состояние проблемы и клинические перспективы: (XI Рос. гастроэнтерол. неделя). — М.: [б. и.], 2005.-С. 17-30.
- Василенко В. X. Язвенная болезнь: современные представления о патогенезе, диагностике, лечении / В. X. Василенко, А. Л. Гребенев, А. А. Шептулин.-М.: Медицина, 1987.-288с.
- Вахрушев Я. М. Комплексная оценка действия ингибиторов секреции соляной кислоты на функциональное состояние желудка при язвенной болезни / Я. М. Вахрушев, О. В. Муравцева // Тер. архив. -2006. -№2.-С. 35-38.
- Витебский Я. Д. Характеристика ночной секреции желудка у больных язвенной болезнью и ее связь с дуоденогастральным рефлюксом / Я. Д. Витебский, Г. Г. Иванов, А. А. Левкина // Тер. архив. — 1980. — № 2. — С. 48-57.
- Возможности внутрипищеводной рН-импедансометрии в диагностике ГЭРБ / В. О. Кайбышева, О. А. Сторонова, А. С. Трухманов, В. Т. Ивашкин // Рос. журн. гастроэнтерол., гепатол., колопроктол. -2013. — № 2. — С. 4-16.
- Волков В. С. Дуоденогастральный рефлюкс и язвенная болезнь двенадцатиперстной кишки — расставим точки над «І» / В. С. Волков, И. Ю. Колесникова // Верхневолжский мед. журнал. — 2010. — Т. 8, Вып. 1. — С. 26-29.
- Григорьева И. Н. Урсодезоксихолевая кислота во внутренней медицине / И. Н. Григорьева. — М. : Медпрактика М, 2012. — 152 с.
- Губергриц Н. Б. Билиарная боль. Боль при заболеваниях печени / Н. Б. Губергриц. — М.: Медпрактика М, 2007. — 420 с.
- Діагностична і лікувальна ендоскопія травного каналу / В. И. Кімакович, В. В. Грубнік, Ю. А. Мельниченко, I. М. Тумак. — Львів : Мс, 2003. — 208 с.
- Дуоденальная гипертензия в практике гастроэнтеролога / Н. Б. Губергриц, Г. М. Лукашевич, О. А. Голубова, П. Г. Фоменко // Вестник Клуба Панкреатологов. — 2012. — № 4. — С. 48-51.
- Ивашкин В. Т. Аутоиммунные заболевания печени в практике клинициста / В. Т. Ивашкин, А. О. Буеверов.-М. : М-Вести, 2001. — 102 с.
- Кислотозависимые заболевания / В. Г. Передерий, С. М. Ткач, Ю. Г. Кузенко, С. В. Скопиченко. — К.: «ААБ» и «ВСБ», 2008.-425 с.
- Ковалева Н. Б. Внутрипеченочный холестаз беременных / Н. Б. Ковалева, И.Х. Байрамова // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2006. — № 3. — С. 36-39.
- Козлова И. В. Клинико-функциональные и структурные нарушения гастродуоденальной зоны после холецистэктомии / И. В. Козлова, Е. В. Граушкина, С. В. Волков // Врач. -2010. -№ 9. -С. 71-75.
- Коротько Г. Ф. Желудочное пищеварение в технологическом ракурсе / Г. Ф. Коротько // Кубанский научный мед. вестник. — 2006. — № 7-8. — С. 17-22.
- Коротько Г. Ф. Физиология системы пищеварения / Г. Ф. Коротько. — Краснодар: ООО БК «Группа Б», 2009. — 608 с.
- Лазебник Л. Б. Урсодезоксихолевая кислота. К 100-летию обнаружения / Л. Б. Лазебник, Л. Ю. Ильченко, Е. В. Голованов // Consilium medicum. — 2002. — № 2, Прилож. -С. 10-14.
- Лапина Т. Л. Горечь во рту: интерпретация гастроэнтеролога / Т. Л. Лапина, А. О. Буеверов // Клин. перспективы гастроэнтерол., гепатол. -2013.-№3.-С. 18- 24.
- Лейшнер У. Аутоиммунные заболевания печени и перекрестный синдром / У. Лейшнер. -М. : Анахарсис, 2005. — 176 с.
- Лейшнер У. Практическое руководство по заболеваниям желчных путей / У. Лейшнер. -М. : ГЭОТАР Медицина, 2001. — 264 с.
- Морозов С. В. Гепатопротекторы в клинической практике: рациональные аспекты использования : пособие для врачей/С. В. Морозов, Ю. А. Кучерявый.-М. :4ТЕАрт, 2011. -28 с.
- Онучина Е. В. Применение препарата УДХК (Урсосан) в терапевтическом ведении больных ПБ/Е. В. Онучина, В. В. Цуканов, М. Ф. Осипенко//Эксперим. и клин, гастроэнтерология. -2010. -№ 12. -С. 96-101.
- Павлов И. П. Физиология : лекции по физиологии пищеварения / И. П. Павлов. — М.: Познавательная книга плюс. — 2002. — 288 с.
- Пасечников В. Д. Рефрактерность к проводимой терапии гастроэзофагеальной рефлюксной болезни: определение, распространенность, причины, алгоритм диагностики и ведение больных / В. Д. Пасечников, Д. В. Пасечников, Р. К. Гогуев // Клин, перспективы гастроэнтерологии, гепатологии. — 2011. — № 2. — С. 27-36.
- Пищевод Барретта после гастрэктомии: патогенетическое значение желчного рефлюкса / Т. Л. Лапина, О. А. Склянская, Н. Н. Напалкова [и др.] // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2009. -Т. 19, № 4. — С. 75-78.
- Пономарев А. А. Необычные язвы желудка и двенадцатиперстной кишки / А. А. Пономарев, Е. П. Куликов. — Рязань: Узорочье, 2003. — 343 с.
- Рысс Е. С. Введение в гастроэнтерологию : учеб. пособие / Е. С. Рысс. — СПб. : Спец-Лит, 2005.- 175 с.
- Сторонова О. А. Практическому врачу о продолжительной интрагастральной рН-метрии: пособие для врачей / О. А. Сторонова, А. С. Трухманов / Под ред. В. Т. Ивашкина. — М.: Медпрактика-М, 2012. — 16 с.
- Ткаченко Е. И. Клинические и функционально-морфологические особенности хронического рефлюкс-гастрита / Е. И. Ткаченко, В. Ю. Голофеевский, О. А. Саблин // Рос. гастроэнтерол. журн. — 1999. — № 1. — С. 9-17.
- Филимонов Р. М. О значении дуоденогастрального рефлюкса желчи при язвенной болезни двенадцатиперстной кишки у подростков / Р. М. Филимонов, К. И. Широкова // Клин, медицина. — 1981. — № 3. -С. 56-57.
- Функциональное состояние желчного пузыря после резекции желудка с формированием пилороподобного гастродуоденоанастомоза / Г. К. Жерлов, В. Д. Завадовская, А. П. Кошель [и др.] // Ультразвуковая и функциональная диагностика. — 2002. — № 1. -С. 18-22.
- Чернин В. В. Болезни пищевода, желудка и двенадцатиперстной кишки / В. В. Чернин. -М.: Мед. информ. агентство, 2010. — 528 с.
- Чернин В. В. Хронический гастрит / В. В. Чернин. — Тверь : ООО «Триада», 2006. -304с.
- Юрьев К. Л. Адеметионин при болезнях печени. Доказательное досье / К. Л. Юрьев // Укр. мед. часопис. — 2011. — № 3. — С. 63-69.
- Acid, nonacid, and gas reflux in patients with gastroesophageal reflux disease during ambulatory 24-h pH-impedance recordings / D. Sifrim, R. Holloway, J. Silny [et al.] // Gastroenterology. — 2001. -Vol. 120.-P. 1588- 1598.
- Behrens M. Oral and extraoral bitter taste receptors / M. Behrens, W. Meyerhof // Results Probl. Cell Differ. — 2010. — Vol. 52. — P. 87 — 99.
- Bile acids inhibit tumour necrosis factor a-induced interleukin-8 production in human colon epithelial cells/O. Saitoh, K. Nakagawa, K. Sugi [etal.] //J. Gastroenterol. Hepatol. — 1998. -Vol. 13.-P. 1212-1217.
- Bile reflux and intestinal metaplasia in gastric mucosa / G. M. Sobola, H. J. O’Connor, E. P. Dewar [etal.] // J.CIin. Pathol. — 1993.-Vol. 46. — P. 235-240.
- Bile reflux gastritis and Barrett’s esophagus: further evidence of a role for duodenogastroesophageal reflux? / M. Dixon, P. Neville, N. Mapstone [et al.] // Gut. — 2001. -Vol.49, No 3.-P. 359-363.
- Bile reflux measurement and its contribution to the severity of reflux esophagitis / N. A. Gad El-Hak, M. El-Hemaly, E. Hamdy [etal.]//Saudi J. Gastroenterol. -2007. -Vol. 13.-P. 180-186.
- Burnat G. Bile acids are multifunctional modulators of the Barrett’s carcinogenesis/G. Burnat, J. Majka, P. С Konturek//J. Physiol. Pharmacol.-2010.-Vol. 61, No 2.-P. 185-192.
- Chirkin A. A. Regulation of regenerative processes in the liver /A. A. Chirkin // Falk Symposium No 125 : Cytokines in liver injury and repair. — Hannover, 2001. — P. 21.
- Deoxycholic acid causes DNA damage while inducing apoptotic resistance through NF-kB activation in benign Barrett’s epithelial cells/X. Huo, S. Juergens, X. Zhang [et al.] //Am. J. Physiol. Gastrointest. Liver Physiol. — 2011. — Vol. 301, No 2. — P. G278 — 286.
- Duodenogastroesophageal reflux : results of medical treatment and anti-reflux surgery / N. G. Elhak, M. Mostafa, T. Salah, M. Haleem // Hepatogastroenterology. — 2008. — Vol. 55. -P. 120-126.
- The effect of betaine in reversing alcoholic steatosis / A. J. Barak, H. С Beckenhauer, S. Badakhsh, D. J. Tuma //Alcohol. Clin. Exp. Res. — 1997.-Vol. 21, No 6.-P. 1100-1102.
- The effect of oral administration of ursodeoxycholic acid and high-dose proton pump inhibitors on the histology of Barrett’s esophagus/A. Bozikas.W. A. Marsman.W. D. Rosmolen [et al.]// Dis. Esophagus. — 2008. — Vol. 21, No 4. — P. 346 — 354.
- Effects of long-term ursodeoxycholate administration on expression levels of secretory low-molecular-weight phospholipase A2 and mucin genes in gallbladder and biliary composition in patients with multiple cholesterol stones / M. Kano, J. Shoda, T. Irimura [et al.] // Hepatology. — 1998.-Vol. 28. — P. 302-313.
- Effects of refluxate pH values on duodenogastroesophageal reflux-induced esophageal adenocarcinoma/ P. Cheng, J. S. Li, J. Gong [etal.] //World J. Gastroenterol. — 2011. -Vol. 17, No 25. -P. 3060-3065.
- Endoscopical and histological features in bile reflux gastritis / С. С. Vere, S. Cazacu, V. Comanescu [et al.] // Rom. J. Morphol. Embryol. — 2005. — Vol. 46, No 4. — P. 269 — 274.
- Esophageal pH-impedance monitoring and symptom analysis in GERD: a study in patients off and on therapy/ F. Zerbib, S. Roman, A. Ropert [etal.] //Am. J. Gastroenterol. — 2006. -Vol. 101. -P. 1956-1963.
- Esophageal visceral sensitivity to bile salts in patients with functional heartburn and in healthy control subjects / A. Siddiqui, S. Rodriguez-Stanley, S. Zubaidi, P. B. Miner Jr. // Dig. Dis. Sci. — 2005. — Vol. 50, No 1. — P. 81 — 85.
- Fass R. Alternative therapeutic approaches to chronic proton pump inhibitor treatment / R. Fass // Clin. Gastroenterol. Hepatol. — 2012. — Vol. 10, No 4. — P. 338 — 345.
- Fiberoptis technique for the 24-hour bile reflux monitoring / M. Fein, K.-H. Fuchs, T. Bohrer [et al.] // Dig. Dis. Sci.- 1996.-Vol. 41, No 1.-P. 216-225.
- Frigerio G. Ursodeoxycholic acid (UDCA) in the treatment of dyspepsia : a report of a multicenter controlled trial/G. Frigerio // Curr. Ther. Res. — 1979.-Vol. 26. — P. 214-224.
- Gastroesophageal reflux disease poorly responsive to single-dose proton pump inhibitors in patients without Barrett’s esophagus: acid reflux, bile reflux, or both? / J. Tack, G. Коек, I. Demedts [et al.] // Am. J. Gastroenterol. — 2004. — Vol. 99. — P. 981 — 988.
- Gawron A. J. Advances in diagnostic testing for gastroesophageal reflux disease / A. J. Gawron, I. Hirano //World J. Gastroenterol. — 2010. — Vol. 14. — P. 3750 — 3756.
- Gutschow C. A. Barrett’s esophagus: what is the poison — alkaline, biliary or acidic reflux? / С A. Gutschow, W.Schroder, A. H. Holscher // Dis. Esophagus. -2002.-Vol. 15. -P. 5-9.
- Henzel K. Ursodeoxycholic acid (UDCA) and tauroursodeoxycholic acid (TUDCA) reduce hepatocyte proliferation in acetaldehyde and ethanol experiments / K. Henzel // Falk Symposium No 136 : Cholestatic liver disease : Therapeutic options and perspectives. -Freiburg, 2003.-P. 31.
- High animal-fat intake changes the bile-acid composition of bile juice and enhances the development of Barrett’s esophagus and esophageal adenocarcinoma in a rat duodenal-contents reflux model / K. H. Chen, K. Mukaisho, H. Sugihara [et al.] // Cancer Sci. — 2007. -Vol.98, No 11.-P. 1683-1688.
- Inverizzi P. Ursodeoxycholic acid inhibits induction of the human intestinal epithelial nitric oxide synthase / P. Inverizzi//Hepatology. — 1995.-Vol. 22, No 4, Pt. 2. — P. 361A.
- Is biliary pain exclusively related to gallbladder stones? A controlled prospective study/ M.Y. Berger, T.C. OldeHartman, J.J. van der Velden, A.M. Bohnen//Br. J. Gen. Pract. -2004. -Vol. 54, No 505. — P. 574-579.
- Johnson C. D. Mayo clinic gastrointestinal imaging review/ C. D. Johnson, G. D. Schmit. -Rochester: Mayo Clin. Sci. Press, 2005. — 735 p.
- KoC.W. Biliary sludge/C.W. Ко, J. H. Sekijima, S. P. Lee // Ann. Intern. Med. — 1999.-Vol. 130.-P.301-311.
- Koutsos M. I. The effects of ursodeoxycholic and lithocholic acid on cell cycle and apoptosis in human colon adenocarcinoma cells / M. I. Koutsos // Gastroenterology. — 1995. — Vol. 108.-P.A492.
- Kruis W. Chenodeoxycholic and ursodeoxycholic acids alter motility and fluid transit in the canine ileum / W. Kruis, A. Haddad, S. F. Phillips // Digestion. — 1986. — Vol. 34, No 3. -P. 185-195.
- Kurtz W. Therapeutische Wirkungen der Ursodeoxycholsaure (UDC) an Leber und Magen-Darm-Trakt / W. Kurtz // Verdauungskrankheiten. — 1992.-Vol. 10.-P. 153- 162.
- Martinez Im. E. Ursodeoxycholic acid (UDCA) can inhibit deoxycholic acid (DCA)-induced apoptosis via modulation of EGFR/Raf-1/ERK signaling in human colon cancer cells / Im. E. Martinez // J. Nutr. — 2004. — Vol. 34, No 2. — P. 483-486.
- Miwa K. Reflux of duodenal or gastroduodenal contents induces esophageal carcinoma in rats / K. Miwa, T. Miyashita, T. Hattori // Nihon Rinsho. — 2004. — Vol. 62, No 8. — P. 1433 -1438.
- Modlin I. M. Acid related diseases: biology and treatment / I. M. Modlin, G. Sachs. -Philadelphia [et al.] : Lippinkott Williams & Wilkins, 2004. — 522 p.
- Morphofunctional gastric pre- and post-operative changes in elderly patients undergoing laparoscopic cholecystectomy for gallstone related disease / G. Aprea, A. Canfora, A. Ferronefti [etal.]//ВМС Surgery.-2012. -Vol. 12, Suppl. 1.-S.5.
- Nehra D. Composition of the refluxate / D. Nehra // Barrett’s esophagus. — Paris : John Libbey Eurotext, 2003. — Vol. 1. — P. 18 — 22.
- Netter F. H. The Netter collection of medical illustrations/ F. H. Netter. — NewYork: Colorpress, 2001.-Vol. 3.-200 p.
- Neuberger J. Immune effects of ursodeoxycholic acid / J. Neuberger // Autoimmune Liver Disease / Eds. P. Berg, A. Lohse, G. Tiegs, A. Wendel. — Dordrecht; Boston ; London : Kluwer Academic Publishers, 1997. — P. 93 — 103.
- Pazzi P. Bile reflux gastritis in patients without prior gastric surgery: therapeutic effects of ursodeoxycholic acid / P. Pazzi, S. Scalia, G. Stabellini // Cur. Ther. Res. — 1989. -Vol.45. -P. 476 — 487.
- Poelmans J. Paroxysmal laryngospasm: atypical but underrecognised supraesophageal manifestation of gastroesophageal reflux/J. Poelmans, J. Tack, L. Feenstra // Dig. Dis. Sci. -2004. — Vol. 9. — P. 1868 — 1874.
- Poelmans J. The role of (duodeno)gastroesophagopharyngeal reflux in unexplained excessive throat phlegm / J. Poelmans, L. Feeusfra, J. Tack // Dig. Dis. Sci. — 2005. — Vol. 50, No 5. -P. 824-832.
- Prospective evaluation of duodenogastroesophageal reflux in gastroesophageal reflux disease patients refractory to proton pump inhibitor therapy / S. Kunsch, A. Neesse, T. Linhart [et al.] // Digestion. — 2012. — Vol. 86. — P. 315 — 322.
- Richter J. E. Duodenogastric reflux-induced (alkaline) esophagitis / J. E. Richter // Curr. Treat. Opin. Gastroenterol. — 2004. — Vol. 7. — P. 53 — 58.
- Richter J. E. Importance of bile reflux in Barrett’s esophagus / J. E. Richter// Dig. Dis. Sci. -2001.-Vol. 8. -P. 208-216.
- Rodrigues С. М. P. Tauroursodeoxycholic acid for the treatment of acute and chronic neurodegenerative diseases / С M. P. Rodrigues, С J. Steer // Bile acids: From genomics to disease and therapy. — Dordrecht [et al.], 2004. — P. 270-286.
- The role of acid and alkaline reflux in laryngeal squamous cell carcinoma / J. Galli, G. Cammarota, L. Galo [et al.]//Laryngoscope. — 2002.-Vol. 112.-P. 1861 — 1865.
- Severe duodenogastroesophageal reflux in an 11 year old girl diagnosed by hepatobiliary imaging with (99m) Tc-mebrofenin / S. Barai, G. Bandopadhaya, M. Arun [et al.] // Hellen. Pyren. Latr.-2004. -Vol.7.-P. 142- 143.
- The severity of duodeno-esophageal reflux influences the development of different histological types of esophageal cancer in a rat model / T. Miyashita, K. Miwa, T. Fujimura // Int. J. Cancer.-2013.-Vol. 132, No 7. -P. 1496- 1504.
- Silva R. Bilirubin-induced apoptosis in astrocytes is prevented by ursodeoxycholic acid / R. Silva//Hepatology. — 1998.-Vol. 28, No4, Pt. 2. — P. 329A.
- Simultaneous intraesophageal impedance and pH measurement of acid and nonacid gastroesophageal reflux: effect of omeprazole / M. F. Vela, L. Camacho-Lobato, R. Srinivasan [et al.] // Gastroenterology. — 2001. — Vol. 120. — P. 1599 — 1606.
- Tack J. Review article : the role of bile and pepsin in the pathophysiology and treatment of gastro-oesophageal reflux disease / J. Tack // Aliment. Pharmacol. Ther. — 2006. — Vol. 24, Suppl. 2.-P. 10-16.
- Toxic bile acids in gastro-oesophageal reflux disease: influence of gastric acidity / D. Nehra, P. Howell, C. P. Williams [et al.] // Gut. — 1999. — Vol. 44, No 5. — P. 598 — 602.
- Ursodeoxycholic acid inhibits Ras mutations, wild-type Ras activation, and cyclooxygenase-2 expression in colon cancer / S. Khare, S. Cerda, R. K. Wali [et al.] // Cancer Res. — 2003. -Vol. 63, No 13. — P. 3517-3523.
- Ursodeoxycholic acid treatment of bile reflux gastritis / A. B. Stefaniwsky, G. S. Tint, J. Speck [etal.] //Gastroenterology. — 1985. -Vol. 89. — P. 1000 — 1004.
- Ursofalk: primary biliary cirrhosis, dyspeptic complaints, cholesterol gallstones. — Freiburg: Dr. Falk Pharma GmbH, 2005.-199p.
- Use of ursodeoxycholic acid in the treatment of functional dyspepsia (a double-blind versus placebo study) / L. Aggio, G. Mastropaolo, F. Di Mario [etal.] // Minerva Dietol. Gastroenterol. -1986. — Vol. 32, No 3. — P. 303 — 306.
- Vaezi M. F. Double reflux: double trouble / M. F. Vaezi, J. E. Richter // Gut. — 1999.-Vol. 44. -P. 590-592.
- Ventura P. A double-blind controlled trial of the efficacy and safety of taurohydrodeoxycholic acid in the treatment of dyspeptic disturbances associated with gallstones or other hepatic disorders / P. Ventura, M. Girola, R. Germogli//Clin. Drug Invest. — 1996. -Vol. 11, No 2. -P. 77-83.
- Yield of 24-h esophageal pH and bilitec monitoring in patients with persisting symptoms on PPI therapy / G. Karamanolis, T. Vanuytsel, D. Sifrim [et al.] // Dig. Dis. Sci. — 2008. — Vol. 53.-P. 2387-2393.
Статья опубликована на сайте http://www.gastroscan.ru
материал с сайта MedLinks.ru




