Возможности применения эплеренона при сердечной недостаточности с позиций доказательной медицины
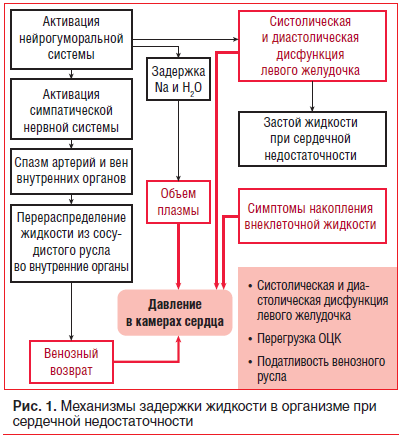
Одышка является проявлением высокого давления в левом желудочке (ЛЖ), застоя крови в венозном русле малого круга кровообращения, приводящего к уменьшению газообмена в легких и раздражению дыхательного центра. Появлению одышки также способствует накопление избыточного количества жидкости в серозных полостях (брюшной, плевральной), что затрудняет экскурсию легких. У некоторых больных одышка может носить приступообразный характер, переходя в приступ удушья, особенно по ночам (пароксизмальная ночная одышка). Причинами ее возникновения служат быстрое и выраженное ухудшение сократительной функции миокарда ЛЖ, увеличение венозного притока крови к сердцу и выраженный застой в малом круге кровообращения. Одышка при наклоне туловища вперед (бендопноэ) в течение первых 30 с (обычно при снятии или надевании обуви) является проявлением увеличения венозного возврата и наполнения левых отделов сердца, правого предсердия, заклинивания легочных капилляров, особенно у лиц с исходно высоким давлением наполнения камер сердца [3, 4].
Наряду с одышкой нередко больных c ХСН беспокоит непродуктивный кашель, возникающий в горизонтальном положении, в основном в ночное время или после физической нагрузки. Его возникновение объясняется длительным застоем крови в легких, отеком слизистой оболочки бронхов и раздражением соответствующих кашлевых рецепторов. Периферические отеки на ранних этапах заболевания локализуются в области стоп, лодыжек и появляются во второй половине дня после продолжительного пребывания в вертикальном положении, а по мере прогрессирования ХСН распространяются на область голеней, бедер, поясницы, крестца, увеличиваясь к вечеру.
Содержание статьи
Возможности коррекции отечного синдрома
С целью облегчения симптомов и снижения выраженности признаков застоя жидкости согласно отечественным и европейским рекомендациям необходимо назначать диуретики. Эти рекомендации распространяются абсолютно на все группы пациентов, независимо от фракции выброса ЛЖ (ФВЛЖ) [1, 5, 6].
При декомпенсации сердечной деятельности в комплексной диуретической терапии для увеличения диуреза и преодоления рефрактерности к тиазидным и петлевым диуретикам добавляют антагонисты минералокортикоидных рецепторов (АМКР), которые назначают в высоких дозах (150–300 мг/сут) в течение 1–3 нед. до достижения компенсации.
В период компенсации сердечной деятельности АМКР применяют в небольших дозах (12,5–50,0 мг/сут) в качестве нейрогуморальных модуляторов, которые более полно блокируют ренин-ангиотензин-альдостероновую систему (РААС) и тем самым улучшают течение заболевания и прогноз жизни больных с ХСН [1, 5, 7] (рис. 2).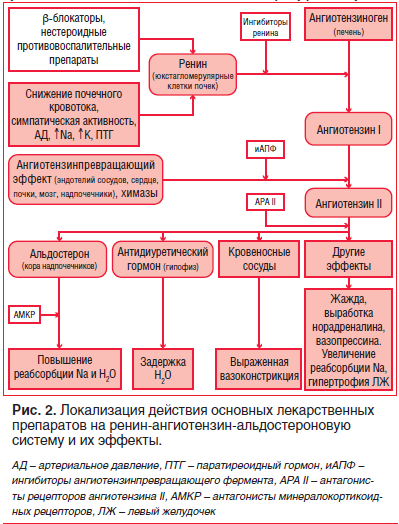
Эффекты альдостерона
Альдостерон секретируется в клубочковой зоне надпочечников, стимулирует реабсорбцию натрия и экскрецию калия в почечных канальцах, что позволяет относить его к минералокортикоидным гормонам. За счет снижения перфузии почек, повышения активности ангиотензина II и адренокортикотропного гормона стимулируется высвобождение альдостерона. При ХСН уровень альдостерона в плазме крови может достигать 300 нг/дл, что в 60 раз выше показателей, наблюдаемых в норме (5–15 нг/дл) [8].
Альдостерон способствует задержке натрия и воды в организме, развитию гиперволемии и застою жидкости. К тому же альдостерон является фактором развития кардиального фиброза — одного из важнейших элементов ремоделирования сердца и прогрессирования ХСН. Эффекты альдостерона реализуются за счет модуляции экспрессии генов в клетке при связывании с минералокортикоидными рецепторами, расположенными в эпителиальных клетках канальцев почек и надпочечников, а также в неэпителиальных клетках гиппокампа, эндотелия и гладкомышечных клетках сердца. Взаимодействие альдостерона с минералокортикоидными рецепторами способствует эндотелиальной дисфункции, усилению тромбоза, снижению сосудистого комплаенса, барорецепторной функции, миокардиальному и сосудистому фиброзу [9, 10]. В эксперименте показано, что стимуляция минералокортикоидных рецепторов приводит к увеличению уровня матричного клеточного белка остеопонтина, усиливающего фиброз и диастолическую дисфункцию миокарда [11].
В последние годы все большее внимание привлекают патофизиологические механизмы, лежащие в основе ассоциации циркулирующего в крови альдостерона и концентрации липидов. Адипозная ткань стимулирует секрецию альдостерона, который, в свою очередь, опосредует дифференцировку адипоцитов, способствуя адипогенезу и воспалению [12]. Помимо этого, существуют исследования, свидетельствующие о повреждающем воздействии высокой концентрации альдостерона на функцию почек с дальнейшей протеинурией [13].
Накапливается все больше доказательств в пользу того, что альдостерон может опосредовать и усугублять повреждающее действие ангиотензина II. Поскольку ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРА II) уменьшают концентрацию альдостерона в плазме, при их применении нередко наблюдается так называемый «эффект ускользания альдостерона» независимо от дозы иАПФ и АРА II. Возможно, что этот феномен объясняется синтезом альдостерона не только в клубочковой зоне надпочечников, но и клетками эндотелия и кардиомиоцитами, на которые не влияют эти группы лекарственных препаратов. В этой связи становится вполне очевидно, что необходима более полная блокада выработки альдостерона для уменьшения риска прогрессирования повреждения органов-мишеней у пациентов, в частности, с ХСН.
Эффекты АМКР
По данным последних исследований, АМКР уменьшают интерстициальный и периваскулярный фиброз миокарда и его патологическое ремоделирование, гипертрофию ЛЖ, оксидативный стресс и улучшают эндотелиальную функцию. Благоприятным эффектом АМКР является и снижение риска фатальных желудочковых и наджелудочковых нарушений ритма, включая фибрилляцию предсердий. Возможно, этот эффект обусловлен как предотвращением гипокалиемии, так и антифибротическим действием [14].
Метаанализ 11 клинических исследований по оценке эффектов АМКР на структуру и функцию ЛЖ с участием 942 пациентов с ХСН, сохраненной ФВЛЖ и диастолической дисфункцией ЛЖ выявил значимое снижение сывороточной концентрации N-терминального пропептида общего проколлагена типа III (динамика составила -0,90 г/л, р
В другом метаанализе было подтверждено влияние АМКР на снижение частоты госпитализаций (отношение шансов 0,83) и улучшение диастолической функции ЛЖ у пациентов с ХСН и сохраненной ФВЛЖ, перенесших инфаркт миокарда [16].
Основные представители АМКР — спиронолактон и эплеренон (относятся к группе лекарственных препаратов для приема внутрь) были изучены в крупных контролируемых рандомизированных исследованиях.
Другой представитель АМКР, калия канреноат, вводится как парентерально, так и энтерально (в некоторых странах). Антиремоделирующие свойства калия канреноата оценивали у больных с легким течением ХСН после перенесенного инфаркта миокарда, но в крупных рандомизированных исследованиях этот препарат не изучали. В связи с этим калия канреноат, в отличие от спиронолактона и эплеренона, реже применяется при лечении больных с ХСН.
Представитель 3-го поколения нестероидных АМКР — финеренон в настоящее время изучается в исследовании FINESSE-HF (Finerenone Trial to Investigate Efficacy and Safety to Eplerenone in Patients with Heart Failure) в сравнении с эплереноном у более чем 3600 пациентов с ХСН и низкой ФВЛЖ, сахарным диабетом (СД) 2 типа и/или с хронической болезнью почек [17, 18].
В настоящее время АМКР отнесены к основной группе лекарственных препаратов и применяются наряду с иАПФ и β-адреноблокаторами (БАБ) для лечения больных с ХСН II–IV функционального класса (ФК) с целью снижения риска госпитализаций и летального исхода (класс I, степень доказательности А).
Место селективного АМКР эплеренона при ХСН с низкой ФВЛЖ
В международное двойное слепое плацебо-контролируемое исследование EPHESUS (Epleronone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study) [19], которое проводилось в 674 центрах 37 стран мира с участием 6632 пациентов (3319 — группа приема эплеренона, 3313 — группа стандартной терапии), перенесших инфаркт миокарда, c ФВЛЖ ≤40% и признаками застоя. Средний возраст 64 года, 71% — мужчины, средняя ФВЛЖ 33%, время от момента развития инфаркта миокарда 7,3 дня, средний период наблюдения за пациентами 16 мес. (от 0 до 33 мес.).
В исследование не включали пациентов с уровнем креатинина более 2,5 мг/дл или калия более 5 ммоль/л. К стандартной терапии на 3–14-е сут заболевания добавляли эплеренон в cредней суточной дозе 43 мг. Важным компонентом данного исследования было назначение исследуемого препарата на фоне оптимальной терапии, включавшей иАПФ или АРА II (87%), БАБ (75%), диуретики (60%) и, по возможности, реперфузионную терапию.
Исследование EPHESUS показало, что применение высокоселективного АМКР эплеренона у пациентов с систолической дисфункцией ЛЖ и ХСН после инфаркта миокарда способствовало снижению общей смертности на 15%, сердечно-сосудистой смертности на 17%, внезапной сердечной смерти на 21%. Было достигнуто снижение суммарного показателя сердечно-сосудистой смертности и сердечно-сосудистых госпитализаций на 13%.
В двойном слепом рандомизированном исследовании EMPHASIS-HF [20] III фазы приняли участие 2737 больных в возрасте 55 лет и старше с ХСН II ФК (по NYHA) и ФВЛЖ не более 35%. Эплеренон рекомендовали в начальной дозе 25 мг/сут (1-я группа) с титрацией до 50 мг/сут через 4 нед. на фоне комплексной терапии с применением иАПФ, АРА II и БАБ в максимально переносимой дозе. Группу контроля составили больные, получавшие плацебо. Промежуточный анализ через 21 мес. от начала исследования показал значимое снижение летальности от сердечно-сосудистых причин и количества госпитализаций, что послужило основанием для преждевременного прекращения исследования (табл. 1).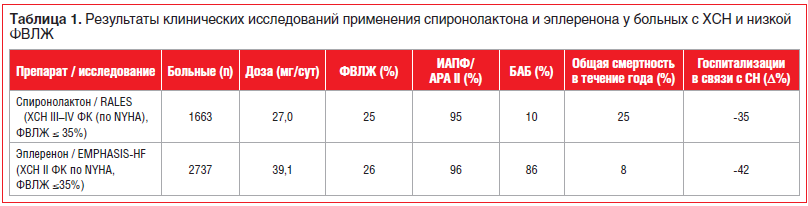
Спиронолактон, в отличие от эплеренона, является неселективным антагонистом минералокортикоидных рецепторов (АМКР) и имеет высокую тропность к андрогенным и прогестероновым рецепторам, приводя к таким нежелательным эффектам, как гинекомастия и импотенция у мужчин, а также нарушение менструального цикла у женщин. К примеру, в исследовании RALES гинекомастия регистрировалась у 10% мужчин, принимавших спиронолактон.
Селективный АМКР эплеренон (например, препарат Эспиро) имеет большую тропность к альдостероновым рецепторам, а его аффинность к прогестероновым и андрогеновым рецепторам в 100 и 1000 раз ниже, чем у спиронолактона, в связи с чем побочные эффекты при применении этого препарата регистрируются значительно реже. Ряд препаратов, таких как кетоконазол, ритонавир, кларитромицин, эритромицин, верапамил, дигоксин, циклоспорин, а также грейпфрутовый сок могут увеличить концентрацию эплеренона в крови из-за подавления активности ферментов CYP3А4, что следует учитывать при назначении данного препарата (табл. 2).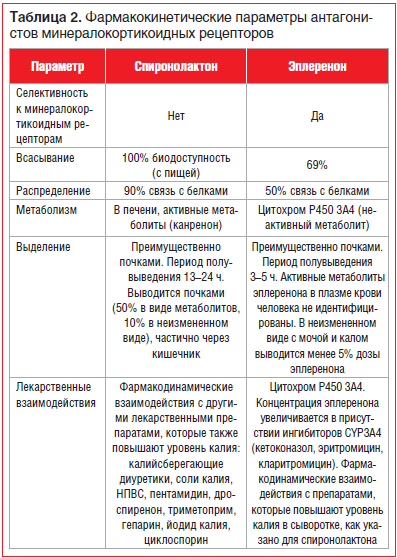
Клинический эффект эплеренона объясняется благоприятными электролитными изменениями, уменьшением интерстициального фиброза миокарда, оксидативного стресса, улучшением эндотелиальной функции, снижением агрегации тромбоцитов, повышением активности металлопротеиназ и симпатоадреналовой системы. Важно иметь в виду, что альдостерон связывается не только со своими специфическими рецепторами в миокарде, макрофагах, но и с фибробластами. В результате этого взаимодействия усиливаются синтез и накопление коллагена типа III, что способствует повышению жесткости миокарда, развитию периваскулярного и интерстициального фиброза, ремоделированию миокарда и артериального русла. Ухудшение вазомоторного резерва коронарных сосудов, кровоснабжения миокарда приводит к гибели кардиомиоцитов, ускоряя процесс фиброза, диастолической и систолической дисфункции.
Раннее назначение АМКР особенно важно для пациентов с ХСН, перенесших инфаркт миокарда, т. к. АМКР обладают доказанной способностью замедлять ремоделирование миокарда ЛЖ. В этой ситуации предпочтительно применение эплеренона из-за менее выраженной вероятности возникновения побочных эффектов [21].
Наиболее частым побочным эффектом эплеренона является гиперкалиемия. По данным исследования EPHESUS, у пациентов с систолической дисфункцией ЛЖ после инфаркта миокарда, применявших эплеренон, гиперкалиемия (6 ммоль/л и более) выявлялась в 1,6% случаев, при этом частота гипокалиемии (3,5 ммоль/л и менее) снизилась на 4,9%.
Гиперкалиемия является наиболее частым побочным эффектом терапии блокаторами РААС, включая АМКР. Существенными факторами риска развития клинически выраженной гиперкалиемии являются расчетная скорость клубочковой фильтрации (СКФ) 2 и/или уровень калия >4,5 ммоль/л на фоне приема оптимальной для данной функции почек дозы диуретика [22]. В таких условиях гиперкалиемия действительно является нередким осложнением терапии блокаторами РААС и частой причиной прекращения лечения или же основанием для применения субоптимальных доз лекарственных препаратов. Ситуация осложняется тем, что именно блокаторы РААС доказали свое влияние на cнижение смертности (в частности, общей смертности на 15–30%), частоты госпитализаций и на замедление прогрессирования почечной дисфункции у пациентов с ХСН [23–25].
Не все пациенты с ХСН принимают иАПФ/АРА II и лишь около 25–45% из них принимают рекомендованные препараты в оптимальных целевых дозах, а 10% прекращают их прием. Пациенты с ХСН и низкой ФВЛЖ также не в полной мере применяют АМКР, а приверженность лечению достигает лишь 50%. По данным T. Thorvaldsen et al., в 2012 г. принимали АМКР 52% пациентов в отличие от 43% в 2002 г. (р2 или уровнем калия >5,5 ммоль/л и прекращению приема АМКР при СКФ2 или при уровне калия >6 ммоль/л [1]. Вышесказанное свидетельствует о необходимости контроля уровня калия в крови и функции почек при назначении АМКР в зависимости от клинического состояния, возраста пациента и сопутствующей патологии.
Анализ подгруппы пациентов с ХСН, низкой ФВЛЖ, II ФК (по NYHA) в исследовании EMPHASIS-HF выявил группу риска развития гиперкалиемии, которая включает пациентов в возрасте старше 75 лет с уровнем СКФ123 мм рт. ст. У пациентов группы риска прием эплеренона способствовал увеличению уровня калия >5,5 ммоль/л, однако уровень калия >6,0 ммоль/л не наблюдался ни у одного из пациентов, включая госпитализированных по поводу гиперкалиемии, прекративших прием препарата из-за гиперкалиемии и госпитализированных по поводу нарушения функции почек [28]. Авторы сделали заключение, что эплеренон достаточно эффективно снижает частоту госпитализаций по поводу декомпенсированной ХСН и сердечно-сосудистой смертности не только в изучаемой популяции пациентов, но и в группе высокого риска развития гиперкалиемии.
В крупных рандомизированных исследованиях по изучению эплеренона (EPHESUS, EMPHASUS-HF) не было зарегистрировано летальных исходов в результате гиперкалиемии.
Так как эплеренон является высокоселективным АМКР, то гинекомастия возникает редко (менее чем у 1% пациентов). Согласно данным исследований EPHESUS и EMPHASIS-HF гинекомастия регистрировалась соответственно у 0,5 и у 0,7% принимавших эплеренон мужчин. Аффинность эплеренона к рецепторам андрогенов в 370 раз ниже, чем у спиронолактона, и даже при приеме высокой дозы препарат не связывается с рецепторами прогестерона и глюкокортикоидов.
При выявлении у пациента с ХСН гинекомастии следует помнить, что существует ряд заболеваний, повышающих риск ее развития, а большинство пациентов с ХСН — это коморбидные пациенты старшего возраста [29]. Инактивация стероидных гормонов происходит в основном в печени, почках и, реже, в кишечнике. Нарушение функционирования этих органов может способствовать нарушению метаболизма стероидных гормонов и повысить их концентрацию в крови. Помимо этого, повышение уровня эстрогенов может наблюдаться при приеме препаратов, содержащих эстрогены и обладающих эффектами эстрогенов или антиандрогенов: генистеина, 8-пренилнарингенина и др. Применение наркотических средств, амфетамина, противоопухолевых препаратов, блокаторов медленных кальциевых каналов, диазепама, наперстянки, хорионического гонадотропина, иАПФ, изониазида, кетоконазола, метилдопы, метронидазола, трициклических антидепрессантов также может вызвать развитие гинекомастии. Эти данные свидетельствуют в пользу выбора эплеренона у пациентов с комплексной сопутствующей патологией.
Место эплеренона при ХСН с сохраненной ФВЛЖ
Поскольку существуют доказательства высокой эффективности эплеренона у пациентов с ХСН и низкой ФВЛЖ, то закономерно возникает вопрос о возможности применения этого препарата у лиц с ХСН и сохраненной ФВЛЖ.
В современном представлении ХСН с сохраненной ФВЛЖ — это комплекс заболеваний, при котором зачастую затруднительно выделить ведущую причину прогрессирования и декомпенсации сердечной деятельности. Всевозможные факторы и заболевания могут формировать и менять клиническую картину, способствуя развитию разнообразных фенотипов.
В патогенезе ХСН с сохраненной ФВЛЖ задействовано несколько физиологических механизмов. Важная роль принадлежит системному воспалению, фиброзу и оксидативному стрессу. У многих пациентов нарушается диастолическая функция ЛЖ, повышается жесткость ЛЖ за счет увеличения отложения внеклеточного коллагена и изменения белков цитоскелета кардиомиоцитов, снижается степень релаксации миокарда и его энергетический резерв, повышается нейрогуморальная активность [30]. Поскольку альдостерон вовлечен во многие перечисленные процессы, применение эплеренона видится перспективным у этой категории пациентов, что подтверждает ряд исследований [31]. В течение 24 мес. наблюдались 303 пациента (249 мужчин) с сохраненной ФВЛЖ в возрасте 58±11 лет, у которых на 7-й день после инфаркта миокарда оценивали уровень матриксной металлопротеиназы-9 (ММП-9). Пациенты были разделены на 2 группы: принимавших эплеренон (n=201) в дозе 25 мг/сут и контрольную группу (n=102). Применение эплеренона не ассоциировалось с улучшением выживаемости в целом по группе (р=0,132), однако в группе пациентов с исходно более низким уровнем ММП-9 (р=0,005) прогноз был лучше, что позволило рассматривать низкий уровень ММП-9 у пациентов после инфаркта миокарда с сохраненной ФВЛЖ в качестве идентификатора той части пациентов, у которых прием эплеренона ассоциируется с благоприятным прогнозом [32–37].
Поскольку в настоящее время нет убедительных данных о высокой эффективности определенных классов лекарственных препаратов, применяемых при ХСН с сохраненной ФВЛЖ, можно надеяться, что воздействие на процесс фиброза поможет улучшить функцию кардиомиоцитов и клиническое состояние пациентов.
Заключение
Таким образом, высокая селективность эплеренона, хорошая переносимость и приверженность лечению, минимальное количество побочных эффектов, доказательная база, подтверждающая снижение частоты госпитализаций и смертности, позволяют рассматривать эплеренон (например, препарат Эспиро) в качестве препарата выбора у пациентов с ХСН, в т. ч. пациентов старшего возраста с множественной коморбидностью.
Применение эплеренона в составе комплексной терапии позволит спасти 0,5 жизни в год и 0,4 жизни — при условии высокого качества жизни, что показали результаты анализа Z. Ademi et al., которые изучили соотношение стоимости и эффективности лечения эплереноном (в сравнении с плацебо) пациентов с ХСН — участников исследования EMPHASIS-HF на протяжении 10 лет [38].
Информация с rmj.ru





