Возможности оптимизации лечения пациентов с гастроэзофагеальной рефлюксной болезнью
Е.Ю. Еремина, С.И. Зверева, Д.Е. Рязанцева, Е.А. Рябова
ФГБОУ ВПО «Мордовский госуниверситет им. Н.П. Огарева»
Вступление
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) является одним из наиболее распространенных заболеваний органов пищеварительной системы. В странах Европы и США ее распространенность среди взрослого населения составляет от 10 до 40% [1]. По данным проведенного в 6 городах России многоцентрового исследования МЭГРЕ [2], 47,5% населения испытывает изжогу, 13,3% — систематически повторяющуюся изжогу 1 раз в день и чаще, что, согласно критериям клиники Мейо, является диагностически значимым критерием ГЭРБ. Одним из центров исследования МЭГРЕ был г. Саранск, где были проанкетированы 1400 жителей в возрасте от 17 до 75 лет (средний возраст — 35,3±13,2 года), в том числе 478 мужчин (средний возраст — 34,8±13,8 лет) и 922 женщины (средний возраст 32,5±12,8 лет). Анализ результатов показал, что изжогу с разной частотой и степенью выраженности отмечали 51,1% респондентов. Диагностически значимая изжога и/или регургитация с частотой раз в неделю и более в течение последних 12 месяцев выявлены у 13,4% респондентов.
Результаты исследования показали, что распространенность симптомов ГЭРБ среди населения Саранска зависела от возраста. В частности, с возрастом увеличивалась частота таких симптомов, как ощущение кислоты в горле, ретростернальная боль и дисфагия, которые были наиболее распространены в группе респондентов старше 60 лет. Частота симптомов изжоги и регургитации также возрастала с увеличением возраста, достигая максимума в группе от 50 до 59 лет [3].
В группе респондентов, отнесенных к категории «пациенты с ГЭРБ», отмечалась большая распространенность других симптомов диспепсии (Рис. 1), а также большая частота хронических заболеваний дыхательных путей (Рис. 2).
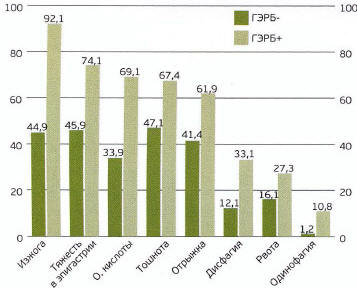
Рис. 1. Распространенность симптомов диспепсии у респондентов г. Саранска в зависимости от наличия («ГЭРБ+») или отсутствия («ГЭРБ-») опросных критериев ГЭРБ. * р<0,05
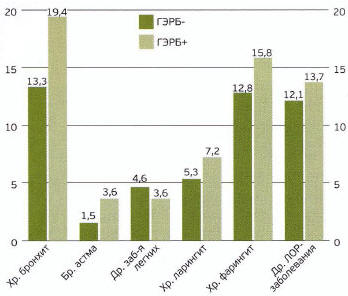
Рис. 2. Распространенность заболеваний органов дыхания среди «ГЭРБ+» и «ГЭРБ-» респондентов г. Саранска. * р<0,05
Основные механизмы развития ГЭРБ
Основные механизмы развития ГЭРБ отражены в ее современном определении, согласно которому под ГЭРБ понимают хроническое рецидивирующее заболевание, обусловленное нарушением моторно-эвакуаторной функции гастроэзофагеальной зоны и характеризующееся спонтанным или регулярно повторяющимся забрасыванием в пищевод желудочного и/или дуоденального содержимого, что может приводить к повреждению дистального отдела пищевода с развитием эрозивно-язвенных, катаральных и/или функциональных нарушений [4, 5]. Непосредственными факторами развития ГЭРБ являются повреждающее действие рефлюктата, представленного соляной кислотой, пепсином, желчными кислотами и панкреатическими ферментами; неспособность слизистой оболочки пищевода противостоять повреждающему действию рефлюктата; ее повышенная чувствительность; снижение функции антирефлюксного барьера и клиренса пищевода.
Снижение клиренса пищевода обусловлено уменьшением нейтрализующего действия слюны и бикарбонатов пищеводной слизи, а также угнетением перистальтики и снижением тонуса стенки грудного отдела пищевода. Снижение функции антирефлюксного барьера реализуется через снижение давления в нижнем пищеводном сфинктере, увеличение числа эпизодов его спонтанного расслабления, а также в случае деструктуризации сфинктера при грыже пищеводного отверстия диафрагмы [6]. Причиной снижения тонуса нижнего пищеводного сфинктера могут быть различные экзогенные факторы — алкоголь, курение, стрессы, диетические погрешности, некоторые лекарства (спазмолитики, антагонисты кальция, нитраты, теофиллин, эстрогены, прогестерон и др.). Развитию гастроэзофагеального рефлюкса способствует повышение внутрибрюшного давления при избыточном употреблении пищи, беременности, абдоминальном ожирении, метеоризме, запорах, дуоденостазе, а также так называемый «кислотный карман», представляющий собой слой небуферизованной кислоты, образующийся после еды на поверхности желудочного содержимого в области пищеводно-желудочного соединения [7,8].
Современная классификация и критерии диагностики ГЭРБ
Современная классификация (Рис. 3) и критерии диагностики ГЭРБ представлены в рекомендациях Монреальского консенсуса 2006 г. [9].
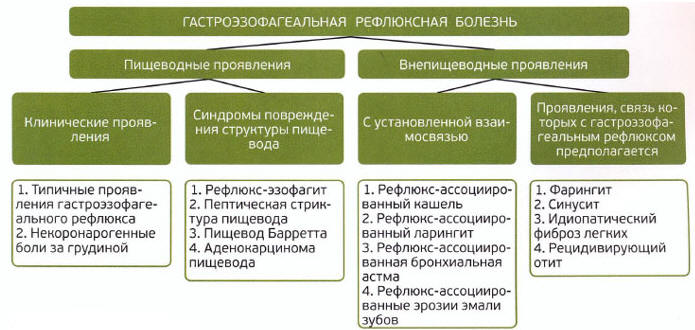
Рис. 3. Монреальская классификация ГЭРБ
К диагностическим критериям ГЭРБ отнесены:
- Наличие характерных для ГЭРБ симптомов (изжоги, регургитации, некоронарных ретростернальных болей).
- Наличие изменений со стороны слизистой оболочки пищевода.
- Подтверждение рефлюкса содержимого желудка с помощью инструментальных исследований при условии наличия типичных и/или атипичных симптомов ГЭРБ или ее осложнений.
Значительное количество работ, посвященных исследованию и детализации механизмов развития ГЭРБ, сделало возможным разработку и внедрение во врачебную практику Стандартов и национальных клинических рекомендаций по ее диагностике и лечению [4, 5]. Одновременно продолжается поиск все более оптимальных, а значит, патогенетически обоснованных и максимально индивидуализированных способов лечения данного заболевания. На сегодняшний день, наряду с модификацией образа жизни (поднятие головного конца кровати, запрет принятия горизонтального положения и работы в наклонном положении в течение 2-3 часов после еды и др.), необходимым, но, к сожалению, недостаточным условием, пациентам предлагаются схемы длительной медикаментозной терапии, включающей в себя применение ингибиторов протонной помпы (ИПП), прокинетиков, антацидов, альгинатов и препаратов урсодезоксихолевой кислоты (УДХК).
Считается, что установление диагноза ГЭРБ на основании типичных симптомов (изжоги и регургитации) является основанием для проведения медикаментозной терапии [10-12]. При этом в большинстве случаев не требуется проведения эндоскопического исследования. Эндоскопия на первом этапе обычно рекомендуется лишь пациентам с тревожными симптомами и высоким риском развития осложнений ГЭРБ.
Терапия ГЭРБ
Поскольку ведущим механизмом формирования симптоматики ГЭРБ считается длительное закисление пищевода, а само заболевание отнесено к кислотозависимым, основным направлением терапии является применение антисекреторных препаратов, прежде всего ИПП, эффективность длительного применения которых доказана множеством зарубежных и отечественных исследований. ИПП в стандартной или удвоенной дозе используются на этапе основного курса лечения и в качестве поддерживающей терапии.
Основной курс ИПП в стандартной суточной дозе при неэрозивной рефлюксной болезни составляет как минимум 4 недели; при эрозивной — минимум 8 недель [10, 12]. Критерием эффективности лечения является стойкое устранение симптомов заболевания и полное заживление эрозий при их наличии.
Выбор конкретного препарата из группы ИПП для лечения больных ГЭРБ основывается на результатах исследования мощности и длительности антисекреторного действия, скорости купирования симптомов, скорости заживления эрозий, прогнозируемости эффекта, безопасности при комбинированном лечении. На сегодняшний день ни один из консенсусов по диагностике и лечению ГЭРБ не отдает предпочтения какому-то конкретному препарату из группы ИПП. Для лечения ГЭРБ используются омепразол, лансопразол, пантопразол, рабепразол и эзомепразол. Все они позволяют обеспечить необходимое для лечения пациентов ГЭРБ значение внутрижелудочного рН>4 большую часть суток [13]. В этом контексте выбор ИПП должен основываться на клинической важности небольших отличий между ними [10]. Например, пантопразол имеет определенное преимущество для пациентов, принимающих несколько препаратов, а также при заболеваниях печени [14]. Антисекреторный эффект рабепразола начинает проявляться раньше, чем при применении других ИПП. Эзомепразол продемонстрировал более высокую эффективность при тяжелых эрозивно-язвенных поражениях пищевода, связанных с ГЭРБ [15].
Стандартные дозы ИПП (омепразол 20 мг/сут, лансопразол 30 мг/сут, пантопразол 40 мг/сут, рабепразол 20 мг/сут, эзомепразол 40 мг/сут) применяются для лечения неэрозивной и эрозивной рефлюксной болезни в течение не менее 4 и 8 недель соответственно (до 12 недель при рефлюкс-эзофагите степени С и D по Лос-Анджелесской классификации 1994 г.) и могут назначаться один раз в день утром за 30 мин. до завтрака [16]. Следует, тем не менее, признать, что лучшего эффекта можно добиться при распределении суточной дозы ИПП на 2 приема, что обеспечивает более устойчивое антисекреторное действие в течение суток и, что особенно важно, — в ночное время [17]. Двойная доза ИПП применяется, как правило, для лечения осложненных форм ГЭРБ или рефрактерных пациентов, которые ранее уже были пролечены стандартными дозами не менее 8 недель, а также при наличии у больного грыжи пищеводного отверстия диафрагмы. Двойная доза всегда распределяется на два приема (утром и вечером за 30 мин. до еды). Время приема ИПП имеет принципиальное значение для обеспечения максимального фармакодинамического эффекта, поскольку данные препараты подавляют лишь активированные пищей протонные помпы, встроенные в мембрану секреторного канальца париетальной клетки [18].
Поддерживающая терапия должна быть назначена пациентам с возобновлением симптомов после прекращения приема ИПП, пациентам с эрозивной рефлюксной болезнью и осложнениями ГЭРБ [11]. При этом может быть использован один из 3 вариантов поддерживающей терапии [11]: постоянная (ИПП в половинных дозах), периодическая или курсовая (ИПП в стандартных дозах курсами по 2-4 недели), терапия «по требованию» (при возникновении симптомов ГЭРБ).
Эффективность антисекреторной терапии ГЭРБ
К сожалению, следует признать, что эффективность антисекреторной терапии ГЭРБ не является 100%-й. Частота клинической неэффективности, по разным данным, составляет от 10 до 40% [6, 19-22]. Всесторонний анализ причин неэффективности терапии пациентов ГЭРБ так или иначе связан с продолжением исследований механизмов формирования ГЭРБ и ее клинико-морфологических вариантов. На сегодняшний день рассматриваются 3 основные группы причин неэффективности медикаментозной терапии ГЭРБ с помощью ИПП [6]:
- Слабая приверженность пациентов терапии (несоблюдение сроков лечения, доз препарата, времени приема относительно еды, невыполнение рекомендаций по модификации образа жизни).
- Индивидуальные особенности пациента («быстрые метаболизаторы», специфическая потеря чувствительности протонных помп к ингибиторам их активности и первичная омепразоловая резистентность, «ночной кислотный прорыв», генетический полиморфизм ферментов системы цитохрома Р450, осуществляющих метаболизм ИПП, наличие грыжи пищеводного отверстия диафрагмы и «кислотного кармана», инфекция Helicobacter pylori, задержка опорожнения желудка).
- Проблемы диагностики (не учитываются сопутствующие состояния, требующие медикаментозной терапии, наличие синдрома «функционального перекреста», например сочетание ГЭРБ с функциональной диспепсией, гиперсенситивный пищевод, синдром Золлингера-Эллисона, эозинофильный эзофагит, функциональная изжога, недоучет особенностей рефлюкса (слабокислотный, смешанный или щелочной (желчный) рефлюкс), нарушение клиренса рефлюктата).
Безусловно, первая и третья группы являются потенциально модифицируемыми. Причины же, относящиеся ко второй группе, должны быть максимально учтены при составлении индивидуальной программы лечебно-диагностических мероприятий у пациентов, рефрактерных к ИПП. Одной из наиболее частых причин неэффективности ИПП-терапии пациентов с ГЭРБ является недоучет особенностей рефлюкса, прежде всего, наличие в рефлюктате компонентов желчи вследствие дуоденогастроэзофагеального рефлюкса [21].
Связано это, как правило, с недостаточными возможностями использования в диагностическом процессе методик внутрипищеводной рН-импедансометрии и билиметрии, позволяющих не только диагностировать патологические желудочно-пищеводные рефлюксы, но и детально определить их тип (кислотный, слабокислотный, щелочной, смешанный, содержащий желчь). Однако в большинстве случаев полезную диагностическую информацию удается получить и при проведении более доступной методики — суточного мониторирования внутрипищеводного рН, проводимого одновременно с мониторированием рН в теле и кардиальном отделе желудка (Рис.4).
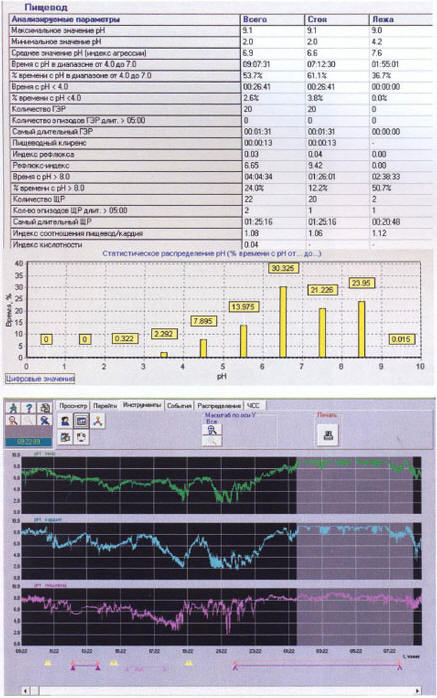
Рис. 4. Результат рН-метрии больной Ф., 43 года
Критерием щелочного рефлюкса, предложенным С.A. Pellegrini (1978), является выявление эпизодов повышения внутрипищеводного рН более 7,0 по данным суточной рН-метрии [23]. При этом, в отличие от кислых рефлюксов, все щелочные рефлюксы являются патологическими, независимо от их суммарной продолжительности за период исследования.
Щелочной или смешанный тип рефлюкса нередко ассоциируется с персистенцией типичных и особенно атипичных, или внепищеводных, симптомов ГЭРБ, в т. ч. на фоне проводимой ИПП-терапии. Являясь в значительной степени следствием заброса в пищевод не только желудочного, но и дуоденального содержимого, он часто наблюдается у пациентов с сопутствующей билиарной патологией.
Симптомы ГЭРБ часто появляются или усиливаются у пациентов после перенесенной холецистэктомии в связи с постхолецистэктомической дисфункцией сфинктера Одди. При этом в клинике, наряду с изжогой, отмечаются регургитация, горечь во рту, отрыжка воздухом и горьким, тошнота, тяжесть в эпигастрии после еды, другие симптомы диспепсии [24]. Клиническим ориентиром присутствия в рефлюктате желчи является горечь во рту, рассматриваемая как симптом дуоденогастроэзофагеального рефлюкса и следствие нарушения моторно-эвакуаторной функции верхних отделов желудочно-кишечного тракта [25-27].
Антисекреторная терапия ГЭРБ, успешно нейтрализуя негативное влияние кислоты, не корригирует повреждающее действие компонентов дуоденального рефлюкса и, прежде всего, желчные кислоты. При значении рН от 2 до 4 агрессивные свойства проявляют пепсин, лизолецитин и конъюгированные желчные кислоты, а при рН выше 7 — трипсин и неконъюгированные желчные кислоты. В исследовании D. Nehra [28] было установлено, что конъюгированные желчные кислоты проявляют агрессивные свойства по отношению к слизистой оболочке пищевода при кислом значении рН. При этом кислота и желчные кислоты синергично влияют на развитие эзофагита. Под влиянием антисекреторной терапии возрастает пул неконъюгированных желчных кислот, которые легче проникают в слизистую оболочку пищевода и оказывают более выраженное повреждающее действие при нейтральном и слабощелочном значении рН [28].
Исходя из представленных данных становится понятно, что присутствие желчных кислот в составе рефлюктата, не зависимо от его собственного рН, способствует более частому развитию эрозивного варианта ГЭРБ, пищевода Барретта и худшему результату ИПП-терапии [28-30]. Некислотный рефлюкс является причиной 15-62% случаев неэффективности ИПП-терапии больных ГЭРБ [31,32].
Существенное значение в развитии рефрактерности к ИПП-терапии принадлежит нарушению клиренса пищевода от повреждающих компонентов рефлюктата, приводящее к удлинению времени негативного влияния рефлюкса на пищевод. Необходимым условием для этого является нарушение опорожнения желудка и увеличение числа преходящих расслаблений нижнего пищеводного сфинктера [33].
Антисекреторная терапия ГЭРБ, несмотря на свою высокую клиническую эффективность, ограничена по спектру своих патогенетических эффектов воздействием лишь на объем и агрессивные свойства кислотного рефлюктата. Она не ликвидирует патологические рефлюксы, не способствует повышению тонуса нижнего пищеводного сфинктера, не влияет на моторику и перистальтику пищевода и желудка, а следовательно, клиренс пищевода. В ряде исследований описана возможность ИПП ослаблять моторику желудка и замедлять его опорожнение [34].
Определение основных причин рефрактерности ряда пациентов с ГЭРБ к проводимой терапии позволяет патогенетически обоснованно модифицировать ее препаратами, влияющими, с одной стороны, на моторно-эвакуаторную функцию эзофагогастродуоденальной зоны, а с другой — нивелирующими выраженный в различной степени щелочной (чаще — желчный) компонент рефлюктата. Возможность повышения эффективности терапии ГЭРБ за счет влияния на кинетические свойства верхних отделов желудочно-кишечного тракта связана с дополнительным назначением прокинетиков [35]. Данные препараты способствуют улучшению эвакуации пищи из желудка, повышению тонуса нижнего пищеводного сфинктера, уменьшают проявления щелочного рефлюкса.
Работами D.N. Amarapurkar (2004) и G. Holtmann с соавт. (2006) установлено, что максимально широким профилем прокинетического действия обладает итоприда гидрохлорид. В отличие от «старых» прокинетиков (метоклопрамида, домперидона), итоприд метаболизируется не ферментной системой печеночного цитохрома Р450, а флавинзависимой монооксигеназой. Это позволяет избежать нежелательного лекарственного взаимодействия при приеме медикаментов, метаболизирующихся ферментами системы цитохрома Р450, в том числе ИПП, азольных противогрибковых препаратов, макролидов и др. [36]. Высокая эффективность итоприда обусловлена двойным механизмом действия — антидопаминергическим и антиацетилхолинэстеразным. Увеличивая уровень ацетилхолина в гладкой мускулатуре желудочно-кишечного тракта посредством блокады дофаминовых рецепторов в межмышечных сплетениях и ингибирования ацетилхолинэстеразы, он усиливает перистальтику верхних отделов желудочно-кишечного тракта, повышает давление нижнего пищеводного сфинктера, предупреждает возникновение эпизодов спонтанного расслабления нижнего пищеводного сфинктера после еды, активизирует моторику желудка и ускоряет процесс его опорожнения [37].
Итоприд (Итомед®) действует быстрее «старых» прокинетиков, и его можно безопасно применять длительными курсами (1 месяц и более), например при лечении больных с внепищеводными проявлениями ГЭРБ. Итоприд применяется внутрь до еды по 1 табл. (50 мг) 3 раза в сутки и без потери эффективности может сочетаться с антисекреторными, ферментными препаратами, антацидами, альгинатами, УДХК. Прокинетическое действие препарата, в отличие от других прокинетиков, не изменяется под воздействием антисекреторных средств.
Наконец, еще одним свойством итоприда является отсутствие побочных эффектов, характерных для «старых» прокинетиков. Установлено, что он не влияет на уровень сывороточного гастрина и не обладает сродством к 5-НТ4-рецепторам, не проникает через гематоэнцефалический барьер и поэтому не вызывает побочных эффектов со стороны ЦНС, не влияет на средний уровень пролактина в крови и может безопасно применяться у пациентов с кардиологической патологией [36,38]. Учитывая факт триггерного влияния рефлюксов на возникновение коронарного ангиоспазма и аритмий, назначение итоприда (Итомед®) при сочетании ИБС и ГЭРБ представляется патогенетически обоснованным.
Многоплановым повреждающим воздействием на слизистую оболочку желудка и пищевода обладают компоненты желчи. Первичные и вторичные желчные кислоты, проникая в эпителиальные клетки слизистой оболочки этих органов, способствуют повышению проницаемости клеточных мембран и вызывают их разрушение. При этом нарушаются межклеточные контакты и клетки погибают. Под влиянием желчных кислот уменьшается толщина защитного слоя слизи. Попадание желчных кислот и лизолецитина на слизистую оболочку желудка сопровождается усилением обратной диффузии ионов водорода, высвобождением гистамина и гастрина, развитием кишечной метаплазии. В работе F. Banki et al. (2005) продемонстрирована роль рефлюкса желчи в развитии пищевода Барретта.
Возможность коррекции негативного влияния компонентов желчи на слизистую оболочку пищевода связана с применением УДХК, которая оказывает комбинированный эффекту пациентов с ГЭРБ со смешанным или билиарным рефлюксом. УДХК (Урсосан) связывает токсичные желчные кислоты, вытесняя их из общего пула желчных кислот, способствует их выведению в кишечник и ингибирует всасывание липофильных желчных кислот в кишечнике. Благодаря этому улучшается состав желчи и частично купируется желчный дуоденогастральный и дуоденогастроэзофагеальный рефлюкс, что позволяет избежать негативного влияния желчных кислот на эпителиальные клетки слизистой желудка и пищевода, делая применение УДХК (Урсосан) патогенетически обоснованным при лечении рефлюкс-гастрита и рефлюкс-эзофагита.
Основанием для включения УДХК в основной курс лечения пациентов с ГЭРБ является наличие симптома горечи во рту, указание на сопутствующую билиарную патологию (вне стадии обострения) или перенесенную холецистэктомию, а также обнаружение дуоденогастрального рефлюкса при проведении эндоскопического исследования и/или признаков смешанного или щелочного рефлюкса при проведении суточной пищеводной рН-метрии. УДХК рекомендовано применять в схемах лечения рефлюкс-индуцированного гастрита у больных, перенесших операции на желудке и желчном пузыре, а также при ассоциированных с дуоденогастральным рефлюксом геликобактерном гастрите, функциональной диспепсии и сочетании ГЭРБ с функциональной диспепсией. Для повышения эффективности лечения больных ГЭРБ имеют значение и другие позитивные свойства УДХК — способность повышать холерез и холекинез, оказывать антихолестатический эффект, улучшать физико-химические и бактерицидные свойства желчи, уменьшать выделение желчи в межпищеварительный период и выраженность дисхолии.
Для лечения билиарного рефлюкса УДХК (Урсосан) применяется по 5-10 мг/кг/сут в 1-2 приема. Однократный прием (обычно 1-2 капс.) рекомендуется в вечернее время перед сном. Более высокие дозы целесообразно делить на 2-3 приема. И.В. Маев и соавт. (2012) рекомендуют прием Урсосана для лечения пациентов с ГЭРБ дважды в день — перед завтраком и обедом [39]. Длительность применения УДХК при ГЭРБ в каждом конкретном случае определяется индивидуально и составляет от 2 недель до 6 месяцев. Эффективность УДХК синергично усиливается при комбинации с прокинетиком и ИПП.
Заключение
Анализ многочисленной отечественной и зарубежной литературы, а также собственный многолетний опыт свидетельствуют о высокой эффективности стандартизированной антисекреторной терапии ИПП большинства больных ГЭРБ. Отсутствие эффекта от адекватно проводимой медикаментозной терапии и выполнения рекомендуемых больным ГЭРБ немедикаментозных мероприятий требует в каждом конкретном случае детального уточнения причин. Клинически значимое нарушение моторно-эвакуаторной функции эзофагогастродуоденальной зоны, не корригируемое ИПП, особенно сочетание ГЭРБ с функциональной диспепсией и билиарными дисфункциями, требует включения в комплексную терапию прокинетика, прежде всего, итоприда гидрохлорида (Итомед®), курсом не менее 1 месяца. Наличие у больных дуоденогастрального/дуоденогастроэзофагеального рефлюкса диктует необходимость применения УДХК (Урсосан). При этом оптимальная эффективность терапии может быть достигнута при комбинации ИПП с итопридом и УДХК.
Список литературы
- DentJ., EL-Serag H.B.,Walander M.A. et al. Epidemiology of gastroesophageal reflux disease. A systematic review. Gut 2005; 54: 710-16.
- Лазебник Л.Б., Машарова А.А., Бордин Д.С. и др. Результаты Многоцентрового исследования «Эпидемиология Гастроэзофагеальной Рефлюксной болезни в России (МЭГРЕ)». Терапевтический архив. 2011; 1: 45-50.
- Зверева С.И. Распространенность и особенности клинических проявлений гастроэзофагеальной рефлюксной болезни в республике Мордовия (по данным исследования «МЭГРЕ»). Экспериментальная и клиническая гастроэнтерология. 2010; 9: 9-14.
- Гастроэнтерология. Национальное руководство // Под ред. В.Т. Ивашкина, Т.Л. Лапиной. М.: ГЭОТАР-Медиа, 2008. С. 397-403.
- Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (4-е Московское соглашение). Экспериментальная и клиническая гастроэнтерология. 2010; 5: 113-118.
- Трухманов А.С, Джахая Н.Л., Кайбышева В.О., Сторонова О.А. Новые аспекты рекомендаций по лечению больных гастроэзофагеальной рефлюксной болезнью. Гастроэнтерология и гепатология. 2013; 2: 2-9.
- Fletcher J.,Wirz A.,Young J. etal. Unbuffered highly acadic gastric juice exist at the gastroesophageal function after a meal. Gastroenterology. 2001; 121; 4: 775-783.
- Бордин Д.С, Колбасников С.В. Патогенетические основы развития гастроэзофагеальной рефлюксной болезни. Диагностика и лечение. Вестник семейной медицины. 2013; 1: 30-34.
- Vakil N., van Zanden S.V., Kahrilas P. et al. The Monreal defenition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterology. 2006; 101; 8:1900-1920.
- Hershcovici Т., Fass R. Gastroesophageal reflux disease: beyond proton pump inhibitor therapy. Drugs. 2011; 71 (18): 2381-9.
- Katz P.O. et al. Guidelines for the Diagnosis and Management of Gastroesophageal Reflux Disease. Am J Gastroenterol 2013; 108: 308-328.
- Allaix M.E., Patti M.G. Current status of diagnosis and treatment of GERD in the US. Minerva Gastroenterol Dietol. 2013; 59 (1): 41-8.
- Kircheiner J., Glatt S., Fuhr U. et al. Relative potency of proton-pump inhibitors — comparison of effects on intragastric pH. Eur J Clin Pharmacol. 2009; 65: 19-31.
- Blume H. et al. Drug Safety 2006; 29 (9): 15-20.
- Galmiche J.P., Haltebakk J., Attwood S. et al. JAMA. 2011; 305 (19): 1969-77.
- Edwards J., Lind Т., Lundell L.T., Das R. Systematic reviev standard and double-dose proton pump inhibitors for the healing of severe erosive oesophagitis — a mixed treatment comparison of randomuced controlled trials. Aliment Pharmacol Ther 2009; 30: 547-56.
- Katz P.O., Ginsberg G.G., Hoyle P.E. et al. Relationship between intragastric acid control and healing status in the treatment of moderate to severe erosive oesophagitis. Asliment Pharmacol Ther. 2007; 25: 617-28.
- Sachs G., Shin J.M., Vagin 0. et al. The gastric H,K-ATPase as a drug target: past, present, and future. J. Clin. Gastroenterol. 2007; 41 (Suppl. 2): S226-242.
- Dellon E.S., Shaheen N.J. Persistent reflux symptoms in the proton pump inhibitor. Era the changing face gastroesophageal reflux disease. Gastroenterology. 2010; 139: 7-13.
- AGA. GERD patient study. Patients and their medications. Available at. http://www.gastro.org/userassets/ documents/13_Media/GERD_Survey_Final_Report_2pdf, 2008. Accessed March 24, 2010.
- Кайбышева В.А., Трухманов А.С, Ивашкин В.Т. Гастроэзофагеальная рефлюксная болезнь, резистентная к терапии ингибиторами протонной помпы. Рос. журн. гастроэнтерол., гепатол., колопрокт. 2011; 4: 4-10.
- Пасечников В.Д., Пасечников Д.В. Как добиться максимальной эффективности медикаментозной терапии гастроэзофагеальной рефлюксной болезни. Фарматека. 2008; 13: 68-72.
- Pellegrini С.A., DeMeester T.R., Wernly Л.A. et al. Alkaline gastroesophagel reflux. Am. 3. Surg. 1978; 135 (2): 177-184.
- Veli M.F., Camacho-Lobalo L., Srinivasan R. et al. Simultaneous intraesophageal impedance and pH measurement of acid and vovacid gastroesophageal reflux: effect of omeprasole. Gastroenterology. 2001; 120: 1599-98.
- Буеверов А.О., Лапина Т.Л. Дуоденогастроэзофагеальный рефлюкс как причина рефлюкс-эзофагита. Фарматека. 2006; 1: 1-5.
- Лапина Т.Л., Буеверов А.О. Горечь во рту: интерпретация гастроэнтеролога//Клин. перспективы гастроэнтерологии, гепатологии. 2013; 3: 18-24.
- Mabrut J.U., Colland J.M., Baulieux 3. Duodenogastric and gastroesophageal bile reflux. 3. Chir. (Paris). 2006; 143 (6): 355-365.
- Nehra D. Composition oftherefluxate in Barrett esophagus. Vol. 1. Paris: John Libbey Eurotext 2003: 18-21.
- Xu X.R., Li Z.S., Zou D.W. et al. Role of duodeno-gastroesophageal reflux in the pathogenesis of esophageal mucosal injury and gastroesophageal reflux symptoms. Can J GastroenteroL 2006; 20: 91-94.
- Kunsch S., Neesse A., Schroder W. et al. Prospective evaluation of duodenogastroesophageal reflux in gastroesophageal reflux disease patients refractory to protein pump inhibitor therapy. Digestion. 2012; 86: 315-322.
- Karamanolis G., Vanuytsel Т., Sifrim D. et al. Yield of 24-h esophageal pH and bilitec monitoring in patients with persisting symptoms on PPI therapy. Dig Dis Sci 2008; 53: 2387-93.
- Fass R. Proton pump inhibitor failure — what are the therapeutic options? Am. J. GastroenteroL 2009; 104 (Suppl. 2): 33-38.
- Sifrim D., Holloway R. Transient lower esophageaL spchinter relaxations: how many or how harmful? Am. J. GastroenteroL 2001; 96 (9): 2529-32.
- Scarpignato C, Pelosini I., Contini S. What is the effect of acid supression with proton pump inhibitors on esophageal and gastric motility? In: Giuli R. et al., editros. Paris. John Libbey Eurotext 2006: 262-271.
- Richter J.E. Duodenogastric reflux-induced (alkaline) esophagitis. Curr Treat Options gastroenterol 2004; 7: 53-8.
- Holtmann G., Talley N.J., Liebregts T. et al. A placebo-controlled trial of itopride in functional dyspepsia. N. Engl. J. Med. 2006. 354; 8: 832-40.
- Scarpellini E., Vos R., Blondeau K. et al. The effects of itopride on oesophageal motility and lower oesophageal sphincter function in man. Aliment Pharmacol. Ther. 2011. 33; 1: 99-105.
- Tack J. Prokinetics and fundic relaxants in upper functional Gl disorders. Curr Opion Pharmacol. 2008; 8 (6): 690-696.
- Маев И.В., Дичева Д.Т., Андреев Д.Н. Подходы к индивидуализации лечения гастроэзофагеальной рефлюксной болезни. Гастроэнтерология. 2012; 4: 1-5.
Статья опубликована на сайте http://www.gastroscan.ru
материал с сайта MedLinks.ru







