Введение
В современных условиях наблюдается изменение парадигмы репродуктивного поведения женщин: преобладающей целью становится карьера, завоевание и повышение социального статуса. Создание семьи и рождение детей откладывается на более поздние сроки, и обычно это возраст старше 30, а нередко и 35 лет. В то же время состояние репродуктивного здоровья в современных условиях имеет тенденцию к ухудшению. Одной из важных проблем является преждевременная недостаточность яичников (ПНЯ), которая инициирует проблему бесплодия, с одной стороны, и проблему преждевременной менопаузы со всеми сопутствующими ей социально-психологическими аспектами — с другой. По данным литературы [1–3], популяционная частота ПНЯ составляет 1,5%, а в группе пациенток с вторичной аменореей данный показатель достигает 10%. Возможными причинами ПНЯ могут быть генетические и хромосомные дефекты, повреждение фолликулов в детском, подростковом и раннем репродуктивном возрасте, воспалительные процессы, аутоиммунные нарушения, соматическая патология, социальные факторы, ятрогении и др. [1, 4, 5]. Тем не менее научно обоснованной теории патогенеза идиопатической ПНЯ до настоящего времени не сформировано. Важность проблемы заключается также и в том, что ранняя (40–45 лет) менопауза является фактором, увеличивающим заболеваемость и смертность от сердечно-сосудистой патологии, частоту развития эндокринных расстройств (сахарного диабета в первую очередь), метаболических нарушений, остеопороза, депрессий и других психологических и психических нарушений [1, 2, 6–10].
Основным методом лечения менопаузальных расстройств является гормональная, по сути симптоматическая, терапия, в сочетании с симптоматическим лечением наиболее выраженных клинических проявлений и сопутствующих заболеваний с использованием селективных ингибиторов обратного захвата серотонина, витаминов, препаратов кальция, препаратов цимицифуги, немедикаментозных методов терапии1. Однако при назначении менопаузальной гормонотерапии (МГТ) необходимо учитывать противопоказания, существующие у многих пациенток, что в определенной степени ограничивает ее применение. А необходимость использования нескольких препаратов одновременно не только снижает комплаентность, но и повышает риск возникновения побочных реакций. Клинические рекомендации Минздрава России «Менопауза и климактерическое состояние у женщины»1 рекомендуют также использование полипептидов эпифиза крупного рогатого скота, учитывая имеющиеся данные об их положительном влиянии не только на купирование нейровегетативных симптомов, но и на функцию яичников и фертильность у пациенток с ранней менопаузой. Однако там же1подчеркивается необходимость проведения дальнейших исследований по оценке эффективности данного препарата у различных категорий пациенток, что и стало основанием для проведения данного исследования.
Цель исследования: изучить терапевтические возможности препарата полипептидов эпифиза крупного рогатого скота при ПНЯ и ановуляторной форме бесплодия у пациенток 30–45 лет.
Содержание статьи
Материал и методы
В исследование включали женщин европеоидной расы в возрасте 30–45 лет с индексом массы тела (ИМТ) в пределах 18,5–29,9 кг/м2 с ановуляторной формой бесплодия продолжительностью от 1 года до 5 лет или с неудачными попытками ЭКО (3 пациентки, включенные в основную группу, и 1 — в контрольную) с признаками овариальной недостаточности, определявшейся по следующим показателям: концентрация фолликулостимулирующего гормона (ФСГ) ≥12 МЕ/л, антимюллерова гормона (АМГ) 0,2–1,2 нг/мл; количество антральных фолликулов ≤5 при ультразвуковом исследовании (УЗИ) на 7±2 день менструального цикла; снижение концентрации эстрадиола в сыворотке крови в эти же дни цикла. Основной причиной обращения к врачу стало психологическое неприятие пациентками факта, что их репродуктивный потенциал исчерпан и наступил преждевременный или ранний (до 45 лет) менопаузальный период. По данным обследования женщины не имели противопоказаний к назначению МГТ.
Критерии невключения в исследование: наличие клинически значимых отклонений при гинекологическом осмотре во время скрининга, включающих следующие, но не ограничивающихся ими: аномальные маточные кровотечения невыявленной этиологии, кровотечения из половых путей в период скрининга по данным гинекологического осмотра или анамнеза; субмукозная миома матки или множественные узлы другой локализации более 3 см в диаметре при УЗИ; патология эндометрия: гиперплазия, полипы, хронический эндометрит (структурные изменения по результатам УЗИ и/или аспирационной биопсии эндометрия с иммуногистохимическим исследованием на CD138) на момент скрининга; беременность или период грудного вскармливания; клинически значимые отклонения основных жизненно важных показателей (частота сердечных сокращений, артериальное давление (АД), частота дыхания, температура тела), которые, по мнению исследователя, могут негативно повлиять на результаты исследования; клинически значимые отклонения по данным лабораторных исследований во время скрининга, а также превышение нормальных значений (верхней границы нормы) в период скрининга уровней АСТ, АЛТ или общего билирубина в 1,5 раза; ИМТ более 35,0 кг/м2; сахарный диабет 1 типа и другие эндокринные или системные заболевания, потенциально оказывающие влияние на физиологию репродукции человека; снижение овариального резерва, в том числе ПНЯ, диагностированная более чем за 5 лет до включения в исследование; мужской фактор бесплодия; женское бесплодие трубного (МКБ-10/N97.1), маточного (МКБ-10/N97.2) и/или цервикального (МКБ-10/N97.3) происхождения; генетические факторы бесплодия; эндокринные причины бесплодия: гипогонадотропная гипоэстрогенная ан-овуляция (функциональная гипоталамическая аменорея), гипогонадотропный гипогонадизм, гипопитуитаризм; синдром поликистозных яичников; гиперпролактинемия (концентрация пролактина в сыворотке крови >550 мЕд/л (27 нг/мл) в двух пробах при нормальном содержании макропролактина либо концентрация пролактина в сыворотке крови >5000 мЕд/л (250 нг/мл) при однократном определении вне зависимости от содержания макропролактина); наличие в анамнезе аутоиммунных заболеваний за исключением компенсированного (тиреотропный гормон от 0,4 до 4,2 мкМЕ/мл) аутоиммунного тиреоидита; инсулинотерапия; острые воспалительные заболевания в течение 3 нед. от момента полного выздоровления до периода скрининга; проводимая гормональная терапия (в том числе кортикостероиды, эстрогены, гестагены) за 8 нед. до скрининга; онкологические заболевания любой локализации; рак молочной железы в анамнезе или по результатам скрининга; результаты цитологического исследования ASCUS, любая степень CIN или carcinoma in situ по данным лаборатории при скрининге, проведенном не ранее чем за 6 мес. до включения в исследование; эпилепсия, деменция или болезнь Альцгеймера по данным анамнеза на момент скрининга; наличие в анамнезе или выявление в период скрининга клинически значимой патологии, в том числе, но не ограничиваясь ею: нестабильной стенокардии, инфаркта миокарда, аритмии, требующей медикаментозной терапии, застойной сердечной недостаточности III или IV класса по классификации Нью-Йоркской кардиологической ассоциации в течение 1 года до скрининга, неконтролируемой гипертензии, травм головного мозга, инсульта или транзиторной ишемической атаки в течение 12 мес. до скрининга, почечной недостаточности (скорость клубочковой фильтрации менее 30 мл/мин), печеночной недостаточности тяжелой и средней степени тяжести; участие пациентки в другом клиническом исследовании; применение любых экспериментальных препаратов или экспериментальных устройств медицинского назначения в течение 3 мес. или в течение периода времени, равного пяти периодам полувыведения препарата, до первого введения исследуемого препарата (в зависимости от того, какой из этих сроков более длительный); наличие любых других патологий, которые, по мнению исследователя, являются противопоказанием для участия в исследовании (т. е. могут негативным образом повлиять на состояние пациентки в случае ее участия в исследовании), могут помешать проведению процедур, применяемых в исследовании, или повлиять на интерпретацию результатов исследования; курение.
Критерии исключения из исследования: решение исследователя об исключении пациентки в интересах самой пациентки; ошибочное включение (нарушение критериев включения и невключения); решение исследователя исключить пациентку из исследования вследствие серьезного отклонения/нарушения протокола; серьезная нежелательная реакция; любая нежелательная реакция, требующая наблюдения, проведения процедур и/или медикаментозного лечения, не разрешенных протоколом настоящего исследования; отказ пациентки от дальнейшего участия в исследовании или ее недисциплинированность; неявка пациентки на визит или потеря связи с ней.
На начальном этапе был проведен скрининг для отбора пациенток. После оценки соответствия критериям включения и невключения в исследование были включены 40 женщин, ранее не получавших препараты МГТ. Женщины были рандомизированы на 2 группы по 20 человек. Пациентки основной группы в течение двух менструальных циклов получали препарат МГТ, содержащий 2 мг эстрадиола и 10 мг дидрогестерона, внутрь по 1 таблетке в сутки в непрерывном циклическом режиме с 1-го по 28-й день (препарат содержит минимальное количество гормонов, не оказывающее депрессивного действия на функцию яичников, но способствующее циклическим изменениям эндометрия) и препарат полипептидов эпифиза рогатого скота (Пинеамин®) лиофилизат для приготовления раствора для внутримышечного введения 10 мг (ООО «Герофарм», Россия) внутримышечно ежедневно в течение 10 дней с 5-го по 14-й день менструального цикла.
В ходе исследования, продолжавшегося 60–70 дней, пациентки выполнили 5 визитов к врачу: на 1–4-й день, 15–23-й день, 29–32-й день (при подозрении на беременность проводили исследование крови на хорионический гонадотропин, при отсутствии беременности назначали 2-й курс лечения), 43–56-й день исследования и после его завершения (60–70-й день). В случае выявления при УЗИ формирования желтого тела на 21–23-й день менструального цикла после первого курса введения изучаемого препарата второй курс не проводили, и пациентка оставалась под наблюдением, в ином случае повторяли 28-дневный цикл комбинированной терапии. Пациентки контрольной группы в течение двух менструальных циклов получали только препарат МГТ по аналогичной схеме.
При возникновении побочных реакций, нарушений самочувствия, которые можно было связать с проводимым лечением, пациентка должна была немедленно обратиться к лечащему врачу.
В ходе исследования в обеих группах оценивали:
-
динамику толщины эндометрия и роста фолликула, маркеры овуляции (желтое тело) на 15–16-й и 21–23-й дни менструального цикла по данным УЗИ, которое выполняли на аппарате Voluson E8 Logic;
-
концентрацию ФСГ, лютеинизирующего гормона (ЛГ), эстрадиола, АМГ до лечения и в следующем цикле после окончания лечения по сравнению с исходным значением (как при наличии желтого тела, так и при его отсутствии после 2-го курса лечения);
-
количество пациенток с нормализовавшимся менструальным циклом и спонтанно наступившей беременностью.
Все пациентки были должным образом информированы о методике, сроках и возможных побочных реакциях в процессе исследования и дали письменное согласие на участие в нем. Препарат назначали в соответствии с инструкцией2 и показанием «нейровегетативные симптомы на фоне дефицита эстрогенов».
Переносимость препарата оценивали по отсутствию или появлению побочных реакций, а также каких-либо новых негативных субъективных и объективных изменений состояния или изменения результатов лабораторных исследований за пределами референтных значений.
Оценка безопасности проводилась по следующим параметрам:
-
Частота развития нежелательных явлений (НЯ) по данным субъективных жалоб, физикального обследования, показателей АД, лабораторных анализов (клинический и биохимический анализы крови).
-
Частота развития НЯ особого интереса: кровотечения из половых путей, формирование патологии эндометрия по результатам УЗИ.
Статистическая обработка полученных результатов проведена с использованием программы Microsoft Excel 2016. При проверке показателей на нормальность распределения с использованием критерия Колмогорова — Смирнова распределение соответствовало нормальному, что позволило оценивать сравниваемые показатели с использованием t-критерия Стьюдента. Статистически значимыми считали различия при р≤0,05.
Результаты исследования
Пациентки основной и контрольной групп были сопоставимы по возрасту — 37,3±2,3 и 36,1±2,5 года в основной и контрольной группах соответственно, ИМТ — 23,6±2,8 и 24,5±2,2 кг/м2соответственно (р≥0,5 в обоих случаях). Не выявлено статистически значимых различий между группами по исходным (до лечения) показателям концентраций ФСГ, ЛГ, АМГ, эстрадиола, толщины эндометрия, по количеству и размерам антральных фолликулов (табл. 1, 2). У всех пациенток, включенных в исследование, присутствовали нейровегетативные симптомы эстрогенной недостаточности различной степени выраженности в виде приливов, эпизодической головной боли, потливости, колебаний АД, нарушений сна, депрессии, раздражительности, снижения работоспособности, либидо.

После первого курса лечения в основной группе у всех (100%) женщин отмечено купирование вышеуказанных нейровегетативных симптомов, в то время как в контрольной группе 16 (80%) пациенток отметили существенное снижение выраженности симптоматики, только у 4 (20%) симптомы полностью купировались. После двух курсов лечения нейровегетативные симптомы у пациенток основной группы отсутствовали. В контрольной группе полное купирование симптомов констатировали в 17 (85%) наблюдениях, сохранение слабовыраженных нейровегетативных нарушений — в 3 (15%).
При оценке динамики показателей гормонального статуса установлено, что в основной группе имело место статистически значимое (р≤0,05) относительно исходных значений снижение уровней ФСГ и ЛГ, а также увеличение концентрации эстрадиола, тогда как в контрольной группе снижение концентраций ФСГ, ЛГ и увеличение концентрации эстрадиола были статистически незначимыми. При отсутствии исходных межгрупповых различий по этим параметрам изменение в основной группе было существенно более выраженным, чем в контрольной группе (р≤0,05) (см. табл. 1).
Концентрация АМГ до лечения практически не различалась в сравниваемых группах (р≥0,5), после завершения курса терапии отмечено несущественное увеличение его концентрации в обеих группах, при этом также не было достоверных различий в концентрации АМГ между группами после лечения (р≥0,5). Однако представляет интерес следующее: беременность наступила у пациенток, получавших Пинеамин®, при исходном уровне АМГ 0,94 и 0,49 нг/мл, а восстановление овуляторного цикла (визуализация желтого тела при УЗИ) наблюдалось у четырех пациенток с исходной концентрацией АМГ 0,76–0,90 нг/мл. У этих же пациенток после лечения отмечен рост уровня АМГ на 9,7–38,8%. При анализе индивидуальных изменений показателей АМГ у остальных 14 пациенток основной группы установлено, что в 11 случаях наблюдался рост его концентрации на 5–33,3%, в двух — уровень АМГ практически не изменился, а в одном — отмечено незначительное снижение его концентрации после курса лечения, что позволяет предположить наличие нескольких механизмов, влияющих на концентрацию АМГ в организме.
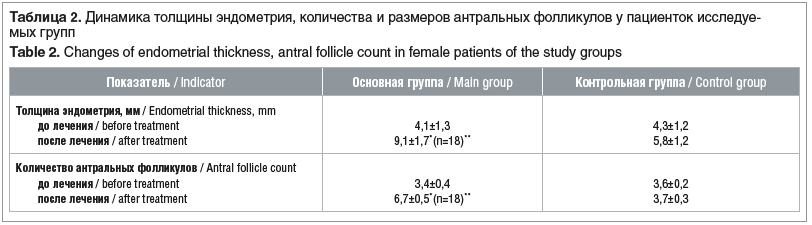
Увеличение концентрации эстрадиола в основной группе оказало положительное влияние на пролиферацию эндометрия: после лечения толщина эндометрия по данным УЗИ достоверно увеличилась у пациенток основной группы (р≤0,05) и практически не изменилась в контрольной группе (р≥0,5). Количество антральных фолликулов также значительно увеличилось у пациенток, получавших комбинированную терапию (р≤0,05), и практически не изменилось при использовании только препарата МГТ (см. табл. 2).
У четырех пациенток основной группы во втором цикле терапии отмечено формирование желтого тела, а еще в двух случаях наступила естественная запланированная беременность, т. е. восстановление двухфазного менструального цикла имело место в 30% наблюдений. При использовании монотерапии препаратом МГТ ни в одном случае желтое тело не обнаружено.
В ходе исследования, а также после его завершения не зарегистрировано НЯ или осложнений. Все пациентки оценили переносимость Пинеамина как отличную. При объективном и лабораторном контроле не было выявлено патологических отклонений исследуемых параметров.
Обсуждение
В настоящее время причины идиопатической ПНЯ остаются недостаточно изученными, что делает крайне сложной разработку патогенетических подходов к терапии данного состояния. Одним из возможных звеньев патогенеза может быть окислительный стресс и его повреждающее действие на клетки гранулезы яичника, что ведет к преждевременной гибели фолликулов. Эндогенный мелатонин может снижать степень выраженности окислительного стресса путем регулирования баланса окислителей и антиоксидантов, кроме того, он может принимать непосредственное участие в фолликулогенезе путем воздействия на сигнальный путь Hippo [11, 12]. Препарат Пинеамин® представляет собой комплекс водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота, и относится к классу нейропептидных блокаторов вазомоторных триггеров [13]. Один из механизмов действия препарата заключается в возможности увеличения функциональной активности пинеалоцитов и, как следствие, увеличения продукции и экскреции эндогенного мелатонина, что в свою очередь приводит к увеличению синтеза гонадотропинингибирующего гормона, снижающего активность KNDy-, NK3 и KISS-нейронов [11, 14, 15]. Результаты нашего исследования показали эффективность данного препарата в коррекции функции яичников: выявлено достоверное снижение продукции ФСГ, ЛГ; увеличение количества антральных фолликулов, концентрации эстрогенов; активация роста эндометрия; достигнуто восстановление двухфазного менструального цикла: в двух случаях наступила беременность при безуспешном предшествующем лечении бесплодия, еще у четырех пациенток визуализировалось желтое тело. Достигнут 100% клинический эффект в лечении нейровегетативных симптомов. Полученные результаты согласуются с данными других исследований эффективности данного препарата как в лечении ПНЯ, так и в коррекции нейровегетативных симптомов [6, 16, 17]. В нашем исследовании препарат применялся в первой фазе искусственно созданного цикла, однако сравнение результатов различных исследований позволяет предположить, что действие препарата эффективно проявляется при его введении как в первой, так и во второй фазе искусственно созданного цикла [6, 16].
В проведенном клиническом исследовании не выявлено существенного увеличения уровня АМГ в основной группе, однако разнородность изменения его концентрации после курса лечения от снижения на 3,5% до роста на 33,3% свидетельствует, с одной стороны, об эффективности Пинеамина в ряде случаев, а с другой — о возможности существования различных патогенетических механизмов, ведущих к снижению продукции эндогенного мелатонина или нарушению его активности, метаболизма и, как следствие, отсутствию эффекта от применения препарата. Известно, что АМГ вырабатывается клетками гранулезы преантральных и антральных фолликулов и играет важную роль в фолликулогенезе, участвуя в инициации роста фолликулов и регулируя порог чувствительности к ФСГ [18]. Установлено, что на концентрацию АМГ могут оказывать влияние многие факторы: выявлена прямая зависимость между уровнем АМГ в сыворотке крови и концентрацией 25-гидроксивитамина D [18]. Установлена связь между степенью выраженности дисменореи, регулярностью менструального цикла и концентрацией АМГ [18, 19], уровень АМГ часто повышен у женщин с синдромом поликистозных яичников [20]. При эндометриозе его уровень также может быть изменен [21]. Имеются данные о возможных вариациях концентрации АМГ в разные дни менструального цикла [22]. Поэтому нельзя исключить положительного влияния Пинеамина на продукцию АМГ — необходимо проведение дальнейших исследований по влиянию данного препарата на концентрацию АМГ у различных групп пациенток.
Доказана эффективность Пинеамина в коррекции нейровегетативных менопаузальных симптомов [6, 17]. Проведенное исследование подтвердило его клиническую эффективность в купировании нейровегетативных симптомов гипоэстрогении у пациенток репродуктивного возраста с ПНЯ: во-первых, субъективной оценкой пациенток, во-вторых, достоверным увеличением концентрации эстрогенов по сравнению с контрольной группой. В исследование были включены женщины 30–45 лет, т. е. среднего и позднего репродуктивного возраста. Положительная динамика показателей у пациенток основной группы связана с воздействием Пинеамина на функцию эндокринных желез и активацией выработки собственных гормонов. Отсутствие положительной динамики в восстановлении гормонального баланса у пациенток контрольной группы можно объяснить заместительным (т. е. симптоматическим) действием препарата, компенсирующим дефицит гормонов в организме без активирующего действия на продукцию собственных гормонов.
Заключение
Таким образом, результаты проведенного нами исследования доказывают, что использование препарата полипептидов эпифиза рогатого скота (Пинеамин®) внутримышечно ежедневно в течение 10 дней с 5-го по 14-й день менструального цикла в сочетании с эстроген-гестагенным препаратом в непрерывном циклическом режиме в течение двух менструальных циклов у пациенток с ановуляторной формой бесплодия оказывает выраженный терапевтический эффект, заключающийся в купировании нейровегетативных симптомов, снижении концентраций ФСГ и ЛГ, активации фолликулогенеза (увеличение количества антральных фолликулов), следствием чего стали увеличение концентрации эстрадиола и активация пролиферативной фазы в эндометрии. У шести пациенток восстановился овуляторный цикл: в двух случаях наступила беременность, а еще в четырех — при УЗИ обнаруживалось желтое тело. Полученные результаты свидетельствуют об эффективности препарата Пинеамин®в лечении пациенток с ПНЯ и ановуляторной формой бесплодия и позволяют рекомендовать разработанную схему лечения к практическому применению.
1Клинические рекомендации. Менопауза и климактерическое состояние у женщины. 2021. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/schema/117_2 (дата обращения: 21.02.2024).
2Листок-вкладыш — информация для пациента. Пинеамин®, 10 мг, лиофилизат для приготовления раствора для внутримышечного введения. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=82e79524-baa5-4e12-8c00-2d50ddf4c259 (дата обращения: 29.02.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Хардиков Александр Владимирович — д.м.н., доцент кафедры акушерства и гинекологии ФГБОУ ВО КГМУ Минздрава России; 305041, Россия, г. Курск, ул. Карла Маркса, д. 3; ORCID iD 0000-0002-7394-4622.
Нетяга Ольга Александровна — врач акушер-гинеколог ООО «Медассист-К»; 305000, Россия, г. Курск, ул. Димитрова, д. 16; ORCID iD 0009-0001-6232-2887.
Контактная информация: Хардиков Александр Владимирович, е-mail: area313@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.01.2024.
Поступила после рецензирования 15.02.2024.
Принята в печать 14.03.2024.
ABOUT THE AUTHORS:
Alexander V. Khardikov — Dr. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology, Kusrk State Medical University; 3, K. Marks str., Kursk, 305041, Russian Federation; ORCID iD 0000-0002-7394-4622.
Olga A. Netyaga — obstetrician-gynecologist, «Medassist-K» LLC; 16, Dimitrov str., Kursk, 305000, Russian Federation; ORCID iD 0009-0001-6232-2887.
Contact information: Alexander V. Khardikov, e-mail: area313@mail.ru.
There is no conflict of interest.
Financial Disclosure: autors have no a financial or property interest in any material or method mentioned.
Received 23.01.2024.
Revised 15.02.2024.
Accepted 14.03.2024.
Информация с rmj.ru




