Возможности достижения максимального эффекта при
контролируемом лечении ревматоидного артрита в реальной практике
Н. В. Чичасова, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Ревматоидный артрит (РА) — болезнь с неизвестной этиологией, чрезвычайно
сложным многокомпонентным патогенезом, в связи с чем терапия в течение многих
лет осуществлялась, по сути, эмпирически. За последние 50 лет в лечении РА
произошли кардинальные изменения. Были внедрены и с успехом применяются новые
синтетические базисные противовоспалительные препараты (БПВП) — метотрексат
(МТ), лефлуномид (Леф), которые отличаются от ранее используемых солей золота,
Д-пеницилламина, алкилирующих цитостатиков явно лучшей переносимостью и,
соответственно, возможностью длительного применения. В XXI веке в практику вошло
использование генно-инженерных биологических препаратов (ГИБП), способных
надежно подавить воспаление и прогрессирование деструкции суставов.
Изменились стратегические подходы к лечению РА. Четко сформулированы принципы
контролируемого лечения РА («Treatment to target», «T2T», «Лечение до достижения
цели»), сформулированные комитетом европейских экспертов и опубликованные в 2010
г. [1]:
А. Лечение РА должно базироваться на постоянном
контакте больного и врача.
B. Первичная задача лечения больного с РА — максимально длительное сохранение
качества жизни путем контроля симптомов, предупреждения деструкции, нормализации
функции и социальной адаптации.
C. Подавление воспаления — наиболее важный путь к достижению этой цели.
D. Лечение до достижения цели («Treatment to target») путем измерения активности
болезни и коррекции терапии для оптимизации исходов РА.
Весьма примечательно, что первый принцип этой программы говорит о
необходимости контакта между врачом и пациентом. Об образовании больных и
привлечении их к процессу лечения, как возможности сократить время для
достижения цели лечения — ремиссии или низкой активности РА, речь пойдет ниже.
Рекомендации по лечению РА говорят о необходимости жесткого контроля («tight»-контроль)
за течением РА:
1) необходимость ежемесячных осмотров больных при
наличии умеренной/высокой активности болезни для своевременной коррекции
терапии, при достижении цели лечения осмотры могут быть реже — раз в 3–6
месяцев;
2) констатация улучшения (по мнению больного или врача) не является достаточным
результатом лечения, цель терапии — достижение низкой активности,
предпочтительнее — ремиссии;
3) следует максимально объективизировать оценку активности; впечатления врача
или больного не являются ориентирами при оценке эффекта терапии, следует
опираться на объективную оценку различных параметров активности, таких как
количество пораженных суставов, оценка активности по визуально-аналоговой шкале
(ВАШ), острофазовые тесты крови;
4) следует скрупулезно оценивать результат терапии: например, DAS28 2,7 не равно
DAS28 2,6 (критерий ремиссии); это означает, что надо корригировать (наращивать)
терапию, стремясь к достижению ремиссии.
Таким образом, тактика лечения РА предполагает выбор препарата с учетом
сопутствующих заболеваний, коррекцию лечения в зависимости от эффективности и
переносимости. Преимущества контролируемого лечения РА были продемонстрированы в
рандомизированном клиническом исследовании (РКИ) TIGORA [2, 3], которое сравнило
результаты 18-месячного лечения двух групп больных РА: в 1-й группе лечение
проводилось со строгим ежемесячным контролем изменения активности РА по индексу
активности болезни (DAS) («tight»-контроль) и в соответствии с динамикой DAS
корригировалась терапия («интенсивная» группа). Во 2-й группе лечение
проводилось «рутинным способом» без такого жесткого контроля. К концу
исследования ремиссия была достигнута у 65% больных 1-й группы и только у 16%
больных 2-й группы. Увеличение числа эрозий было меньше в 1-й группе.
Контролируемое лечение («интенсивная» группа) сопровождалось более частой
коррекцией терапевтической тактики (использование комбинации БПВП, эскалация их
дозы, использование внутрисуставных введений глюкокортикоидов). Авторы при
анализе этих результатов пришли к выводу, что контроль за лечением обеспечивает
наилучшие результаты вне зависимости от выбора БПВП. Эти данные были
подтверждены в ряде зарубежных и отечественных исследований [4–7].
Новые диагностические критерии Американского колледжа ревматологов (American
College of Rheumatology, ACR) и Европейской антиревматической лиги (European
League Against Rheumatism, EULAR) 2010 года [8] позволяют диагностировать РА на
ранней стадии. Это позволяет назначать БПВП при раннем РА, что и отмечено в
международных и отечественных рекомендациях по использованию при РА БПВП и ГИБП
[9, 10]. Раннее назначение БПВП на сегодняшний день является обыденным. Хорошо
известно, что отсрочка с назначением БПВП приводит к худшим исходам РА. При
анализе 14 РКИ была оценена частота развития эффекта у 1435 больных (886
получали различные БПВП и 549 — плацебо) при различной длительности РА (табл.
1), учитывались демографические факторы (пол, возраст), функциональный класс (ФК)
по Steinbrocker, клинико-лабораторные параметры активности болезни (боль, число
болезненных суставов (ЧБС), число воспаленных суставов (ЧВС), СОЭ, опросник
оценки здоровья — Health Assessment Questionnaire (HAQ) и др.) [11]. При любой
длительности РА различия в частоте развития эффекта между активным лечением и
плацебо были примерно одинаковы — около 30%. По мере увеличения длительности РА
эффективность БПВП снижалась с 52% «ответчиков» (< 1 года) до 35% «ответчиков»
(> 10 лет) (табл. 1). По данным метаанализа 12 РКИ при раннем назначении
отмечалось достоверное уменьшение рентгенологического прогрессирования
разрушения суставов — стандартизированное среднее различие между началом и
концом наблюдения составило –0,19 (95% CI –0,34; –0,004), что на 33% меньше по
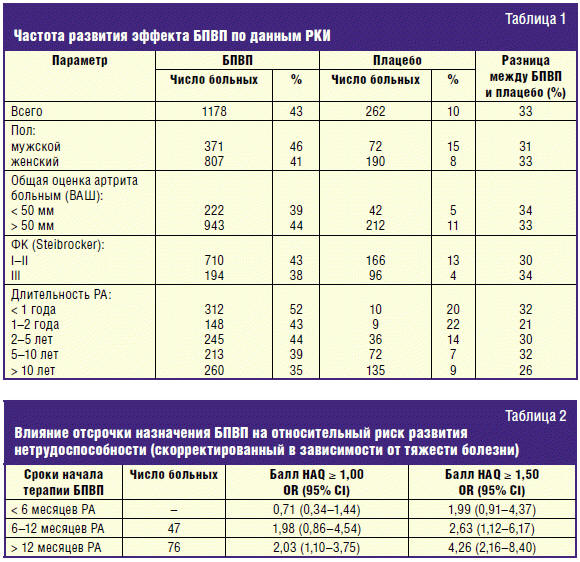
сравнению с более поздним началом терапии БПВП (рис. 1) [12]. Такие же
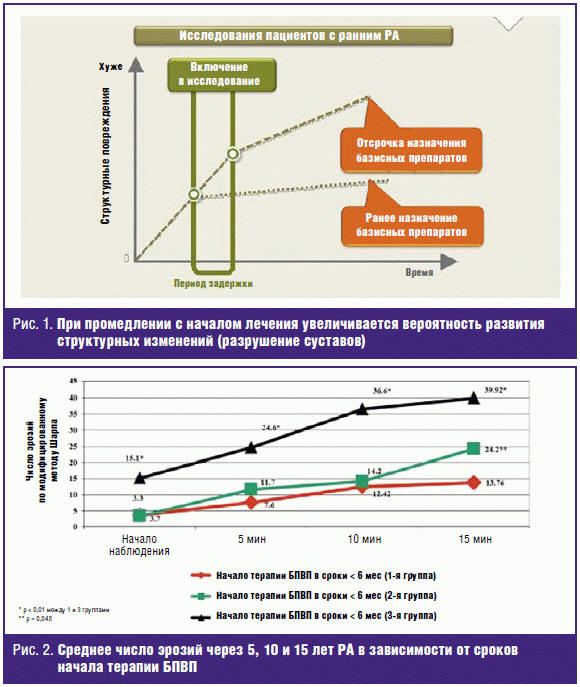
результаты получены нами при анализе появления новых эрозий у больных с
различными сроками начала терапии БПВП (рис. 2) [7]: в первые 6 месяцев РА, во
вторые 6 месяцев РА и при назначении БПВП в сроки более 12 месяцев РА.
Минимальное увеличение среднего числа эрозий отмечалось при назначении БПВП в
сроки до 6 месяцев РА: соответственно через 5, 10 и 15 лет — 7,6 ± 3,12; 12,42 ±
7,84; 13,76 ± 10,53. При назначении базисных препаратов во второе полугодие РА
количество эрозий до 10 лет болезни несколько выше, чем в первой группе (p >
0,05), и только к 15 годам различие в деструкции мелких суставов становится
близким к достоверному (р = 0,048). Задержка с назначением БПВП до 1–3 лет
приводит к заметно более выраженному увеличению числа эрозий в анализируемые
сроки, соответственно — 24,6 ± 16,81; 36,6 ± 19,22 и 39,02 ± 24,6 (между 1-й и
3-й группой на всех этапах р < 0,01). Предотвращение деструкции суставов
предотвращает и развитие необратимой утраты функции больного. Так, по данным
наблюдательного исследования трудоспособности большой когорты больных,
включенных в Норфолкский регистр (n = 384), при регрессионном анализе было
получено, что у пациентов с началом терапии в первые 6 месяцев РА через 5 лет
риск нарушения функции был в 2 раза меньше, чем у больных с отсроченным началом
лечения [13]. В табл. 2 приведен относительный риск нарушения функции через 5
лет болезни, оцененный по индексу HAQ, в зависимости от сроков начала БПВП. По
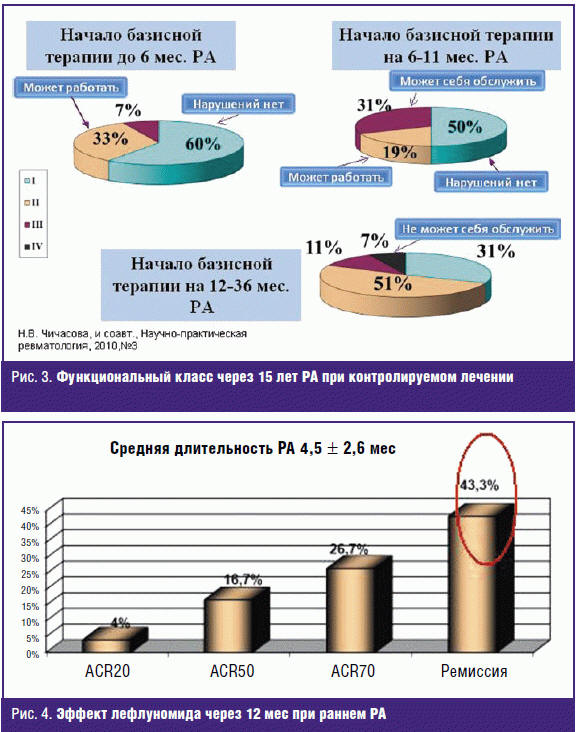
нашим данным [7] раннее получение БПВП (в первые и вторые 6 месяцев болезни)
способствует полному сохранению функции (функциональный класс I) через 15 лет
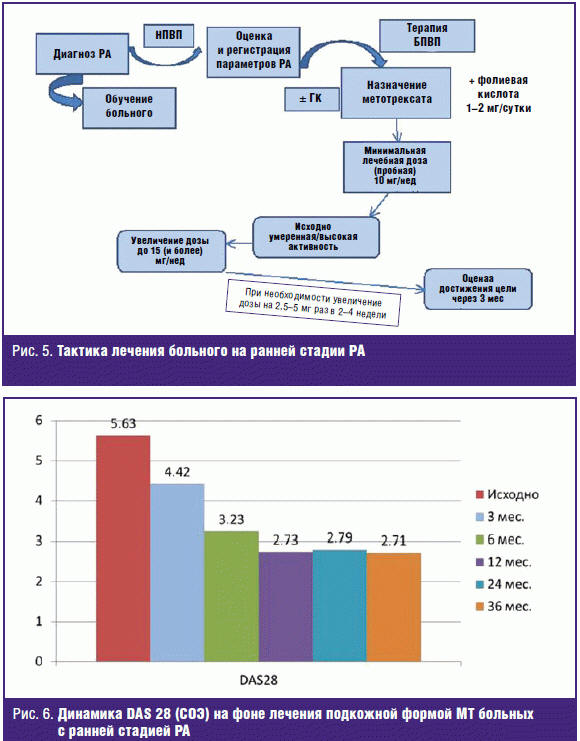
соответственно у 60% и 50% больных (рис. 3). В работе Д. Е. Каратеева, Е. Л.
Лучихиной и Е. Л. Насонова, представленной на Конгрессе Европейской
антиревматической лиги 2005 года [14], было показано, что назначение лефлуномида
больным с ранним РА (средняя длительность 4,5 ± 2,6 мес) позволяет добиться
ремиссии через 12 месяцев у 43,3% больных и еще у 26,7% больных 70% улучшения по
критериям Американского колледжа ревматологов (рис. 4).
По последним рекомендациям Европейской антиревматической лиги 2013 года [9] и
по отечественным рекомендациям [10] подтверждена первостепенная роль БПВП в
лечении РА. При этом МТ является препаратом «первой линии» и должен назначаться
всем пациентам с диагнозом РА (уровень доказательности A) и недифференцированным
артритом (НДА) при высокой вероятности развития РА (уровень доказательности С)
[10]. При недостаточной эффективности (или плохой переносимости) таблетированной
формы МТ до смены терапии БПВП и назначения ГИБП следует перевести пациентов на
парентеральную (подкожную) форму препарата (уровень доказательности B); у
пациентов с РА с высокой активностью, которым показано назначение высокой дозы
МТ (≥ 15 мг), рекомендуется начинать лечение с подкожной формы препарата
(уровень доказательности С) [10].
МТ обоснованно считается препаратом, с которого следует начинать лечение РА.
МТ является высокоэффективным препаратом, контролирующим активность и
прогрессирование РА [15, 16]. Причем эффект МТ является дозозависимым [17, 18].
Рекомендации по использованию МТ, разработанные в соответствии с принципами
доказательной медицины с использованием систематического обзора литературы и
учетом мнения 751 эксперта-ревматолога из 17 стран [19], включают:
- Необходимость оценки факторов риска развития нежелательных лекарственных
реакций (НЛР), исследования сывороточных трансаминаз, альбумина, креатинина,
клинического анализа крови, проведения рентгенологического исследования
органов грудной клетки, тестов на ВИЧ-инфекцию, гепатит В/С и беременность. - Рекомендуемые дозы МТ и способ введения. При отсутствии противопоказаний
(пожилой возраст, нарушение функции почек, печени, гематологические нарушения
и др.) минимальная пробная терапевтическая доза МТ составляет 10 мг/неделю, но
при лечении РА она должна быть сразу увеличена в течение первых недель лечения
до 15 мг/нед, а далее доза корригируется (по 2,5–5 мг каждые 2–4 недели) до
25–30 мг/неделю в зависимости от успеха лечения и переносимости препарата
(рис. 5). У пациентов с высокой активностью
РА, которые имеют показания для назначения высокой дозы МТ (≥ 15 мг),
рекомендуется начинать лечение препаратом подкожным (п/к) введением [10], так
как увеличение концентрации в сыворотке крови при увеличении дозы п/к формы
имеет более линейный вид, чем фармакокинетическая кривая при использовании
пероральной формы. - На фоне лечения МТ обязателен прием не менее 5–10 мг фолиевой кислоты в
неделю (не ранее чем через 24 часа после приема МТ), что позволяет снизить
риск НЛР [20].
Мониторинг переносимости МТ в начале лечения или при увеличении дозы МТ
включает определение АЛТ/АСТ, креатинина, проведение общего анализа крови, что
необходимо повторять каждые 1–1,5 месяца до достижения стабильной дозы МТ, затем
— каждые 3 месяца; клиническую оценку НЛР следует проводить во время каждого
визита пациентов. Лечение МТ следует прервать при повышении концентрации АЛТ/АСТ
> 3 верхней границы нормы (ВГН); возобновить лечение в более низкой дозе после
нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ > 3
ВГН следует скорректировать дозу МТ; при сохранении увеличения уровня АСТ/АЛТ >
3 ВГН после отмены МТ следует провести соответствующие диагностические
процедуры.
С учетом благоприятного профиля безопасности МТ его возможно использовать
длительно. В 6-летнем исследовании было показано, что при использовании МТ в
сравнении с другими средствами уменьшается риск преждевременной смерти (HR 0,3;
95% CI 0,2–0,7) [21]. В двух РКИ МТ показал отсутствие факторов риска
кардиоваскулярных болезней и даже снижение такого риска при лечении больных РА (OR
0,11; 95% CI 0,02–0,56) [22, 23]. По данным метаанализа и систематического
обзора исследований по использованию БПВП в разных когортах больных,
прослеженных 5–12 лет, МТ реже отменяется из-за НЛР, чем другие БПВП, исключая
гидроксихлорохин [24, 25].
МТ может использоваться в периоперационный период, что не оказывает влияния
на исход операции и частоту постоперационных, в том числе инфекционных,
осложнений [26–27]. МТ при планировании беременности у пациенток с РА и
партнеров пациентов РА должен быть отменен как минимум за 3 месяца [28, 29].
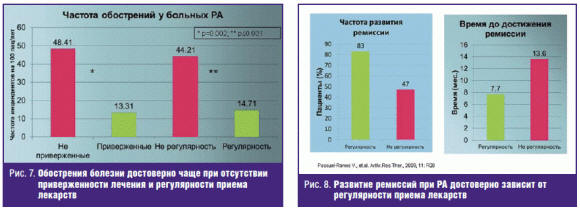
Еще раз хочется обратить внимание практикующих врачей на необходимость
обучения больных. В настоящее время этому придается большое значение. Было
показано, что приверженность больного лечению и регулярность приема препаратов
уменьшают число обострений РА и сокращают время до достижения ремиссии (рис. 7,
8) [30, 31]. В этой связи в странах Европы, в том числе и в России, проводятся
школы для улучшения коммуникации между медицинским персоналом и больными и для
объяснения больным принципов лечения РА — программа «Treatment to Target Connect».
Согласно опросу больных в более чем 50% случаев врач не обсуждал с ними
стратегию лечения. А опрошенные врачи объясняют нежелание такого обсуждения с
больным отсутствием времени (21% респондентов), неспособностью некоторых больных
понять это (48% респондентов), невозможностью больного принять решение (59%
респондентов). Конечно, врач не имеет возможности на амбулаторном приеме
подробно обсуждать с больным стратегические вопросы из-за нехватки времени.
Поэтому привлечение больных в такие школы может существенно облегчить работу.
Литература
-
Smolen J. S., Aletaha D., Bijlsma J. W. et al. Treating
rheumatoid arthritis to target: recommendations of an international task force
// Ann Rheum Dis. 2010: 69: 631–637. -
Grigor C., Capell H., Stirling A. et al. Effect of treatment
strategy of tight control of rheumatoid arthritis (the TIСORA study): a
single-blind randomised controlled trial // Lancet. 2004, 364: 263–269. -
Porter D. Targeting persistent disease activity in early RA: a
commentary on the TICORA trial // Int. J. Adv. Rheum. 2005, 3: 2–6. -
Albers J. M., Paimela L., Kurki P. et al. Treatment strategy,
disease activity, and outcome in four cohorts of patients with early
rheumatoid arthritis // Ann. Rheum. Dis. 2001, 60, 453–458. -
Bijlsma J. W., Weinblatt M. E. Optimal use of the methotrexate:
the advantages of tight control // Ann. Rheum. Dis. 2007, 66: 1409–1410. -
Verstappen S. M. M., Jacobs J. W., van der Veen M. J. et al.
Intensive treatment with methotrexate in early rheumatoid arthritis: aiming
for remission. Computer Assisted Management in Early Rheumatoid Arthritis (CAMERA,
an open-label strategy trial) // Ann. Rheum. Dis. 2007, 66: 1443–1449. -
Чичасова Н. В., Каневская М. З. Исходы — длит. // Научно-практ.
ревматол. 2010. -
Aletaha D., Neogi T., Silman A. et al. 2010 Rheumatoid arthritis
classification criteria: an American College of Rheumatology/European League
Against Rheumatism collaborative initiative // Ann Rheum Dis. 2010; 69:
1580–1588. -
Smolen J. S., Landewe R., Breedveld F. C. et al. EULAR
recommendations for the management of rheumatoid arthritis with synthetic and
biological disease-modifying antirheumatic drugs: 2013 update // Ann Rheum Dis.
2014, 73: 492–509. -
Насонов Е. Л., Мазуров В. И., Каратеев Д. Е. и соавт. Проект
рекомендаций по лечению ревматоидного артрита Общероссийской общественной
организации «Ассоциация ревматологов России» (часть 1) // Научно-практ.
ревматология. 2014, № 5, 477–494. -
Lard L. R., Visser H., Speyer I. et al. Early versus delayed
treatment un patients with recent-onset rheumatoid arthritis: comparison of
two cohorts who received different treatment strategies // Amer. J. Med. 2001,
V. 111: 446–451. -
Finckh A., Liang M., Mugica C. et al. Long-term impact of early
treatment on radiological progression in rheumatoid arthritis: a meta-analysis
// Arthr Care Res. 2006; 55: 864–872. -
Wiles N. J., Lunt M., Barrett E. M. et al. Reduced disability at
five years with early treatment of inflammatory polyarthritis. Results from a
large observational cohort, using propensity models to adjust for disease
severity // Arthr Rheum. 2001; 44: 1033–1042. -
Karateev D. E., Luchikhina E. L., Nasonov E. L. High frequency of
clinical remission in patients with early rheumatoid arthritis treated with
leflunomide // Ann Rheum Dis. 2005; Supl., Fr10179. -
Donanue K. E., Gartlenhar G., Jonas D. E. et al. Systematic
review: comparative effectiveness and harms of disease-modifying medications
for rheumatoid arthritis // Ann. Int. Med. 2008, 148: 124–134. -
Salliot C., van der Heijde D. Long-term safety of methotrexate
monotherapy in patients with rheumatoid arthritis: a systemic literature
research // Ann Rheum Dis. 2009; 68: 1100–1104. -
Pincus T., Yazici Y., Sokka T. et al. Methotrexate as the «anchor
drug» for the treatment of early rheumatoid arthritis // Clin. Exp. Rheum.
2003, 21 (Supl. 31): S178–185. -
Visser K., van der Heijde D. Optimal dosage and route of
administration of methotrexate in rheumatoid arthritis: a systematic review of
the literature // Ann. Rheum. Dis. 2009, 68: 1094–1099. -
Visser K., Katchamart W., Loza J. A. et al. Multinational
evidence-based recommendations for a use of methotrexate in rheumatic
disorders with a focus on rheumatoid arthritis: integrating systematic
literature research and expert opinion of a broad international panel of
rheumatologists in the 3 E Initiative // Ann Rheum Dis. 2009, 68: 1086–1093. -
Shea B., Swinden M. V., Tanjong Ghogomi E. et al. Folic acid and
folic acid for reducing side effects in patients receiving methotrexate for
rheumatoid arthritis // Cochrane Database Syst Rev. 2013, May 31; 5: CD000951.
doi: 1002/14651858.CD000951.pub2. -
Choi H. K., Herman M. A., Seeper J. D., Robins J. M., Wolfe F.
Methotrexate and mortality in patients with rheumatoid arthritis: a
prospective study // Lancet. 2002; 359: 1173–1177. -
Assous N., Touze E., Meune C., Kahan A., Allanore Y.
Cardiovascular disease in rheumatoid arthritis: single-center hospital-based
cohort study in France // Joint one Spine. 2007; 74: 66–72. -
Van Halm V. P., Nurmohamed M. T., Twisk J. W. et al.
Disease-modifying antirheumatic drugs are associated with a reduced risk for
cardiovascular disease in patients with rheumatoid arthritis: a case-control
study // Arthritis Res Ther. 2006; 8: R w151. -
Maatzel A., Wong A., Strand V. et al. Meta-analysis of treatment
termination rates among rheumatoid arthritis patients receiving
disease-modifying anti-rheumatic drugs // Rheumatology (Oxford). 2000; 39:
975–981. -
Salliot C., van der Heijde D. Long term safety of methotrexate
monotherapy in rheumatoid arthritis patients: a systematic literature research
// Ann Rheum Dis. 2009; 68: 1100–1104. -
Grennan D. M., Gray J., Loudon J., Fear S. Methotrexate and early
postoperative complications in patients with rheumatoid arthritis undergoing
elective orthopaedic surgery // Ann Rheum Dis. 2001; 60: 214–217. -
Murata K., Yasuda T., Ito H. et al. Lack of increase in
postoperative complications with low-dose methotrexate therapy in patients
with rheumatoid arthritis undergoing elective orthopedic surgery // Mod
Rheumatol. 2006; 16: 14–19. -
Ostensen M., Hartmann H., Salvesen K. Low dose weekly
methotrexate in early pregnancy. A case series and review of the literature //
J Rheumatol. 2000; 27: 1872–1875. -
Charakravarty E. F., Sanchez-Yamamoto D., Bush T. M. The use of
disease modifying antirheumatic drugs in women with rheumatoid arthritis of
childbearing age: a survey of practice patterns and pregnancy outcomes // J
Rheumatol. 2003; 30: 241–246. -
Contreras-Yanez I., Ponce De Leon S., Cabiedes J. Inadequate
therapy behavior is associated to disease flares in patients with rheumatoid
arthritis who have achieved remission with disease-modifying antirheumatic
drugs // Am J Med Sci. 2010; 340: 282–290. -
Pascual-Ramos V., Contreras-Yanez I., Villa A. R. et al.
Medication persistence over 2 years of follow-up in cohort of early rheumatoid
arthritis patients: association ship with disease activity and with disability
// Arthr Res Ther. 2009; 11: R26.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







