Влияние ожирения на клиническое течение инфаркта миокарда
Содержание статьи
Введение
Ожирение является одним из распространенных факторов сердечно-сосудистого риска: развития артериальной гипертензии (АГ), сахарного диабета (СД), атеросклероза и ишемической болезни сердца (ИБС) [1–3]. Лидирующее место по распространенности ожирения занимают США (47,6%), избыточной массой тела и ожирением страдают 12,8% населения европейских стран [4, 5]. По данным статистики ВОЗ 2014 г., процент людей с ожирением в развитых и развивающихся странах увеличился более чем в 2 раза по сравнению с 1980 г. [6]. При сохранении отрицательной динамики к 2030 г. избыточный вес или ожирение будет иметь почти половина взрослого населения мира [7].
В Российской Федерации распространенность ожирения составляет около 26% [8]. Анализ результатов крупного эпидемиологического исследования ЭССЕ-РФ показал, что более чем у двух третей исследуемых всех возрастных групп выявлено ожирение, что также укладывается в мировую тенденцию распространенности эпидемии ожирения [9].
Ожирение является значимой причиной развития дислипидемии и атеросклероза, поскольку висцеральная жировая ткань — эндокринный орган, продуцирующий ряд биологически активных веществ (факторов роста и воспаления), влияющих на структуру и функцию сердца [10, 11]. Под воздействием гиперпродукции данных веществ происходит развитие гипертрофии левого желудочка (ЛЖ), дилатация левого предсердия (ЛП), нарушение диастолической и систолической функций ЛЖ [12].
Роль ожирения как прогностического фактора смертности у пациентов с сердечно-сосудистыми заболеваниями, в частности ИБС, остается противоречивой. Доказано, что ожирение ассоциируется с повышенным риском преждевременной смерти в общей популяции [13]. Однако результаты регистров острого инфаркта миокарда PREMIER, TRIUMPH и MITRA PLUS показали наличие «парадокса ожирения», т. е. у пациентов с высоким индексом массы тела (ИМТ) наблюдались низкие показатели смертности [14, 15].
Особую актуальность изучение влияния ожирения на течение острого коронарного синдрома и показатели геометрии ЛЖ приобретает у пациентов с инфарктом миокарда (ИМ) и фракцией выброса левого желудочка (ФВЛЖ) >40% в отношении выявления диастолической дисфункции, которая может ассоциироваться с неблагоприятным отдаленным прогнозом заболевания, особенно в отношении развития клиники хронической сердечной недостаточности.
Цель работы: оценка влияния ожирения на эхокардиографические показатели ремоделирования и выявление особенностей клинического течения ИМ с ФВЛЖ >40%.
Материал и методы
В рамках регистрового исследования, организованного на базах ГБУЗ КО «Кемеровский областной клинический кардиологический диспансер им. академика Л.С. Барбараша» и ФГБНУ «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний», за период с 2014 по 2015 г. было обследовано 120 пациентов с ИМ с подъемом сегмента ST (ИМпST). Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practive) и принципами Хельсинкской декларации. Протокол данного исследования одобрен локальным этическим комитетом. Все пациенты подписали информированное согласие на участие в исследовании.
Критериями включения в данное исследование были: подписанное пациентом добровольное информированное согласие; возраст >18 и
У всех пациентов проводили сбор демографических, анамнестических и клинических данных, а также применяли стандартные при ИМ методы исследования, включая общий и биохимический анализ крови, липидограмму, оценку кардиоспецифических маркеров некроза миокарда, электрокардиографическое исследование.
Оценка ожирения проводилась путем определения индекса массы тела, который рассчитывался по формуле: ИМТ = масса тела (кг) / рост2 (м2). Критерием ожирения, согласно классификации ВОЗ, считается ИМТ 30 кг/м2
и более [16].
ЭхоКГ выполняли всем пациентам на 1-е и 10–12-е сут госпитализации в М- и В-режимах на аппарате «Sonos 2500» (Hewlett Packard, США), определяли следующие показатели: размеры ЛП и правого предсердия, межжелудочковой перегородки, задней стенки ЛЖ, конечный диастолический размер (КДР) и конечный диастолический объем (КДО) ЛЖ, конечный систолический размер и конечный систолический объем (КСО) ЛЖ, оценивали общую сократимость миокарда (ФВЛЖ, массу миокарда ЛЖ, ударный объем (УО), скорость распространения раннедиастолического потока в полости ЛЖ (СРМП). ФВЛЖ оценивали по методикам Симпсона и Тейхольца [17]. Диастолическую функцию ЛЖ оценивали по трансмитральному кровотоку с помощью показателей: пиковой скорости раннего диастолического (Е, см/с) и предсердного (А, см/с) наполнения, соотношения Е/А, времени изоволюметрического расслабления (IVRT, мс),
времени замедления кровотока раннего диастолического наполнения ЛЖ (DТ, мс), а также на основании данных тканевой допплерографии: скорости раннего расслабления миокарда ЛЖ по мере подъема митрального кольца во время раннего наполнения ЛЖ (е’, см/с), коэффициента Е/е’ — отношения Е-волны кровотока на митральном клапане к е’-волне [18].
Согласно Европейским рекомендациям по диагностике и лечению острой и хронической сердечной недостаточности (2016) были выделены три типа диастолической дисфункции:
I тип (замедление расслабления), для которого характерны показатели: E/A 220 мс; IVRT ≥110 мс;
e’
II тип (псевдонормализация): E/A 1,0–2,0; DT 140–220 мс; IVRT 60–100 мс; e’
III тип (рестрикция): E/A ≥2,0; DT
На госпитальном этапе лечения у пациентов с ИМ фиксировали следующие конечные точки: рецидивирующий инфаркт миокарда, раннюю постинфарктную стенокардию, острую левожелудочковую недостаточность, жизнеугрожающие нарушения ритма, клиническую смерть; летальных случаев в общей группе больных в госпитальный период не зарегистрировано.
Средний возраст в общей группе пациентов с ИМпST составил 58 (52; 63,5) лет. Из 120 больных 75,8% (n=91) были мужчины. Продолжительность пребывания в стационаре составила 11 (9; 13) дней в обеих группах. Клинико-
анамнестическая характеристика пациентов и данные объективного осмотра представлены в таблицах 1 и 2.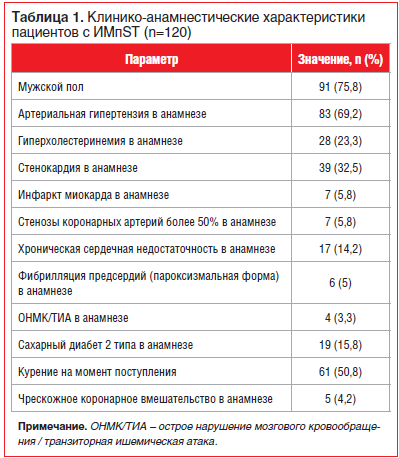
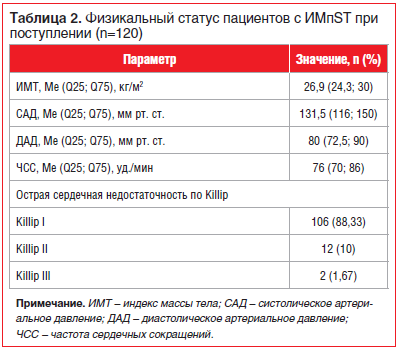
Примечательно, что в исследование были включены достаточно тяжелые пациенты с серьезным риском ранних и отдаленных неблагоприятных исходов.
При проведении динамического эхокардиографического исследования у пациентов с ИМпST и ФВ >40% выявлено, что на 10–12-е сут после ИМ были зарегистрированы значимые различия следующих ультразвуковых параметров: ФВ, КСО и УО, DT, а также СРМП (табл. 3).
Статистическую обработку данных осуществляли с помощью программы Statistica версии 8.0 (StatSoft, Inc, США). Нормальность распределения проверяли с помощью критерия Колмогорова — Смирнова. Использовали стандартные методы описательной статистики. Полученные данные представлены в виде медианы и интерквартильного размаха (25-й процентиль; 75-й процентиль). Различия между двумя независимыми группами оценивали при помощи непараметрического критерия Манна — Уитни. При сравнении групп по качественному показателю использовалось построение таблиц сопряженности с последующим расчетом χ2 Пирсона (при количестве менее 10 пациентов применялась поправка Йетса), точного критерия Фишера с двусторонней доверительной вероятностью (если одно из значений было меньше 5). С помощью критерия Вилкоксона оценивали значимость динамики количественных признаков в выборке. Статистически значимыми считали различия при p
Результаты
Все пациенты с ИМпST по результатам оценки ИМТ при поступлении были разделены на 2 группы: 1-я группа — 90 (75%) больных без ожирения, 2-я группа — 30 (25%) больных с ожирением (ИМТ ≥30 кг/м2) [16]. Пациентов 2-й группы в зависимости от ИМТ сначала разделили на подгруппы по степени ожирения: c I cтепенью (ИМТ 30–34,9 кг/м2) — 21 (70%) пациент, со II (ИМТ 35–39,9 кг/м2) — 8 (26,7%), с III (ИМТ 40 кг/м2 и более) — 1 (3,3%) пациент. Учитывая, что по степени ожирения статистически значимых различий в эхокардиографических показателях не было выявлено, все подгруппы в дальнейшем представлены как одна группа.
При анализе клинико-анамнестических данных отмечено, что группы сопоставимы между собой по полу, возрасту, однако у пациентов с ожирением статистически значимо чаще, чем в группе с ИМТ
В обеих группах преобладал ИМ задней локализации — в 48,9 и 53,3% случаев. На догоспитальном этапе 10 (8,3%) больным проведена тромболитическая терапия. По результатам коронароангиографии у большинства пациентов обеих групп превалировало гемодинамически значимое (стеноз 70% и больше) поражение одной коронарной артерии: у 53,3% пациентов без ожирения и у 56,7% — с ожирением.
Оценивая параметры гемодинамики, а именно АД и ЧСС, между группами, мы выявили, что САД было значимо выше при поступлении у пациентов с ожирением [130 (110; 145) против 140 (120; 160) мм рт. ст., p=0,03]. Лабораторные данные показали, что для пациентов с ожирением характерна гипергликемия, как стрессовая [6,8 (4,9; 9,9) против 7,7 (5,6; 11,4) ммоль/л, p=0,01], так и истинная тощаковая [5,6 (4,8;7,3) против 6,2 (5,3; 8,9) ммоль/л, p=0,00], а также более тяжелые проявления дислипидемии: ХС ЛПВП [1,0 (0,7; 1,4) против 0,93 (0,6; 1,3) ммоль/л, p=0,03], триглицериды [1,4 (0,9; 2,5) против 1,9 (1,2; 4,3) г/л, p=0,01], индекс атерогенности [3,8 (2,5; 7,0) против 4,9 (2,8; 10), p=0,002].
Анализ эхокардиографических показателей при поступлении в стационар показал тенденцию (р=0,08) к более высокому значению ФВЛЖ по Тейхольцу и значительно (р=0,01) высокий уровень УО у пациентов с ожирением. Таким образом, для больных с ожирением был характерен гиперкинетический тип внутрисердечной гемодинамики при поступлении. Эти пациенты также имели более выраженную дилатацию ЛЖ, по данным оценки КДР, и более высокую скорость распространения раннедиастолического потока в полости ЛЖ, чем пациенты без ожирения (табл. 4).
В динамике на 10–12-е сут госпитализации при сравнении групп по показателям ЭхоКГ в группе с ожирением сохранялись более выраженные проявления дилатации ЛЖ, чем в группе без ожирения: КДР [5,4 (5,2; 5,6) против 5,5 (5,1; 6,1) см, p=0,01], КДО [141 (124; 154) против 147 (118; 187) мл, p=0,04] и ЛП [4,0 (3,9; 4,2) против 4,1 (3,7; 4,8) см, p=0,03], а также более высокое значение ударного объема [80 (73; 87) против 85 (79,5; 95) мл, p=0,00].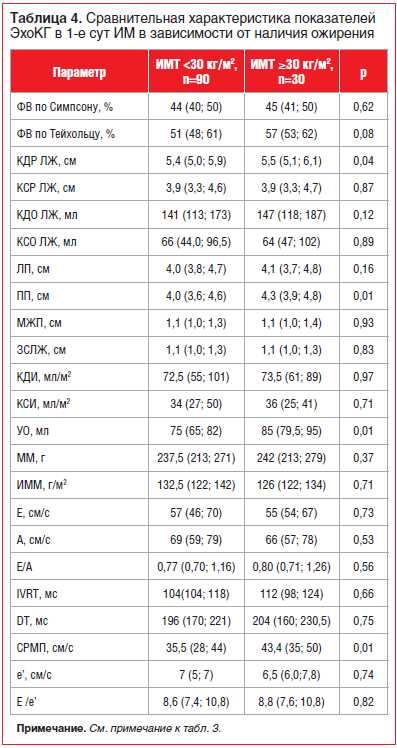
Согласно критериям Европейских рекомендаций по диагностике и лечению острой и хронической сердечной недостаточности (2016) [19] диастолическая дисфункция ЛЖ выявлена на 1-е сут у 46,7% (n=14) пациентов с ожирением и у 48,9% (n=44) пациентов без ожирения. Среди пациентов с ожирением у большинства (n=11) наблюдалось замедление релаксации, у 2 больных — псевдонормальный тип диастолической дисфункции (ДД) и у 1 пациента — рестриктивный тип. У 32 пациентов без ожирения выявлен I тип ДД ЛЖ, II тип — у 10 пациентов и III тип — у 2 пациентов.
К концу госпитализации у 6,7% (n=6) пациентов без ожирения наблюдалось снижение ФВ
На 10–12-е сут госпитализации у 50% (n=15) пациентов с ожирением и у 48,9% (n=44) пациентов без ожирения выявлена ДД по типу замедления расслабления миокарда ЛЖ. Особенность заключалась в том, что в группе с ожирением встречался только I тип ДД ЛЖ, а в группе без ожирения I тип ДД выявлен у 32 пациентов, II тип — у 11 и III, рестриктивный тип — у 1 пациента.
Таким образом, к концу госпитализации у всех пациентов с ожирением и ДД регистрировался тип ДД, только связанный с замедлением релаксации, т. е. более благоприятный, чем у пациентов без ожирения. В группе без ожирения увеличилось количество пациентов с псевдонормальным типом ДД, что говорит о более тяжелом функциональном состоянии.
При анализе особенностей клинического течения ИМ по частоте конечных точек выявлено, что суммарно они регистрировались у 20 пациентов (табл. 5).
Изложенное позволяет утверждать, что исходно пациенты с ожирением и ИМ — это клинически более тяжелая в отношении коморбидности группа пациентов. Однако при развитии ИМ с ФВЛЖ >40% изменения показателей, характеризующих процессы ремоделирования миокарда, на госпитальном этапе у пациентов с ожирением протекают более благоприятно, что отражается и на структуре конечных точек в этот период лечения. Можно предполагать, что негативного влияния на тяжесть ремоделирования миокарда и ранний прогноз при ИМ с ФВЛЖ >40% ожирение не оказывает.
Обсуждение
Оценка феномена ожирения у пациентов с ИМ изучена недостаточно, особенно в группе пациентов с ФВЛЖ >40%. В настоящем исследовании клинической оценке подверглись пациенты с так называемой постинфарктной сердечной недостаточностью со средней ФВЛЖ (СНсрФВ), когда значение таковой не ниже 40%. Диагноз «сердечная недостаточность со средней фракцией выброса» — более сложный клинический и прогностический феномен. Ранние исходы у этих пациентов более благоприятные, чем у больных с ИМ со сниженной ФВЛЖ, однако отдаленная выживаемость в этих группах больных не различается [19].
В этой связи все больше внимания уделяется оценке дополнительных факторов коморбидности, которые могут оказывать влияние на формирование прогноза и специфического морфологического профиля миокардиального ремоделирования у пациентов с СНсрФВ, характеризующегося высокой патологической ДД ЛЖ [20]. К таковым традиционно относят ожирение, которое является глобальной пандемией и не может не оказывать того или иного влияния на течение острого ИМ. Именно относительно характера такого влияния нет единства мнений.
Известно, что ожирение может ухудшать течение ИМ у пациентов с систолической сердечной недостаточностью [21], а также приводить к изменению диастолической функции миокарда [20–23].
Однако ассоциация ожирения с большей выраженностью клинической картины ИМ и негативным влиянием на прогноз у пациентов с ИМ и ФВЛЖ не ниже 40% оценивается исследователями весьма противоречиво [24–26].
В ставшем классическим исследовании N.M. Norris
et al. [24] показано, что минимальный уровень госпитальной летальности и отдаленной сердечно-сосудистой смертности регистрировался в группе пациентов с ожирением. Однако данное эпидемиологическое исследование было проведено в «дореперфузионную» эру, когда большая часть больных с ИМ имела значительно сниженную насосную функцию ЛЖ и не получала терапию, направленную на улучшение прогноза. Фактически большинство этих пациентов были больными с тяжелой систолической сердечной недостаточностью. В данном случае речь может идти о так называемом «парадоксе ожирения», когда оно оказывает протективный эффект на выживаемость больных, что было показано у пациентов с бивентрикулярной сердечной недостаточностью [27].
В более поздних исследованиях пациентов с ИМ с активной реперфузионной терапией влияние ожирения на течение ИМ оценивали менее позитивно. В исследовании S. Hosoda et al. [25] у пациентов с ожирением была выявлена высокая частота сердечно-сосудистой смертности в течение 5 лет после ИМ.
В исследовании T.D. Rea et al. [26] выявлено, что с возрастанием степени тяжести ожирения у пациентов, перенесших ИМ, увеличивается риск развития повторных ИМ.
В работе О.В. Груздевой и соавт. [28] показано, что наличие висцерального ожирения у пациентов с ИМ, оцененного с помощью компьютерной томографии, ассоциируется с высокой активностью провоспалительных интерлейкинов и снижением активности противовоспалительного интерлейкина-10. В свою очередь, у этих пациентов чаще развивались конечные точки в постинфарктном периоде наблюдения. Похожие результаты получены в исследовании Н.В. Орловой и соавт. [10].
С другой стороны, в исследовании L. Gruberg et al. [29] был выявлен протективный эффект ожирения в отношении выживаемости на госпитальном этапе лечения и при последующем наблюдении в течение года у пациентов с различными формами ИБС после чрескожных коронарных вмешательств. Наивысший риск неблагоприятных исходов был в группе пациентов с ИМТ 2. При этом пациенты с ожирением оказались более молодыми, чем пациенты без ожирения.
В ряде других работ отмечено снижение смертности вдвое у пациентов с острым коронарным синдромом (ОКС) и ожирением по сравнению с больными без ожирения после ранней реваскуляризации [30–32].
Однако анализ регистра ОКС Swedish Coronary Angiography and Angioplasty Registry показал, что у пациентов с ИМТ >35 кг/м2 была отмечена более высокая смертность, чем у больных без ожирения [33].
В настоящем исследовании у пациентов с ИМ и ожирением выявлено меньшее число конечных точек на госпитальном этапе лечения, однако эти пациенты исходно имели бóльшую коморбидность, чем больные без ожирения.
Полученные в настоящем исследовании результаты, которые свидетельствуют о большей исходной коморбидности у пациентов с ожирением, совпадают с данными литературы. Так, согласно данным исследования INTERSALT на каждые 4,5 кг прибавки веса систолическое артериальное давление увеличивается на 4,5 мм рт. ст. [34]. Ряд авторов указывают, что высокое АД у пациентов с ожирением ассоциируется с увеличением ударного объема и сердечного выброса при нормальном периферическом сопротивлении сосудов [35, 36]. В ряде работ показана тесная ассоциация ожирения с различными нарушениями углеводного обмена, включая СД 2 типа [37–39].
В недавно опубликованном исследовании 1118 пациентов с ИБС показано, что ожирение тесно взаимосвязано с большим количеством факторов сердечно-сосудистого риска, включая АГ, тяжелую дислипидемию и инсулинорезистентность [40]. В работе H.J. Buettner et al., выполненной на 1676 пациентах с ИМ, отмечена высокая распространенность АГ, СД и дислипидемии у пациентов с избыточной массой тела и ожирением [30].
Механизм, благодаря которому ожирение влияет на прогноз ИМ, неизвестен. В литературе имеются данные о том, что у пациентов с ожирением менее выражено снижение систолической функции ЛЖ после ИМ. C.F. Lundergan et al. [41] показали, что высокий ИМТ связан с сохранением систолической функции и лучшим 30-дневным прогнозом смертности у пациентов с ИМ.
Анализ эхокардиографических показателей у пациентов с ИМ выявил повышенные значения ФВЛЖ и УО в группе больных с ожирением, что аналогично результатам исследования Messerli et al., и подтверждает данные о том, что при ожирении увеличиваются общий объем крови и соответственно сердечный выброс [42]. Аналогичные результаты были получены и в других работах [44–46].
При этом по мере повышения объемов и давления при заполнении кровью отделов сердца у пациентов с ожирением достаточно часто увеличиваются размеры левых отделов сердца [47], что отмечено и в настоящем исследовании.
В исследовании G. Iacobellis et al., включавшем 75 пациентов с ожирением, но без АГ, нарушений углеводного обмена и дислипидемии, не отмечено каких-либо изменений в геометрии сердца, при этом выявлена высокая частота ДД миокарда ЛЖ [20].
В настоящем исследовании у больных с ИМ и ожирением при поступлении выявлена несколько бóльшая частота ДД ЛЖ, однако на 12-е сут число больных с ДД в группе с ожирением не становится больше, а профиль типов ДД у больных с ожирением перед выпиской более благоприятный. Для комплексной оценки феномена ожирения у пациентов с ИМ и ФВЛЖ >40% и его клинико-прогностической значимости требуется оценка не только госпитального этапа лечения, но и отдаленного периода наблюдения, что неоднократно подчеркивалось по поводу проведения госпитальных регистров ОКС [46–50].
Заключение
У пациентов с ожирением и ИМ с ФВЛЖ >40% не выявлено значимых отличий от пациентов без ожирения по частоте ДД ЛЖ и раннему клиническому прогнозу.
Информация с rmj.ru



