Содержание статьи
Влияние антигипертензивных препаратов на состояние когнитивных функций у больных артериальной гипертензией I–II степени
Т. Е. Морозова, доктор медицинских наук, профессор
С. В. Гонтаренко
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
В последние годы все больше внимания стало уделяться ранним проявлениям поражения головного мозга как органа-мишени при артериальной гипертензии (АГ), так как уже доказано, что поражение головного мозга может проявляться не только инсультами, но и нарушениями когнитивных функций — памяти, мышления, внимания, что существенно повышает риск развития деменции, частота которой достигает 10–15% в год, а за 5-летний период наблюдения у 70% пациентов умеренные когнитивные нарушения (КН) трансформируются в деменцию [1–3].
В связи с этим особую актуальность приобретают вопросы рационального выбора антигипертензивной терапии с учетом потенциального влияния препаратов на состояние когнитивных функций. Имеющиеся на сегодняшний день данные о влиянии различных классов антигипертензивных препаратов на состояние когнитивных функций неоднозначны и противоречивы. В частности, это относится к препаратам, влияющим на ренин-ангиотензин-альдостероновую систему (РААС). Экспериментальные и клинические исследования однозначно свидетельствуют о важной роли повышенной активности РААС головного мозга в возникновении и прогрессировании нарушений когнитивных функций [4–6]. В качестве возможной терапевтической стратегии рассматриваются возможные эффекты блокады РАСС головного мозга с целью предотвращения прогрессирования когнитивных нарушений (КН) [7]. Очевидно, что наибольшим потенциалом с этой точки зрения должны обладать ингибиторы АПФ, способные снижать уровень ангиотензина II в плазме крови и тканях головного мозга, так как этот гормон является одним из ключевых медиаторов в развитии и прогрессировании КН [8–11].
В то же время остается нерешенным вопрос, все ли ингибиторы ангиотензинпревращающего фермента (АПФ) могут оказывать положительное воздействие на когнитивные функции у больных АГ с КН [12–14]. Так, результаты ряда эпидемиологических исследований свидетельствуют об отсутствии преимуществ ингибиторов АПФ в отношении влияния на когнитивные функции у больных АГ [15], тогда как в исследовании PROGRESS было доказано, что антигипертензивная терапия ингибитором АПФ периндоприлом снижает риск нарушений когнитивных функций у пациентов с цереброваскулярными заболеваниями в анамнезе [16]. Подобные различия, по-видимому, могут определяться существующими фармакодинамическими и фармакокинетическими особенностями, присущими различным представителям данного класса препаратов. Наибольшим потенциалом в отношении влияния на когнитивные функции должны обладать те ингибиторы АПФ, которые имеют большую липофильность, большее сродство к тканевым компонентам РААС и лучше проникают через гематоэнцефалический барьер [17, 18]. Все это позволяет предполагать, что имеются важные различия в отношении влияния ингибиторов АПФ на когнитивные функции, однако комплексных исследований по оценке влияния терапии ингибиторами АПФ с различными фармакологическими свойствами на когнитивные функции у больных АГ без цереброваскулярных заболеваний в анамнезе не проводилось.
В связи с этим целью нашего исследования явилось изучение влияния двух ингибиторов АПФ, широко использующихся в клинической практике, периндоприла и эналаприла, обладающих разными фармакологическими свойствами, на состояние когнитивных функций у больных АГ без цереброваскулярных заболеваний в анамнезе.
Материалы и методы исследования
В проспективное исследование по оценке влияния антигипертензивных препаратов на состояние когнитивных функций были включены 82 больных АГ I-II степени (50 женщин и 32 мужчины) в возрасте от 40 до 75 лет (средний возраст 58,04 ± 8,59 года) без цереброваскулярных заболеваний в анамнезе, имеющих нарушения когнитивных функций по данным нейропсихологического тестирования и подписавшие информированное согласие на участие в исследование.
Не включались в исследование пациенты с наличием критериев деменции по данным шкалы MMSE (Mini Mental State Examination), симптоматической АГ, наличием противопоказаний или отмеченной ранее непереносимости ингибиторов АПФ, инсультами или транзиторными ишемическими атаками в анамнезе любых сроков давности, а также другими клинически значимыми неврологическими заболеваниями, ишемической болезнью сердца, хронической сердечной недостаточностью II–IV ФК по NYHA (Нью-Йоркская классификация), сахарным диабетом 1-го типа, декомпенсацией сахарного диабета 2-го типа (при уровне HbA1c (гликированный гемоглобин) > 7,5%).
Все пациенты перед началом лечения либо не принимали антигипертензивной терапии вообще или не получали регулярной антигипертензивной терапии. Больные методом конвертов были рандомизированы в две группы: периндоприла (n = 41) и эналаприла (n = 41). Начальная суточная доза периндоприла составила 5 мг, эналаприла — 10 мг, в дальнейшем при недостаточном антигипертензивном эффекте доза увеличивалась соответственно до 10 и 20 мг.
Программа клинического обследования включала в себя: анализ жалоб, сбор анамнеза, физикальный осмотр, проведение суточного мониторирования АД (СМАД), а также оценку показателей когнитивных функций с помощью различных методик нейропсихологического тестирования. С этой целью использовали шкалу оценки психического статуса Mini-mental State Examination (MMSE), визуально-аналоговую шкалу субъективной оценки памяти и внимания (ВАШ), проводили исследование оперативной памяти и внимания по субтесту Векслера 5, определение концентрации внимания по субтесту Векслера 7. Для исключения признаков депрессии всем больным проводили анкетирование по госпитальной шкале депрессии и тревоги (Hospital Anxiety and Depression Scale, HADS). Качество жизни оценивали с помощью Гетеборгского опросника и по данным опросника SF-36. Также определяли уровни биохимических маркеров, отражающих активность РААС (ангиотензин II) и эндотелиальную дисфункцию (эндотелин-1) в сыворотке крови методом иммуноферментного анализа.
На каждом визите оценивались эффективность, переносимость лечения и регистрировались побочные эффекты. В случае необходимости больным индивидуально назначались дополнительные визиты. Лекарственные препараты назначались открытым способом без применения плацебо в добавление к терапии, которую пациенты получали в неизмененном виде не менее 12 недель.
Статистическая обработка полученных данных выполнена по программе Statistica 6.0. Результаты представлены в виде М ± а (М — средняя величина, а — среднее квадратичное отклонение). Разница показателей в двух группах оценивалась при помощи критерия Манна–Уитни. Динамика параметров во времени оценивалась при помощи критерия Вилкоксона. Для выявления наличия связи между величинами применялся корреляционный анализ по Спирмену. Достоверными считались различия и корреляции при р < 0,05.
Результаты и обсуждение
Оценка когнитивных функций у больных АГ
Результаты нейропсихологического тестирования в комплексе с оценкой гемодинамических показателей, которое было проведено 134 больным АГ I–II степени без цереброваскулярных заболеваний в анамнезе, показали, что признаки нарушений когнитивных функций имеют место у 82 пациентов (61,19%). Следует отметить, что анкетирование по шкале MMSE не выявило достоверных признаков выраженного когнитивного снижения, однако более чувствительные тесты позволили выявить легкие и умеренные нарушения когнитивных функций. Об этом свидетельствует снижение таких показателей, как показатель внимания по субтесту Д. Векслера, который составил 36,20 ± 11,56 балла (в группе пациентов АГ без КН — 69,53 ± 2,42 балла, р < 0,001), показатель непосредственной слухоречевой памяти по субтесту Д. Векслера 5 — 9,46 ± 1,91 балла (в группе пациентов АГ без КН — 13,96 ± 1,04 балла, р < 0,001). Показатели субъективной оценки памяти и внимания составили: по шкале ВАШ «Память» 72,49 ± 20,19 мм (в группе пациентов АГ без КН — 94,16 ± 3,18 мм, р = 0,004), по шкале ВАШ «Внимание» 68,09 ± 18,42 мм (в группе пациентов АГ без КН — 89,0 ± 7,12 мм, р = 0,004).
У этих больных по данным СМАД имело место повышение исходных значений САД и ДАД во все периоды: САДсут и ДАДсут составили 141,05 ± 7,74 и 88,52 ± 6,58 мм рт. ст., САДдн. и ДАДдн. — 144,35 ± 8,23 мм рт. ст и 92,30 ± 6,43 мм рт. ст., САДночн. и ДАДночн. — 132,24 ± 10,08 мм рт. ст. и 80,94 ± 9,05 мм рт. ст. соответственно. Кроме того, выявлены высокие показатели гипертонической нагрузки: индекс времени по САД и ДАД во все временные промежутки более чем в 2–3 раза превышает нормальные показатели у 86% больных.
Также у большого количества больных выявлены нарушения суточного профиля артериального давления (АД). Так, у 46 больных (56,1%) отсутствовало достаточное снижение САД и у 33 (40,2%) ДАД в ночное время, и у них профиль АД был представлен типом суточной кривой «non-dipper». Повышение САД в ночные часы (тип суточной кривой «night-peaker») отмечено у 8 больных (9,8%) и ДАД у 3 больных (3,7%). У части пациентов (7 больных; 8,5%), напротив, отмечалось чрезмерное снижение ДАД в ночное время (тип суточной кривой «over-dipper»). Нормальный суточный профиль с достаточным ночным снижением САД (тип суточной кривой «dipper») выявлен лишь у 28 больных (34,1%) и ДАД у 39 больных (47,6%). Характер изменений суточного профиля АД до лечения в группах периндоприла и эналаприла достоверно не различался (рис. 1).
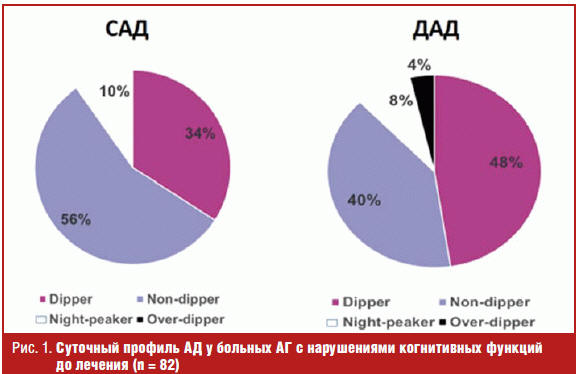
При анализе активности РААС у больных АГ с нарушениями когнитивных функций выявлены более высокий уровень ангиотензина II — 60,04 (53,78; 66,48) нг/мл по сравнению с контрольной группой (больные АГ без КН — 48,39 (25,89; 54,18) нг/мл, р = 0,003) и нормальными значениями 10–30 нг/мл. Уровень ангиотензина II достоверно не различался у мужчин и женщин — 64,40 (61,48; 68,57) и 57,93 (52,51; 69,46) нг/мл соответственно, р = 0,12. Отмечено достоверное повышение активности ангиотензина II при АГ II степени по сравнению с АГ I степени — 64,40 (54,78; 75,54) и 55,43 (45,68; 65,19) нг/мл соответственно, р = 0,011. Выявлена тенденция к повышению активности ангиотензина II у курящих больных по сравнению с некурящими лицами — 64,54 (54,11;69,99) и 57,91 (54,28; 63,24) нг/мл соответственно, р = 0,08. Также у всех обследованных больных АГ с КН был выявлен повышенный уровень эндотелина-1 в сыворотке крови по сравнению с группой контроля (больные АГ без КН) (0,94 (0,56; 2,32) фмоль/мл и 0,52 (0,28; 0,89), р = 0,043) и нормальными значениями 0,26 фмоль/мл (р = 0,001).
Влияние антигипертензивных препаратов на состояние когнитивных функций
Целевой уровень АД (< 140/90 мм рт. ст.) через 12 недель лечения был достигнут у 87% больных, принимавших периндоприл, и у 79% больных, принимавших эналаприл. Показатели офисного АД достоверно снизились в обеих группах (рис. 2).
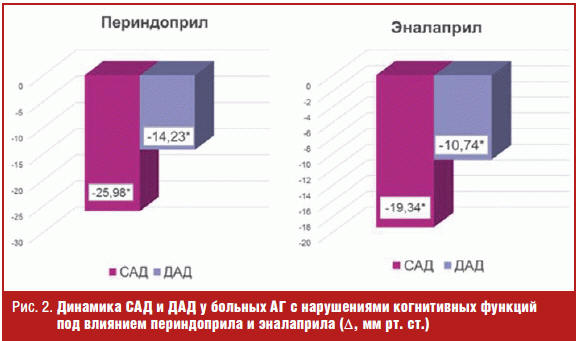
Высокая антигипертензивная эффективность изученных препаратов в разных дозах у больных АГ с нарушениями когнитивных функций была подтверждена результатами данных СМАД. Отмечено достоверное снижение среднесуточных, среднедневных и средненочных показателей САД и ДАД (р < 0,05) как на фоне приема периндоприла, так и эналаприла (рис. 3), что согласуется с результатами других исследований [19, 20]. При этом отмечено положительное влияние периндоприла и эналаприла на суточный профиль АД, выражавшееся в увеличении количества больных с нормальным суточным профилем «dipper» и уменьшении числа больных с нарушенными типами суточного профиля («non-dipper», «night-peaker», «over-dipper») (рис. 4).
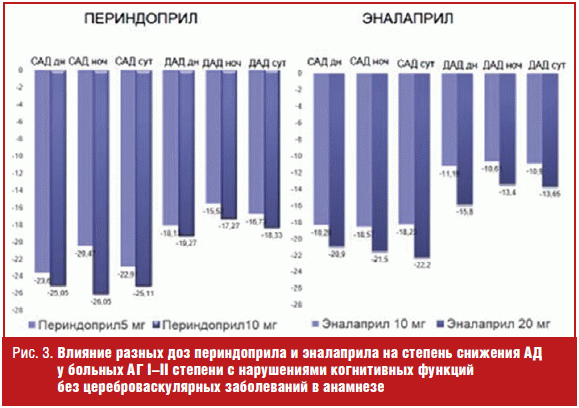
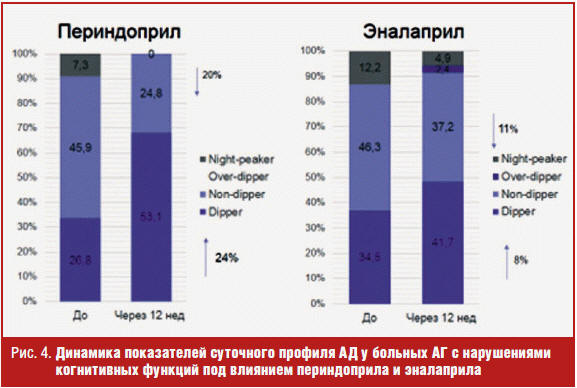
Анализ влияния периндоприла и эналаприла, ингибиторов АПФ с различными фармакологическими свойствами, на показатели когнитивных функций показал, что наряду с антигипертензивным эффектом препараты влияют и на когнитивные функции, но выраженность этого влияния различна. Степень изменения когнитивных функций была достоверно больше на фоне ингибитора АПФ периндоприла, обладающего высокой липофильностью и высоким сродством к тканевому АПФ. Липофильность препарата и связанная с ним высокая аффинность к тканевому АПФ позволяют ему лучше проникать в ткани головного мозга и оказывать благоприятное влияние на когнитивные функции, обеспечивать защиту органов-мишеней.
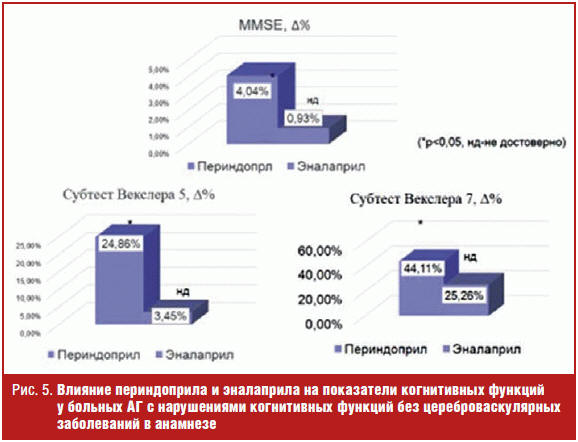
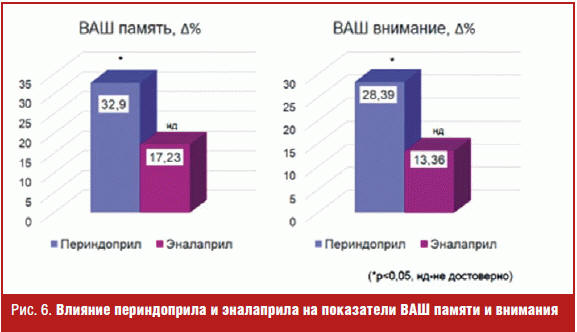
Так, на фоне терапии периндоприлом отмечено уменьшение количества жалоб на ухудшение памяти и внимания с 2,27 ± 0,90 до 1,46 ± 0,64 (р < 0,05), достоверное увеличение показателя MMSE с 28,56 до 29,45 балла, Δ% = 4,04 (р < 0,05), субтеста Векслера 5 с 9,48 ± 1,9 до 11,19 ± 2,02, Δ% = 24,86 и субтеста Векслера 7 с 36,9 ± 13,12 до 48,31 ± 10,41, Δ% = 44,11 (р < 0,05 во всех случаях). Также на фоне приема эналаприла количество жалоб на ухудшение памяти и внимания и показатель MMSE практически не изменились и отмечена некоторая тенденция к увеличению баллов по субтестам Векслера 5 и 7 (на 3,45% и 25,26% соответственно, р > 0,05) (рис. 5). Кроме того, отмечено достоверное улучшение показателей по ВАШ «Памяти» и «Внимания» на фоне приема периндоприла (рис. 6).
Степень изменения биохимических маркеров (ангиотензина II и эндотелина-1) также была более выраженной на фоне периндоприла: уровень ангиотензина II снизился на фоне периндоприла и эналаприла на 31,56% (р < 0,001) и 18,9% (р < 0,05) нг/м соответственно (рис. 7), эндотелина-1 — на 59,56% (р = 0,001) и 31,24% (р = 0,06) соответственно (рис. 8).
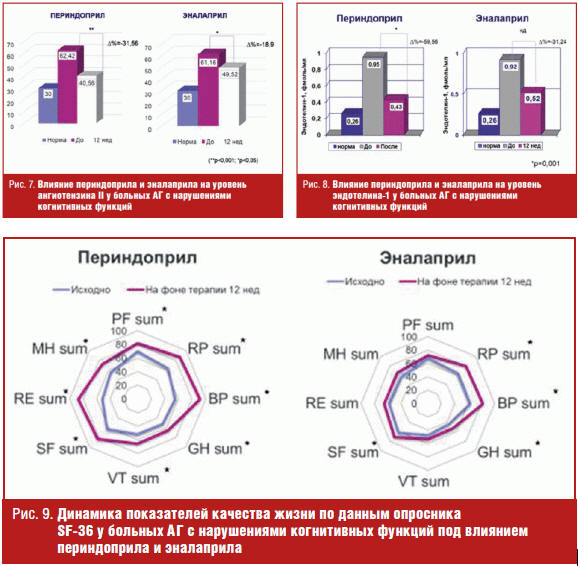
Положительная динамика гемодинамических показателей, биохимических маркеров активности РАСС и улучшение показателей когнитивных функций сопровождались улучшением показателей качества жизни. Средний балл по анкете «Качество жизни у больных гипертонической болезнью» по Гетеборгскому опроснику снизился на 23% в группе периндоприла (р = 0,004) и на 15% в группе эналаприла (р = 0,015), что свидетельствует об уменьшении выраженности симптомов, связанных с АГ. По данным опросника SF-36 улучшились показатели физического и психологического компонента здоровья под влиянием обоих препаратов. Однако более выраженное улучшение наблюдалось на фоне приема периндоприла (рис. 9).
Таким образом, полученные результаты подтверждают гипотезу, что повреждение головного мозга, являющегося органом-мишенью при АГ, способствует развитию когнитивных нарушений, что сопровождается более значимым изменением показателей активности РААС и эндотелиальной дисфункции. Ингибиторы АПФ на сегодняшний день являются одними из наиболее широко применяемых препаратов при АГ, однако при выборе конкретного препарата следует учитывать имеющиеся фармакологические различия между отдельными препаратами. Несмотря на сопоставимость степени антигипертензивного эффекта, в плане потенциальной пользы и уменьшения когнитивных нарушений преимуществом обладают те из них, которые имеют большее сродство к тканевой РААС в головном мозге.
Заключение
У больных АГ I–II степени, не имеющих цереброваскулярных заболеваний в анамнезе, достаточно часто (60,2%) выявляются признаки нарушений когнитивных функций по данным нейропсихологического тестирования. У этих больных имеют место клинико-лабораторные особенности, такие как нарушения суточного профиля АД, высокие показатели гипертонической нагрузки, более значимое повышение уровней ангиотензина II и эндотелина-1 по сравнению с больными без нарушений когнитивных функций. По мере увеличения степени АГ у больных появляются более выраженные изменения когнитивных функций, что сопровождается и более значимыми повышениями биохимических маркеров активности РААС и функции эндотелия (ангиотензина II и эндотелина-1).
Ингибитор АПФ периндоприл по сравнению с эналаприлом, наряду с сопоставимой антигипертензивной эффективностью, обладает более выраженным церебропротективным эффектом, в большей степени снижает уровни ангиотензина II и эндотелина-1, что можно объяснить высокой липофильностью и большим сродством к тканевым компонентам РААС. Это также свидетельствует в целом о большем влиянии на активность РААС и функцию эндотелия и позволяет говорить о его плейотропных свойствах.
Литература
- Lewington S., Clarke R., Qizilbash N., Peto R., Collins R. Prospective Studies Collaboration. Age specific relevance of usual blood pressure to vascular mortality. A metaanalysis of individual data for an million adult in 61 prospective studies. Prospective studies collaboration // Lancet. 2002; 360: 1903–1913.
- Ruitenberg A., Skoog I., Ott A., Aevarsson O., Witteman, J. C., Lernfelt B. et al. Blood pressure and risk of dementia: result from the Rotterdam study and the Gothenberg H-70 study // Dement Geriatric Cogn Disord. 2001; 12: 33–39.
- Захаров В. В. Всероссийская программа исследований эпидемиологии и терапии когнитивных расстройств в пожилом возрасте («Прометей») // Неврологический журнал. 2006. Т. 11. С. 27–32.
- Jennings J. R. Zanstra Y. Is the brain the essential in hypertension? // Neuroimage. 2009; 47: 914–921.
- Masaki Mogi, Jun Iwanami and MasatsuguHoriuchi. Roles of Brain Angiotensin II in Cognitive Function and Dementia // International Journal of Hypertension. 2012, Article ID 169649, 7 p.
- Ohrui T. Alzheimer disease-contribution of renin-angiotensin system to Alzheimer disease progression // NihonRinsho. 2012, Sep; 70 (9): 1599–1603.
- Wright J. W., Harding J. W. Brain renin-angiotensin-A new look at an old system // Progress in Neurobiology. 2011, vol. 95, № 1, p. 49–67.
- Kazama K., Anrather J., Zhou P. et al. Angiotensin II impairs neurovascular coupling in neocortex through NADPH oxidase-derived radicals // Circ Res. 2004 Nov 12; 95 (10): 1019–1026. [PubMed].
- Скворцова В. И. и др. Артериальная гипертония и головной мозг // Журн. неврологии и психиатрии. 2006. № 10. С. 68–76.
- Nimmo A. J., Vink R. Recent patents in CNS drug discovery: the management of inflammation in the central nervous system // Recent Pat CNS Drug Discovery. 2009; 4: 86–95.
- Maes M., Kubera M., Obuchowiczwa E., Goehler L., Brzeszcz J. Depression’s multiple comorbidities explained by (neuro)inflammatory and oxidative &nitrosative stress pathways // NeuroEndocrinolLett. 2011; 32: 7–24.
- Sink K. M., Leng X., Williamson J., Kritchevsky S. B., Yaffe K., Kuller L., Yasar S., Atkinson H., Robbins M., Psaty B., Goff D. C. Jr. Angiotensin-converting enzyme inhibitors and cognitive decline in older adults with hypertension: results from the Cardiovascular Health Study // Arch Intern Med. 2009, Jul 13; 169 (13): 1195–1202.
- Sastre M., Richardson J. C., Gentleman S. M., Brooks D. J. Inflammatory risk factors and pathologies associated with Alzheimer’s disease // CurrAlzheimerRes. 2011; 8: 132–141.
- Ohrui T. Alzheimer disease-contribution of renin-angiotensin system to Alzheimer disease progression //NihonRinsho. 2012, Sep; 70 (9): 1599–1603.
- Phillips M. I., de Oliveira E. M. Brain renin angiotensin in disease // J. Mol. Med. 2008. 86, 715–722.
- PROGRESS collaborative group. Randomized trial of a perendopril-bases blood pressure-lowering regimen among 6105 individuals with previous stroke or transient ischemic attack // Lancet. 2001; 358: 1033–1041.
- Yamada K., Uchida S., Takahashi S. et al. Effect of a centrally active angiotensin-converting enzyme inhibitor, perindopril, on cognitive performance in a mouse model of Alzheimer’s disease // Brain Research C. 2010, vol. 1352, p. 176–186.
- Tzourio C., Anderson C., Chapman N., Woodward M., Neal B. et al. Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease // Arch. Intern. Med. 2003. 163: 1069–1075.
- Недогода С. В., Брель У. А., Чаляби Т. А. Различная эффективность антагониста рецепторов ангиотензина II и ингибитора ангиотензин-превращающего фермента в коррекции когнитивных нарушений при артериальной гипертензии у лиц пожилого возраста // Кардиоваскулярная терапия и профилактика. 2007. Т. 7, № 3, с. 21–25.
- Шлымова Р. О., Майкотова А. М., Тундыбаева М. К. Нарушение суточного ритма артериального давления — фактор риска развития когнитивных нарушений у больных с артериальной гипертонией // Функцион. диагностика. 2007. № 1, с. 25–32.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







