Введение
История изучения гастрита берет свое начало в первой половине ХVIII в. и продолжается до сегодняшнего дня. Научные достижения в области патологической анатомии, гистологии, микробиологии, эндоскопии привели к пониманию сложности проблемы, казалось бы, понятного и простого диагноза «хронический гастрит» (ХГ) на современном уровне. Это дало возможность внедрения диагностических систем и методов в клиническую практику, прогнозирования и оценки рисков развития рака желудка (РЖ) на основании изменений слизистой оболочки желудка (СОЖ).
Первые клинические наблюдения заболеваний желудка упомянуты G.E. Stahl в 1732 г. F.J.V. Broussais в 1808 г. предложил термин «гастрит» в качестве отдельной нозологической единицы. Прорыв в диагностике гастрита произошел благодаря R. Schindler в 1932 г., когда был изобретен прототип современного эндоскопа — полужесткий гастроскоп. Было введено разделение гастрита на острый и хронический: последний был подразделен на поверхностный, атрофический и гипертрофический. В 1972 г. ряд исследователей предложили топографическое деление ХГ на антральный, фундальный, кардиальный и пилорический; а также на «активный» и «неактивный» ХГ на основании наличия воспалительной инфильтрации СОЖ, введено понятие метаплазии. В 1975 г. представлена последовательность патологических изменений (каскад) от формирования неатрофического ХГ до дисплазии и РЖ. Важное открытие сделали J.R. Warren, В. Marshall в 1983 г., доказав этиологическую роль Helicobacter pylori в развитии гастрита. В 1990 г. была принята Сиднейская система классификации гастритов. Для определения степени и стадии гастрита в 2005–2008 гг. вошли в клиническую практику системы OLGA и OLGIM. Киотский консенсус в 2015 г. систематизировал данные об этиологических факторах ХГ [1].
Содержание статьи
Современные подходы к диагностике и лечению гастрита
Наиболее важные вопросы, касающиеся воспалительных заболеваний желудка, направленные на помощь медицинским работникам в клинической практике, были затронуты в работе инициативной группы — Real-world Gastritis Initiative, или RE.GA.IN., в 2022 г. [2]. Результаты работы включают восемь разделов:
-
Определения и вопросы классификации гастритов.
- H. рylori-гастрит.
-
Основные методы диагностики гастрита, вызванного H. pylori.
-
Гастрит, вызванный H. pylori: клинический исход.
-
Аутоиммунный гастрит (АИГ).
-
Редко распространенный гастрит.
-
Гастрит и микробиота желудка.
-
Эпидемиология гастрита и связанных с ним предопухолевых и опухолевых поражений.
Прежде всего, если говорить о гастрите, важно определить, что такое норма для желудка для предотвращения постановки клинически незначимых диагнозов. Норма — это отсутствие поражений или изменений СОЖ при эндоскопии и гистологических данных об изменениях структуры СОЖ, в том числе воспалительных инфильтратов, лимфоидных фолликулов, атрофии, кишечной или псевдопилорической метаплазии, гиперпластических или опухолевых изменений. Состояние СОЖ оптимально оценивать с помощью гастроскопа высокого разрешения с возможностью увеличения изображения. Для подтверждения нормальной эндоскопической картины необходимы образцы биопсии, особенно при первой гастроскопии у пациента. Мононуклеарные клетки (например, лимфоциты, гистиоциты, плазматические клетки) и небольшое количество эозинофилов могут находиться в собственной пластинке желудка в норме [3].
Диагноз гастрита устанавливается гистологически при наличии воспаления СОЖ от легкой до высокой степени и полиморфно-ядерных лейкоцитов.
Согласно Киотской классификации различают острые и хронические типы гастритов. Клинически острый гастрит имеет спектр кратковременных (обычно самокупирующихся) воспалительных изменений СОЖ, вызванных инфекционными и неинфекционными причинами [4]. Наряду с общими симптомами (лихорадка, астения, потливость, гипотония) доминирует эпигастральная боль с тошнотой, рвотой, выявляется постпрандиальный дискомфорт. При гастроскопии обычно выявляются: гиперемия, отек, рыхлость СОЖ, расширение желудка, петехии, диффузные геморрагии, эрозии, осложняющиеся редко кровотечением и флегмоной. Взятие биоптатов поможет определить этиологический фактор, однако не определит различия между острым и хроническим поражением СОЖ [5, 6]. В гистологических образцах могут выявляться как лимфоциты, обычно связанные с хроническим воспалением, так и полиморфно-ядерные нейтрофилы.
Хронический гастрит определяется как длительно текущее (обычно несамокупирующееся) воспаление СОЖ. Заболевание часто длится пожизненно при постоянном влиянии этиологического фактора, например H. pylori. ХГ обычно протекает бессимптомно, корреляция воспаления с выраженностью диспепсических симптомов обычно слабая [7]. Хроническое воспаление СОЖ приводит к постепенной потере железистых структур, к атрофии с метапластическими изменениями или без них. Различают ХГ неатрофический и атрофический [8, 9]. Неатрофический гастрит является потенциально обратимым воспалительным заболеванием с минимальным риском РЖ. Использовать ранее применявшийся термин «поверхностный гастрит» для описания неатрофического гастрита не рекомендуется как потенциально вводящий в заблуждение, поскольку воспаление, особенно в антральном отделе, часто вовлекает всю толщу СОЖ. Для диагностики и определения стадии гастрита необходимо взять не менее двух биоптатов из антрального отдела и двух из тела желудка и провести комплексную оценку по OLGA/OLGIM. Кроме того, следует брать пробы из любых аномальных участков. Биопсия угла желудка, ранее рекомендуемая Сиднейской системой, является необязательной.
При расхождении между эндоскопическими и гистологическими оценками атрофии при гастрите необходимо придерживаться следующей стратегии: при атрофических очагах, документированных эндоскопически, но подтвержденных гистологически, данный тип следует отнести к атрофическому гастриту. При выявлении атрофии гистологически в случае отсутствия эндоскопических изменений именно гистологическая оценка будет определять тактику наблюдения и лечения [10]. Эндоскопические классификации атрофии (Кимура — Такемото) и метаплазии не являются стандартными, но хорошо коррелируют с заключением по OLGA/OLGIM.
Гастрит следует дифференцировать от гастропатии, при которой выявляются аномалии СОЖ (например, фовео-лярная гиперплазия, мышечная гиперплазия) с минимальным воспалительным компонентом или без него (например, реактивная гастропатия, возникающая в результате дуоденогастрального рефлюкса, портальная гипертоническая гастропатия и антральная сосудистая эктазия) [11].
Несомненно, самый часто встречающийся этиологический фактор ХГ — это H. pylori, при котором воспаление СОЖ может сохраняться неопределенно долго. ХГ развивается почти у всех людей, инфицированных H. pylori, но стадия и степень воспаления могут зависеть от влияния факторов окружающей среды, генетики хозяина, времени после инфицирования и вирулентности бактерий. Гастрит, вызванный H. pylori, может прогрессировать из неатрофического в атрофический с прогрессированием в РЖ. Тяжесть и степень атрофического ХГ коррелируют с риском развития РЖ. Факторы, связанные с ускоренным прогрессированием гастрита, включают штамм H. pylori, вызывающий инфекцию, определенную генетическую предрасположенность хозяина, наличие родственников первой степени родства с РЖ в анамнезе, нездоровый образ жизни и вредные привычки.
Статус H. pylori можно оценить с помощью неинвазивного и инвазивного тестирования. Среди неинвазивных тестов приоритетными являются дыхательный тест и фекальные антигенные тесты. Обнаруженные при серологическом исследовании антитела к H. pylori не отражают давность инфекции и могут применяться только для первичной диагностики. Получение ДНК из биоптатов СОЖ и (в последнее время) желудочного сока также позволяет проводить молекулярное тестирование, в том числе и на устойчивость H. рylori к антибиотикам [9]. H. рylori можно обнаружить микроскопически на окрашенных слайдах, наибольшая чувствительность достигается при гистохимическом исследовании. Визуально при эндоскопии рисунок слизистой желудка выглядит как «мозаичный» или «пятнистый» [12, 13].
Исходом H. рylori-гастрита, как уже было сказано выше, может быть атрофический гастрит и атрофия СОЖ. Первый чаще всего является результатом активной инфекции H. рylori с воспалительным компонентом, богатым полиморфно-ядерными нейтрофилами; при атрофии СОЖ воспаление незначительное или отсутствует. Данный подход позволяет выделить два атрофических фенотипа исхода инфекции H. рylori, что является важным в определении тактики ведения пациента. Исследования постэрадикационных биоптатов СОЖ показывают, что часто происходит регресс атрофических изменений за счет уменьшения активности воспалительного компонента.
Основным методом лечения остается эрадикация возбудителя, что не только способствует разрешению воспаления, но и снижает риск РЖ. Ряд рандомизированных и когортных исследований показали снижение риска развития РЖ желудка примерно на 50% после успешной эрадикации H. pylori [14, 15]. Изменение образа жизни, сокращение потребления соленой и обработанной пищи, отказ от курения и чрезмерного употребления алкоголя, увеличение в рационе количества свежих овощей и фруктов могут играть важную роль в профилактике РЖ в сочетании с успешной эрадикацией H. pylori[16, 17]. Однако у пациентов, у которых уже развился атрофический гастрит, сохраняется уровень риска РЖ, аналогичный тому, который существовал до эрадикации H. pylori.
В современном мире явно просматриваются тенденции к росту заболеваемости иммуноопосредованными заболеваниями параллельно со снижением заболеваемости инфекционными болезнями [18]. Не является исключением и АИГ — первоначальное иммуноопосредованное несамокупирующееся воспаление кислотопродуцирующей слизистой оболочки, прогрессирующее до атрофии тела желудка, характеризующееся наличием специфических серологических реакций. Топография АИГ — воспалительное поражение проксимальных отделов желудка при незатронутой слизистой оболочке антрального отдела. Первичная аутоиммунная реакция направлена на париетальные клетки желудка. Распространенность АИГ колеблется от 0,1 до 2% среди населения в целом [19, 20]. Этиология и патогенез первичного АИГ до конца остаются неясными. Часто он встречается у пациентов с аутоиммунной патологией щитовидной железы, при болезни Аддисона, витилиго, целиакии и других аутоиммунных заболеваниях [21].
Диагностика АИГ осуществляется с помощью серологических методов (аутоантитела против париетальных клеток желудка и внутреннего фактора Касла, пепсиногены I и II и гастрин 17), гастроскопии и характерных гистологических данных. Диагностика атрофии неинвазивно возможна посредством измерения сывороточного гастрина 17 и пепсиногенов I и II и их соотношения [22].
У пациентов с АИГ эндоскопическая картина меняется лишь в атрофическую фазу, поэтому роль оценки по OLGA/OLGIM малоинформативна [8, 21]. Гистологические находки при АИГ заключаются в утрате кислотопродуцирующих желез, мононуклеарной инфильтрации и неметапластической атрофии. Гипоацидность приводит к потере внутреннего фактора Касла, дефициту железа и мальабсорб-ции витамина B12 и в конечном счете к анемии. Также гипохлоргидрия приводит к повышению уровня сывороточного гастрина и активизации энтерохромаффиноподобных клеток, что способствует развитию нейроэндокринной опухоли I типа. Это диктует необходимость эндоскопического наблюдения за пациентами с установленным диагнозом АИГ и проведения биопсий 1 раз в 3–5 лет [23, 24].
Помимо H. pylori, существуют и другие инфекционные причины гастрита, включая вирусы, грибы и микобактерии, особенно у лиц с ослабленным иммунитетом. Клиническая значимость редких форм гастрита невелика из-за низкой распространенности и минимального риска развития РЖ. Исключением является гастрит, вызванный вирусом Эпштейна — Барр (ВЭБ), который ассоциирован с развитием специфического подтипа РЖ — лимфоэпителиомоподобных карцином. ВЭБ-положительный РЖ преобладает у курящих мужчин, нередко выявляется после резекции желудка и чаще всего локализуется в проксимальных отделах [25, 26]. В этих ситуациях рекомендована детекция вируса, так как пациентам с ВЭБ-положительным РЖ может помочь этиотропная и иммуномодулирующая терапия.
Лекарственные препараты также могут вызывать воспалительные и невоспалительные поражения слизистой оболочки (т. е. гастропатии). Клиническая картина проявлений лекарственного гастрита (ЛГ) весьма разнообразна: от бессимптомного течения и легкой диспепсии до желудочно-кишечных кровотечений и анемии. Тяжесть проявлений зависит от дозы, продолжительности приема и типа используемых препаратов. Повреждения желудка (эрозии, язвы) не всегда соответствуют тяжести клинических проявлений.
Ключом к установлению диагноза ЛГ является хронологическая связь между употреблением препарата и возникновением клинических, эндоскопических и гистологических изменений, а также исчезновение или выраженное уменьшение этих проявлений после отмены препарата [26].
К лекарственным средствам, вызывающим повреждение СОЖ, в первую очередь относятся нестероидные противовоспалительные препараты (НПВП), включая ацетилсалициловую кислоту, за счет снижения синтеза простагландинов СОЖ. Повреждение СОЖ вызывают также пероральные препараты железа или калия, ингибиторы контрольных точек иммунитета. При длительном использовании ингибиторов протонной помпы возникают полипы фундальных желез, которые не входят в спектр гастрита, но встречаются нередко.
Всем пациентам с гастропатиями, индуцированными НПВП, показана эрадикация H. pylori [28]. При отмене лекарственного препарата прогрессирования гастрита не происходит. Ни атрофии желудка, ни развития предопухолевых или неопластических изменений как следствия ЛГ не описано.
Некоторые иммуноопосредованные системные заболевания, в том числе системная красная волчанка, склеродермия, синдром Шегрена и IgG4-ассоциированное заболевание, вызывают поражение желудка и атрофический гастрит. Изменения чаще выявляют случайно при эзофагогастродуоденоскопии (ЭГДС), проводимой по другим показаниям. Диагноз основывается на данных серологических исследований, эндоскопии и гистологии. Примерно у 55% пациентов обнаруживаются аутоантитела, чаще антинуклеарные.
Микробиота здорового желудка в основном состоит из транзиторных микроорганизмов, происходящих из полости рта и переносимых в тонкую кишку с желудочным содержимым [29]. Хорошо изучена и доказана роль H. pylori в развитии патологии желудка, но роль других микроорганизмов в патогенезе гастрита и предопухолевых поражений в настоящее время окончательно не определена. Инфекция H. pylori оказывает влияние на состав микробиоты желудка, снижая микробное α-разнообразие по сравнению с неинфицированной СОЖ. У пациентов после эрадикации H. pylori микробиота различается в зависимости от постэрадикационного фенотипа гастрита (неатрофический или атрофический) и коррелирует с кислотностью желудка.
В нескольких исследованиях сообщалось, что по мере прогрессирования атрофии и снижения секреции кислоты в микробиоте желудка начинают преобладать компоненты ротовой и/или кишечной микрофлоры, которая обладает канцерогенным потенциалом [30].
Распространенность H. pylori снижается во многих странах, особенно среди молодого населения. Вклад других факторов в эпидемиологию ХГ в отсутствие H. pylori еще предстоит определить.
Наблюдаются значительные географические различия в заболеваемости и смертности от РЖ, при этом примерно 75% новых случаев приходится на Азию. В число стран с самыми высокими показателями заболеваемости РЖ среди мужчин вошли Япония, Монголия и Республика Корея. Самая высокая заболеваемость РЖ среди женщин наблюдалась в Монголии и Таджикистане. Важнейший прогностический фактор выживаемости при РЖ — это стадия на момент постановки диагноза, для ранних стадий РЖ 5-летняя выживаемость — свыше 60% по сравнению с 5% для поздних стадий [29].
Гастрит является предопухолевым состоянием с разным уровнем риска, который зависит от таких факторов, как этиология и стадия. Следует различать предопухолевые состояния и поражения желудка. Состояния — это заболевания, которые могут прогрессировать в РЖ путем формирования атрофии и метаплазии (например, генетические аномалии, ВЭБ-гастрит, H. pylori-гастрит) [21, 31, 32]. Предраковые поражения — это состояния с уже имеющимся канцерогенным потенциалом, например пролиферация энтерохромаффинных клеток.
Риск прогрессирования предраковых состояний желудка различается в зависимости от наличия активной инфекции H. pylori, протяженности и тяжести поражения, типа интестинальной метаплазии (ИМ), факторов со стороны организма хозяина и со стороны окружающей среды. Мультифокальная или обширная неполная ИМ представляет собой ключевой компонент канцерогенеза [8, 33, 34].
Не существует клинических симптомов, которые являются надежным индикатором риска развития РЖ. Поэтому все лица, подверженные риску РЖ (стадии III–IV OLGA/OLGIM и/или обширная неполная ИМ), должны быть обследованы с помощью серологических методов, эндоскопии высокого разрешения с биопсией и гистологическим анализом по OLGA/OLGIM 1 раз в 3 года [35]. Эпидемиологические исследования подтверждают надежность оценки сывороточного соотношения пепсиноген I / пепсиноген II как индикатора функционального статуса СОЖ.
Пациенты с дисплазией низкой/высокой степени или ранним РЖ после эндоскопической резекции СОЖ или эндоскопической подслизистой диссекции остаются в группе риска по развитию РЖ. Рекомендуемый интервал эндоскопического наблюдения после эндоскопической резекции СОЖ — 1 раз в 5 лет [36].
В последнее время обсуждается роль искусственного интеллекта (ИИ) в клиническом ведении гастрита. В Китае Y. Zhang et al. [37] построили ИИ-модель сверхточной нейронной сети и провели исследования. Точность (94,2%), чувствительность (94,5%) и специфичность (94,0%) этих исследований превзошли результаты экспертов-эндоскопистов в диагностике гастрита. Общая точность диагностики как инфекции H. pylori, так и предраковых поражений желудка составила 79,6 и 90,3% соответственно. Система ИИ может стать ценным дополнительным диагностическим ресурсом, но она должна применяться параллельно с другими методами диагностики, а не заменять работу врача [38].
Таким образом, на протяжении десятилетий классификации гастрита часто изменялись, менялись и взгляды врачей на данный диагноз — от гипердиагностики до полного неприятия. Признание того, что H. pylori является наиболее распространенной причиной ХГ, существенно изменили взгляды на его этиологию, появились доказательства того, что ХГ тесно связан с РЖ. В Сиднейской системе (1990 г.), ее обновленной Хьюстонской версии (1994 г.), в Киотском глобальном консенсусе (2014 г.) были обновлены классификации. Перечисленные системы, а также выводы конференции в Маастрихте, посвященной H. pylori, конкретизация рекомендаций группы RE.GA.IN сделали подходы к классификации и диагностике гастрита более понятными для практикующих врачей.
Подходы к лечению ХГ — фокус на α-глутамил-триптофан
В последнее время наряду с уже известными подходами к лечению ХГ появляются лекарственные средства, направленные не только на устранение агрессивного фактора, но и на усиление защитных свойств СОЖ. Помимо хорошо известных лекарственных средств, таких как соли висмута, синтетические простагландины, ребамипид, появился отечественный препарат с особым механизмом действия — Регастим Гастро (действующее вещество — α-глутамил-триптофан), порошок для приготовления геля для приема внутрь, производитель — АО «МБНПК «Цитомед»1. Препарат оказывает репаративное, противовоспалительное и обволакивающее действие и применяется в комплексном лечении атрофического ХГ. Стимулирует процессы регенерации при наличии очагов атрофии СОЖ, препятствуя сокращению количества желудочных желез. Способствует снижению уровня гастрина 17 в крови, увеличению соотношения пепсиноген I / пепсиноген II, что является показателем восстановления кислотообразующей и пепсинобразующей функций2.
В проведенном Н.В. Барышниковой и профессором Ю.П. Успенским и соавт. [39] исследовании после эрадикационной терапии 58 пациентам была назначена монотерапия Регастим Гастро. Была показана эффективность исследуемого препарата в отношении его влияния на снижение интенсивности всех компонентов клеточной воспалительной инфильтрации в зоне атрофии СОЖ, что свидетельствует о его противовоспалительном действии, обеспечивающем регресс хронической воспалительной реакции (включая аллергический и аутоиммунный компоненты). Определено, что исследуемый препарат обладает благоприятным профилем безопасности. Так, исследователи отметили статистически значимое снижение в 4 раза количества нейтрофильных лейкоцитов на 1 мм2 СОЖ: с 4,0 [0,0; 23,0] до 0,0 [0,0; 2,0] (z=3,841236; p=0,000122) по сравнению с исходным состоянием на фоне приема исследуемого препарата и отсутствие подобных различий у пациентов, принимавших плацебо (до приема плацебо — 3,0 [0,0; 15,0], после приема плацебо — 1,0 [0,0; 14,0]). У пациентов из группы исследуемого препарата статистически значимо снизилось в 3 раза количество эозинофильных гранулоцитов на 1 мм2 СОЖ: с 6,0 [1,0; 15,0] до 2,0 [1,0; 8,0] (z=3,036351; p=0,002395) по сравнению с исходным состоянием. Подобные различия отсутствовали у пациентов, получавших плацебо (до приема плацебо — 5,0 [0,0; 10,0], после приема плацебо — 6,0 [1,0; 11,0]). Прием Регастим Гастро статистически значимо способствовал снижению в 1,5 раза количества макрофагов на 1 мм2 СОЖ: с 1,5 [0,0; 4,0] до 0,0 [0,0; 1,0] (z=3,085251; p=0,002034) по сравнению с исходным состоянием. Авторами отмечено отсутствие подобных различий у пациентов из группы плацебо. Явление отражает снижение интенсивности хронического локального воспаления при атрофическом гастрите. Отмечено статистически значимое снижение в 1,39 раза количества лимфоцитов на 1 мм2 СОЖ: с 35,5 [20,0; 76,0] до 25,5 [16,0; 49,0] (z=2,815422; p=0,004872) по сравнению с исходным состоянием на фоне приема препарата Регастим Гастро и отсутствие подобных различий у пациентов, принимавших плацебо (до приема плацебо — 35,5 [17,0; 49,0], после приема плацебо — 28,5 [12,0; 58,0]). Также снизилось количество плазмоцитов на 1 мм2 СОЖ в 1,42 раза: с 27,0 [14,0; 52,0] до 19,0 [10,0; 28,0] (z=2,423776; p=0,015361) по сравнению с исходным состоянием на фоне приема препарата Регастим Гастро. Отмечено снижение титра антител к H. pylori на фоне приема исследуемого препарата. Все изложенное, по мнению исследователей, может служить основанием для использования препарата Регастим Гастро в комплексной терапии атрофического ХГ, в том числе ассоциированного с H. pylori [39]. По данным суточной рН-метрии, Регастим Гастро способствует восстановлению кислотообразующей функции желудка [40]. На фоне приема препарата имело место статистически значимое (р=0,028) увеличение на 26,1% количества желез на 1 мм2 СОЖ в сравнении с исходными показателями у пациентов с атрофическим гастритом [41]. Эффекты препарата Регастим Гастро, выявленные в ряде исследований, обобщены в таблице.
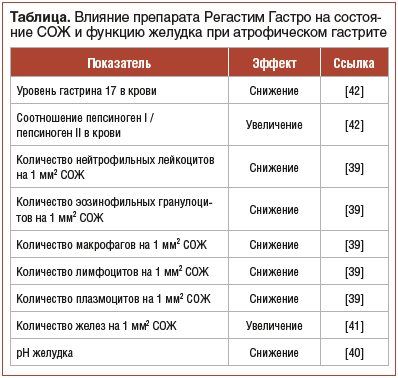
Представим собственное клиническое наблюдение пациентки с атрофическим гастритом.
Клиническое наблюдение
Пациентка П., 43 года, проходила обследование перед плановым оперативным лечением суставов. Жалоб со стороны пищеварительной системы не было. При ЭГДС выявлен мультифокальный атрофический гастрит тела и антрального отдела желудка, степень 2, стадия II по OLGA, обнаружен H. pylori в СОЖ морфологически и с помощью дыхательного теста c C13. Также выполнен анализ крови на гастропанель, выявлено снижение уровня пепсиногена I менее 30 мкг/л и снижение соотношения пепсиноген I / пепсиноген II менее 3. Антитела к париетальным клеткам желудка не выявлены. У пациентки отягощена наследственность по РЖ по линии матери.
Пациентке проведена эрадикация H. pylori схемой первой линии 14 дней. Через 4 нед. для контроля эффективности эрадикации проведен уреазный дыхательный тест с меченым атомом углерода С13. Результат теста отрицательный. По настоятельной просьбе пациентки проведена контрольная ЭГДС: остаются очаги атрофии в теле желудка, подтвержденные морфологически, а также признаки умеренной активности воспалительного процесса в СОЖ, о чем свидетельствует умеренная инфильтрация лейкоцитами СОЖ, указывающая на наличие постхеликобактерного гастрита умеренной активности. В связи с отсутствием четких рекомендаций по ведению пациентов в подобной ситуации, с учетом зарегистрированных показаний и предыдущего опыта коллег был назначен препарат Регастим Гастро за 30 мин до еды 2 р/сут на 1 мес. После лечения выполнен анализ крови на гастропанель, уровень пепсиногена I повысился, соотношение пепсиноген I / пепсиноген II — в пределах референсных значений, что является показателем восстановления пепсинобразующей функции желудка.
Заключение
Таким образом, проблема всесторонней оценки состояния СОЖ активно изучается. Определяются различные этиологические факторы, вызывающие воспалительные изменения, изучаются методы диагностики состояния СОЖ и стратификация риска развития РЖ, а также апробируются новые подходы к ведению больных с явлениями хронического воспалительного процесса в СОЖ при невозможности проведения этиотропной терапии или после устранения этиологического фактора, направленные на восстановление состояния СОЖ, кислотообразующей и пепсинобразующей функций желудка. Ѓ
1Регастим Гастро, регистрационное удостоверение ЛП-№(006130)-(РГ-RU) от 04.07.2024. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=df18c7fc-bc67-4cf6-b6a1-b1e5ec53e205 (дата обращения: 04.10.2024).
2Регастим Гастро, инструкция по медицинскому применению. (Электронный ресурс.) URL: https://cytomed.ru/product/regastim-gastro/ (дата обращения: 04.10.2024).
Информация с rmj.ru



