Для цитирования: Васильева Е.С. Угревая болезнь: клинико–иммуно–микробиологические аспекты // РМЖ. 2008. №8. С. 572
Здоровье кожи в значительной мере определяется состоянием ее симбиотической микрофлоры. Благодаря кооперации и метаболической активности симбионтная микрофлора кожи у здорового человека противодействует ее колонизации патогенными микроорганизмами. «Колонизационная резистентность» кожных покровов обеспечивается механизмами, связанными с организмом хозяина (продукция жирных кислот, иммуноглобулинов, лизоцима и др.), а также с образованием кожной микрофлорой разнообразных микробных агентов (органические кислоты, бактериоцины, перекиси, антибиотики и т.д.) [2,6]. Анализ данных литературы свидетельствует, что у больных акне имеются глубокие нарушения количественного и качественного состава микрофлоры кожи [2–5,11]. Наиболее выраженные изменения проявляются в увеличении количественного содержания на коже Staphylococcus аureus и Staphylococcus haemoliticus [5,6] и уменьшении содержания эпидермальных стафилококков, пропионибактерий и других представителей нормофлоры кожи [1,8,10]. Выделенные при акне патогенные и оппортунистические микробы, как показывают данные литературы, часто обладают устойчивостью к антибактериальным средствам (например, резистентность к эритромицину у Staphylococcus epidermidis составляет 95%, у Propionibacterium acnes – 52% [9]) и повышенным патогенным потенциалом [6,12–15].
Цель исследования: оценка состава микрофлоры кожи у больных с вялотекущими, торпидными формами акне и исследование чувствительности к наиболее часто применяемым при этой патологии антимикробным средствам.
Материалы и методы. Было обследовано 137 больных с воспалительными формами угревой болезни, которые отмечали неэффективность проводимого ранее лечения.
Согласно классификации Pochi P.E. et al. (1991) были выделены основные клинические формы заболевания: папуло–пустулезная – 104 пациента (76%) и узловатая – 33 больных (24%).
Степень тяжести заболевания определяли по методу С.Н. Соок et al. (1979) в модификации B.S. Allen, J.G. Smith (1982), на основании шкалы от 0 до 8 в зависимости от выраженности акне–элементов, их количества и площади поражения. У наблюдаемых больных отмечалась средняя и тяжелая степени тяжести, о чем свидетельствуют градации 4–6 и градации 7–8 по шкале Кука. Средняя степень тяжести преобладала у 115 (84%) больных папуло–пустулезной формой акне и у 86 (63%) – узловатой.
Возраст пациентов составил от 18 до 34 лет, давность заболевания от 5 до 12 лет. Больные на протяжении 1,5–3 лет неоднократно получали антимикробные препараты как местно, так и системно, но без клинического эффекта. Наиболее часто использовались эритромицин и доксициклин.
Объектом исследования явилась кожа лица в областях поражения до лечения и идентичные по локализации участки кожи через неделю после лечения. Взятие материала осуществлялось следующим образом: 1–2 воспалительных очага с визуально выявляемыми признаками гнойного воспаления вскрывались стерильной иглой. Шпателем осуществляли надавливание на пустулы и содержимое выдавливали на стерильный ватный тампон. Тампоны тотчас доставлялись в микробиологическую лабораторию в течение 2 часов после взятия материала. Изоляция микроорганизмов из представленного биоматериала осуществлялась в микробиологической лаборатории Больницы гражданской авиации. Посев, культивирование и идентификацию микроорганизмов проводили в соответствии с приказом МЗ СССР № 535 от 22 апреля 1985 г. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико–диагностических лабораториях лечебно–профилактических учреждений».
Посевы бактериологического материала проводили в аэробных и анаэробных условиях количественным или полуколичественным методом на плотные и жидкие питательные среды (Приказ Минздрава СССР № 535, 1985 г.; Mannual of Clinical Microbiology, 1999). Для получения изолированных колоний использовали модификацию рассева по Дригальски. Идентификацию аэробной и анаэробной флоры проводили с помощью «рутинных» методик (постановка «пестрого ряда» на 12 тестах или на микробиологическом анализаторе с автоматизированной системой i EMS Reader, Labsystems, Финляндия, с использованием планшет: СТАФИ–тест 16, НФЕРМ–тест 24, СТРЕПТО–тест 16, ЭНТЕРО–тест 16 производства «PLIVA–Lachema», Чехия). Использовали программы: «МИКРОБ» и «МИКРОБ–АВТОМАТ».
Предварительные результаты оценивали в день забора материала и через 24–48 часов при первичном просмотре чашек. Окончательный ответ с результатами идентификации и постановкой чувствительности к антибактериальным препаратам получали на 5–6–е сутки.
Определение чувствительности к антибиотикам проводили в соответствии с методическими указаниями МУК 4.2.1890–04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» (2004), а также руководствуясь стандартами Национального комитета по клиническим лабораторным стандартам США (с 2005 года – Институт клинических и лабораторных стандартов) – диско–диффузионным методом на агаре Мюллера–Хинтона (тест Кирби и Бауэра) в соответствии с руководством по микробиологии «Медицинская Микробиология» (1998) с помощью коммерческих планшет производства ЗАО «Ставрополь» и автоматизированной программы «МИКРОБ– АВТОМАТ». Использовались диски для определения чувствительности к антибиотикам: эритромицину, доксициклину, тетрациклину, азитромицину, линкомицину. Количество выросших бактерий выражали в колониеобразующих единицах (КОЕ) на 1 мл патологического материала [7].
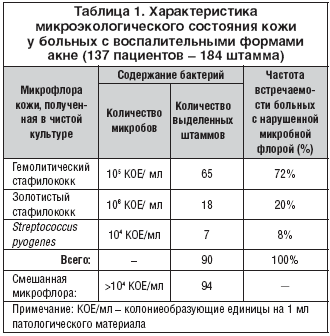
Результаты и обсуждение. Проведенное микробиологическое исследование позволило выделить из очагов поражения 184 штамма бактерий, из которых наиболее часто определялись в чистой культуре (всего 90 штаммов) штаммы гемолитического стафилококка (65 штаммов) и золотистого стафилококка (18 штаммов). Кроме того, были получены 94 штамма, обусловившие смешанный рост культур (2–3 и более). Встречались комбинации стафилококков с Peptostreptococcus anaerobius, S. epidermidis, Neisseria sicca, Propionibacterium acnes.
Все микроорганизмы при первичном исследовании высевались в концентрациях более чем 104 КОЕ/мл.
Выводы: Анализ полученных результатов подтвердил данные литературы, что у больных с пустулезными формами акне из воспалительных элементов выделяются гемолитический и золотистый стафилококки (табл. 1). Результаты наших исследований впервые показали, что у больных с упорно протекающим, торпидным к проводимому лечению течением дерматоза преобладающим возбудителем является Staph. haemoliticus (72%), в меньшей степени – Staph. аureus (20%), причем они выявлялись в 3–4 раза чаще других микроорганизмов. Кроме того, помимо Staph. аureus и Staph. haemoliticus, у части больных (8% случаев) выделялся пиогенный стрептококк (Streptococcus pyogenes).
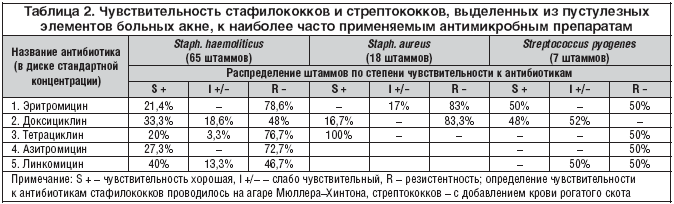
Наиболее часто выделяемый у больных акне (табл. 2) гемолитический стафилококк в 78,6% случаев резистентен к эритромицину, в 48% случаев отмечается резистентность к доксициклину, в 76,7% – к тетрациклину, т.е. к тем антимикробным препаратам, которые в настоящее время традиционно используются в практической косметологии [8,9,11] для лечения больных. Эти данные позволяют нам высказать предположение, что одной из причин хронизации дерматоза и неэффективности проводимого лечения является широкое распространение антибиотикорезистентности среди основных возбудителей.
В связи с вышеизложенным считаем целесообразным:
1. Обязательное определение чувствительности к антибиотикам у всех больных; выбор антибактериального средства осуществлять с учетом этих данных.
2. Изыскание новых антимикробных средств.
3. Более широкое использование альтернативных методов лечения акне, осложненных гнойно–воспалительным процессом, к каковым можно отнести физиотерапевтические методы, иммуностимулирующие средства, использование пробиотических препаратов, содержащих микроорганизмы и проявляющих выраженную антагонистическую активность в отношении Staph. aureus и Staph. haemoliticus.
Литература
1. Донецкая С.В. Обоснование тактики лечения вульгарных угрей на основании изучения индивидуальных особенностей корреляции общего и местного иммунитета. Дис… канд. мед. наук. – М., 1997. – 113 с.
2. Иванов А.А. Микроэкология кожи человека и ее взаимосвязь с иммунным статусом человека //Мат. науч.–практ. конф. «Микрофлора кожи человека – клинико–диагностическое значение». – М., 1989. – С.3–11.
3. Клемпарская Н.Н. Изменение микрофлоры кожи при действии на организм экзогенных и эндогенных факторов // Мат. науч.–практ. конф. «Микрофлора кожи человека – клинико–диагностическое значение». – М., 1989. – С.12–23.
4. Ковалев В.М. Методы комплексной терапии угревой болезни в свете новых данных о патогенетической роли нарушений содержания простагландина Е 2 и циклического 3, 5–аденозинмонофосфата., 1983, Дис… к.м.н.
5. Кутасевич Я.Ф., Маштакова И.А., Багмет А.Н., Шаповалова О.В. Микробиоценоз кожи у больных угревой болезнью и пути его коррекции. Украiнський журнал дерматолог, венеролог, косметолог. №1, березень 2003.– 43–47 с.
6. Нобл У.К. Микробиология кожи человека. – М.: Медицина, 1986. – 496 С.
7. Фельдман Ю.М., Миханева Л.Г., Шапиро А.В., Кузьменко В.Д. Количественное определение бактерий в клинических материалах // Лаб. дело. – 1984.– №10.– С. 616–619.
8. Braun–Falco O., G. Plewig, H.H. Wolff, W.H.C. Burgdorf Dermatology, 2000; P. 1054–1055.
9. Dreno B, Reynaud A, Moyse D, Habert H, Richet H. Erythromycin– Resistance of cutaneous bacterial flora in acne. Eur. J. Dermatol. 2001. Nov–Dec; 11(6): 549–53.
10. Holland K. T., Aldana O., Bojar R.A., Cunllife W.J., Eady E.A. Propionibacterium acnes and Acne. // Dermatology, 1998; P. 196: 67–68.
11. Kennet A. Arndt, Kathryn E. Bowers. Manual of Dermatologic Therapeutics. LWW, 2002.p.3–20.
12. Leeming J.P., Holland K.T., Cunliffe W.J. The microbial colonization of inflamed acne vulgaris lesions. Brit. J. Derm., 1988, 118 (2), 203–8.
13. Plewig G., Kligman A.M. Acne: Morphogenesis and Treatment. Berlin: Springer, 1975.
14. Plewig G., Kligman A.M. Acne: Pathogenesis; Morphologie; Therapie. Berlin etr., Springer, 1978, 348 p.
15. Webster G.F. Acne vulgaris. Clinical review. B M J 2002; Volum 325: 475–9.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Предыдущая статья
Следующая статья
Информация с rmj.ru






