Введение
Эозинофильный гранулематоз с полиангиитом (ЭГПА) относится к группе некротизирующих васкулитов с преимущественным поражением сосудов среднего и мелкого калибра [1]. ЭГПА был впервые описан J. Churg и L. Strauss в 1951 г. на основании аутопсийных данных 13 пациентов со схожей клинической картиной (тяжелая бронхиальная астма (БА), эозинофилия крови, некротизирующий васкулит с образованием внесосудистых гранулем, выявленных при вскрытии) [2]. В связи с анализом только аутопсийных данных ранняя диагностика заболевания была невозможна, а отсутствие общепринятых диагностических критериев затрудняло выявление больных ЭГПА.
В 1990 г. Американский колледж ревматологии предложил новые классификационные критерии ЭГПА, включающие астму, мигрирующие инфильтраты в легких, аномалии околоносовых пазух, моно- или полинейропатии, эозинофилию периферической крови (более 10% общего количества лейкоцитов), эозинофильные инфильтраты в тканях. Наличия четырех из шести признаков достаточно для постановки диагноза ЭГПА с 99,7% специфичностью и 85% чувствительностью [3]. В 2012 г. на конференции Chapel Hill (США, штат Северная Каролина) ЭГПА был отнесен к АНЦА-ассоциированным васкулитам (АНЦА — антинейтрофильные цитоплазматические антитела), а название «синдром Churg — Strauss», употреблявшееся при формулировке диагноза, заменено на «ЭГПА» [4]. От других некротизирующих васкулитов (гранулематоз с полиангиитом, микроскопический полиангиит, узелковый полиартериит) ЭГПА отличается частым сочетанием поражения мелких и средних сосудов с проявлениями бронхообструктивного синдрома и риносинусита, а также эозинофилией периферической крови [1, 4].
В феврале 2022 г. Американский колледж ревматологии обновил критерии диагноза ЭГПА [5]. Новые критерии могут быть применены как к пациентам, у которых ЭГПА подразумевается, так и к пациентам с уже установленным ранее ЭГПА (см. таблицу).
Эозинофильный гранулематоз с полиангиитом является одним из наиболее редко встречающихся васкулитов [1, 4, 6]. Ежегодная заболеваемость, по наблюдениям авторов из разных стран, варьирует от 0,5 до 14 случаев на 1 000 000 населения. Гендерных различий в частоте выявления васкулита нет [1, 6–8]. Приблизительно в 30–40% случаев ЭГПА ассоциирован с наличием АНЦА [8, 9]. На основании наличия или отсутствия АНЦА выделяют 2 основных иммунных фенотипа ЭГПА: АНЦА-положительный, характеризующийся выявлением аллелей HLA-DQ (Human Leukocyte Antigen DQ), перинуклеарным свечением при иммунофлуоресценции и антимиелопероксидазной активностью; АНЦА-отрицательный, характеризующийся аллергическим типом воспаления и образованием эозинофильных инфильтратов в тканях [10–13]. Антитела к протеиназе 3 нейтрофилов выявляются в 1–3% наблюдений [9]. Наличие АНЦА коррелирует с увеличением частоты развития гломерулонефрита, моно- или полинейропатий [8, 9, 13]. АНЦА-негативность чаще наблюдается у пациентов с поражением ЛОР-органов, дыхательной системы, сердечно-сосудистой системы и эозинофилией [1, 8–10].
Для определения режима начальной терапии и прогнозирования риска смертности у пациентов с АНЦА-ассоциированными васкулитами в зарубежной литературе рекомендовано использовать шкалу Five-Factor Score (FFS), включающую почечную недостаточность (сывороточный креатинин ≥150 мкмоль/л), протеинурию >1 г/сут, кардиомиопатию, поражение желудочно-кишечного тракта и центральной нервной системы, возраст старше 65 лет [14, 15]. Каждый критерий оценивается по шкале 0/1 балл. В зависимости от количества набранных баллов, а также характера течения ЭГПА выбирается один из режимов стартовой терапии: глюкокортикоиды (ГК) перорально, пульс-терапия ГК, ГК + меполизумаб, ГК + ритуксимаб, ГК + циклофосфамид, оптимизация ингаляционной терапии [14–16]. При адекватной и вовремя индуцированной терапии 5-летняя выживаемость пациентов с ЭГПА приближается к 80% [17]. Надежных стандартизированных рекомендаций по лечению АНЦА-ассоциированных васкулитов в нашей стране не разработано, а подбор терапии следует осуществлять, исходя из активности и спектра пораженных внутренних органов [18, 19].
Содержание статьи
Клиническое наблюдение
Пациентка М., 63 года, в 2015 г. впервые отметила появление одышки смешанного характера при обычной физической нагрузке. При проведении 04.08.2015 компьютерной томографии органов грудной клетки (КТ ОГК) выявлены следующие изменения: участки перибронхиального уплотнения по типу «матового стекла» преимущественно в верхушках и кортикальных отделах (пневмофиброз?); деформация интерстиция за счет Y- и V-образных расширений концевых бронхиол; очаговое образование S3 правого легкого (узелковый фиброз? гамартохондрома?); очаговое образование S3 левого легкого (внутрилегочный лимфоузел?); релаксация правого купола диафрагмы. Консультирована торакальным хирургом, показаний для биопсии не найдено. Спирография от 18.08.2015: нарушения функции внешнего дыхания (ФВД) не выявлены. В лабораторных анализах отклонения от нормы не наблюдались. В 2016 г. пациентка отметила появление сухого кашля с наличием дистантных хрипов. Аллергический анамнез не отягощен, при проведении аллергопроб сенсибилизации к основным аллергенам не выявлено. Консультирована пульмонологом, установлен диагноз «диссеминация в легких неясной этиологии с вторичным бронхообструктивным синдромом». Получала терапию комбинированным препаратом (ингаляционный ГК в средних дозах и длительно действующий β-агонист (ДДБА)) с положительным клиническим эффектом. Пульмонолог изменил диагноз на «интерстициальное заболевание легочной ткани неясной этиологии», пациентка продолжала получать прежнюю терапию.
Выявленные при КТ ОГК (04.08.2015) изменения сохранялись без существенной динамики по данным КТ ОГК в 2017–2023 гг. Исследование ФВД и лабораторные анализы до 2020 г. пациентка не выполняла, так как был достигнут контроль симптомов. По этой же причине самостоятельно отменила ингаляционную терапию.
В 2020 г. отметила усиление интенсивности кашля вплоть до приступов экспираторной одышки, нарастание интенсивности одышки (при минимальной нагрузке). Пульмонологом выставлен диагноз «БА эндогенная», вновь назначен комбинированный препарат (ингаляционный ГК в средних дозах и ДДБА) длительно. На фоне терапии 1–2 раза в год от переохлаждения возникали обострения БА (требовалось назначение системных стероидов), полностью симптомы не купировались, контроль заболевания достигнут не был. По данным медицинской документации, лабораторно в крови выявлялись эозинофилия 11% (1,01×109/л), повышение уровня С-реактивного белка (СРБ) до 24 мг/л (21.01.2021).
В июне 2021 г. в связи с сохранением симптомов БА и нарастанием выраженности одышки к терапии добавлен длительно действующий антихолинергический препарат (ДДАХ), однако полного контроля симптомов достигнуто не было.
В период 2021–2023 гг. полный контроль симптомов астмы также не достигнут, периодически беспокоила заложенность носа. По данным лабораторных исследований определялась эозинофилия 16–20%. В связи с сохраняющейся эозинофилией в 2023 г. проведено обследование на гельминтозы: данных за глистную инвазию не получено. КТ-картина в легких была прежняя.
В июле 2023 г. отметила ухудшение состояния в виде усиления интенсивности кашля, появления заложенности носа (периодически возникала с 1980 г.), увеличения потребности в бронхолитиках, снижения толерантности к физической нагрузке. Была госпитализирована в пульмонологическое отделение ГУЗ «ОКБ» г. Саратова с диагнозом «БА эндогенная, тяжелое неконтролируемое течение, в стадии легкого обострения». При дообследовании выявлен полипозный риносинусит, сохранялась эозинофилия 15% (1,47×109/л), IgE 49,6 МЕ/мл (норма от 0 до 100 МЕ/мл). В общем анализе мокроты обнаружены кристаллы Шарко — Лейдена. При спирографии выявлена умеренная бронхообструкция (объем форсированного выдоха за 1-ю секунду (ОФВ1) 68% от должного, отношение ОФВ1 к форсированной жизненной емкости легких 62%), проба с бронхолитиком положительная (прирост ОФВ1 210 мл, 15%). Пациентке проводилась тройная ингаляционная терапия (ГК в высоких дозах + ДДБА + ДДАХ).
Учитывая отсутствие полного контроля симптомов БА, наличие полипозного синусита, интерстициального поражения легких, сохраняющуюся гиперэозинофилию (>1×109/л), для исключения системного васкулита и бронхолегочного аспергиллеза проведено дообследование. Выявлены положительные АНЦА (скрининг, профиль не исследован) от 03.08.2023, IgG к аспергиллам отрицательные.
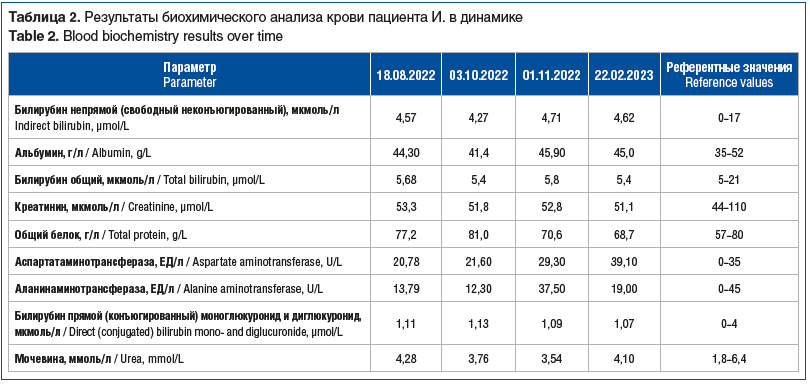
Основываясь на данных результатах, для верификации диагноза пациентку госпитализировали в ревматологическое отделение в сентябре 2023 г. На момент поступления отмечена одышка при минимальной физической нагрузке, постоянная заложенность носа, отсутствие вкуса и обоняния. При объективном обследовании обращали на себя внимание выраженная бронхиальная обструкция, снижение SpO2 до 91–93% в покое. В лабораторных анализах сохранялась эозинофилия (13%, 1,71×109/л), СРБ в пределах нормы (1,9 мг/л). При КТ ОГК в верхушках и кортикальных отделах верхних долей легких сохранялись участки перибронховаскулярного уплотнения небольших размеров, до 10 мм, неоднородной структуры по типу «матового стекла» с нечеткими неровными контурами, прежних размеров и формы. Учитывая признаки дыхательной недостаточности и высокой активности заболевания, к лечению добавили оксигенотерапию по потребности средним потоком кислорода, проводилось введение метилпреднизолона 500 мг внутривенно капельно в режиме пульс-терапии № 3, назначен метилпреднизолон 4 мг по 4 таблетки внутрь. Пациентка продолжала прием тройной ингаляционной терапии в прежнем объеме. На фоне проводимой терапии отмечено уменьшение одышки и кашля, нормализация SpO2 (без оксигенотерапии 95–96%).
На основании наличия обструкции дыхательных путей (диагностированная БА), полипов полости носа (хронический полипозный риносинусит), эозинофилии более 1×109/л, положительных АНЦА в анамнезе согласно классификационным критериям 2022 г. [5] набрано ≥6 баллов, что позволяет установить диагноз: ЭГПА, хроническое течение, АНЦА позитивные, с поражением легких, верхних дыхательных путей (хронический полипозный риносинусит), нижних дыхательных путей (БА эндогенная, тяжелое неконтролируемое течение), эозинофилия.
На амбулаторном этапе было рекомендовано продолжить прием пероральных ГК (метилпреднизолон 4 мг 4 таблетки), тройную ингаляционную терапию (ГК+ДДБА+ДДАХ). На фоне получаемой терапии отмечено увеличение толерантности к физическим нагрузкам, уменьшение одышки, приступов кашля и удушья, восстановление восприятия запахов и вкуса, снизилось количество эозинофилов в крови (2%). При повторном исследовании АНЦА (профиль) антитела к миелопероксидазе и протеиназе 3 — отрицательные.
Учитывая поражение легких («матовое стекло» по данным КТ ОГК), отсутствие полного контроля БА на фоне гормональной терапии (хотя и с явной положительной динамикой), необходимость снижения дозы пероральных ГК, обсуждался вопрос о назначении цитостатической терапии. Перед началом терапии пациентке амбулаторно был выполнен диаскин-тест. Положительный тест (20 мм) потребовал консультации фтизиатра. Был исключен активный туберкулез, установлено наличие латентной туберкулезной инфекции, в связи с чем рекомендовано проведение профилактической противотуберкулезной терапии.
В связи с невозможностью проведения цитостатической терапии, наличием тяжелой БА было решено назначить терапию меполизумабом (моноклональное антитело к интерлейкину (ИЛ) 5) на фоне профилактического курса туберкулостатической терапии.
Обсуждение
Согласно данным литературы ЭГПА с одинаковой частотой выявляется у мужчин и женщин в возрасте 35–50 лет [6, 16]. В нашем исследовании диагноз ЭГПА установлен у женщины в возрасте 63 лет, при этом первые симптомы заболевания отмечены в возрасте 55 лет.
В связи с разнообразной клинической картиной ЭГПА в дебюте заболевания пациенты чаще всего обращаются не к ревматологам, а к ЛОР-врачам, пульмонологам, неврологам, кардиологам. Учитывая данное обстоятельство, а также недостаточную ориентированность практикующих врачей в критериях диагноза ЭГПА и редкую встречаемость васкулита, приходится признать, что с момента появления клинических симптомов до постановки верного диагноза в среднем проходит 8–10 лет [1, 6, 9, 16]. В описанном нами наблюдении с появления первых симптомов (одышка и интерстициальное поражение легких в 2015 г., типичная клиническая картина БА с фиксацией бронхообструктивного синдрома и назначение ингаляционных ГК и ДДБА в 2016 г., установленный диагноза БА и гиперэозинофилия в 2020 г.) до верификации диагноза (в 2023 г.) прошло 8 лет. Затруднения в диагностике обусловлены недостаточной осведомленностью практикующих врачей о таком редком заболевании, как ЭГПА. Ускорить постановку диагноза могли бы более ранний тщательный анализ клинической картины заболевания (гиперэозинофилия, интерстициальное поражение легких нехарактерны для БА) и направление на обследование в специализированный стационар.
Необходимо отметить, что описанный нами клинический случай имеет типичную клиническую динамику развития симптомов, характерных для ЭГПА. Сначала превалируют симптомы БА и риносинусита, затем появляются гипер-эозинофилия, легочные изменения и поражение висцеральных органов [7–10, 15]. Следует рассматривать клинические проявления совместно с лабораторными (в том числе иммунологическими) и инструментальными данными. Подтверждению диагноза и более раннему выявлению васкулита может способствовать проведение биопсии для выявления эозинофильных гранулем в периваскулярных тканях, стенках сосудов, внутренних органах [20].
Выбор начальной терапии (монотерапия или комбинация препаратов) при ЭГПА зависит от риска смерти, поражения внутренних органов, активности и тяжести заболевания [14, 15, 21].
В последнее время ведутся активные дискуссии о минимизации применения ГК для уменьшения побочных эффектов, а в ряде исследований не получено разницы с исходом васкулита при применении меньших доз ГК. Дозу ГК следует титровать строго под контролем клинико-лабораторных параметров для предотвращения рецидива заболевания, а добавление иммуносупрессивных препаратов (метотрексат, циклофосфамид или азатиоприн) помогает быстрее достичь ремиссии и модифицирует течение заболевания [22–24].
В настоящее время возможности лечения ЭГПА расширились и включают назначение генно-инженерных биологических препаратов (ГИБП). Основанием для использования моноклональных антител служит хороший терапевтический эффект при лечении заболеваний со схожим патогенезом. Одним из представителей ГИБП является меполизумаб, ингибирующий связывание ИЛ-5 с рецепторами и предотвращающий пролиферацию, созревание и дифференцировку эозинофилов [25]. Ранее назначение меполизумаба хорошо себя зарекомендовало у пациентов с тяжелой эозинофильной БА, так как приводило к длительному снижению абсолютного количества эозинофилов с достижением клинической ремиссии [26, 27]. В ряде многоцентровых исследований после добавления меполизумаба достигнуто большее количество ремиссий и меньшее количество рецидивов у пациентов с ЭГПА, что позволяет уменьшать поддерживающую дозу ГК или отменять их [25, 28, 29]. Таким образом, доказанная эффективность меполизумаба с минимальными побочными эффектами позволила одобрить его для лечения ЭГПА и рекомендовать в рассматриваемом случае.
Заключение
Представлено клиническое наблюдение, которое демонстрирует сложности диагностики ЭГПА. Разнообразие клинической картины в дебюте заболевания, постепенное появление симптоматики, необходимость учета не только клинических, но и лабораторных показателей — все это обусловливает трудности в постановке верного диагноза на ранних стадиях. В данной статье описан клинический случай относительно поздней диагностики ЭГПА, что, возможно, связано с недостаточной осведомленностью практикующих врачей об этом редком заболевании и с поздним направлением больной к ревматологу. Ускорить постановку диагноза могут не только морфологическая верификация и иммунологическое обследование, но и обсуждение подобных клинических случаев в медицинском сообществе. В настоящее время возможности терапии ЭГПА расширены за счет включения заболевания в показания к биологическим методам лечения, нацеленным на ИЛ-5, что позволит улучшить прогноз болезни и снизить бремя длительного приема гормональных препаратов.
СВЕДЕНИЯ ОБ АВТОРАХ:
Кароли Нина Анатольевна — д.м.н., профессор кафедры госпитальной терапии лечебного факультета ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0002-7464-826X.
Канаева Татьяна Владимировна — ассистент кафедры госпитальной терапии лечебного факультета ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0002-9451-9318.
Никитина Наталья Михайловна — д.м.н., заведующая кафедрой госпитальной терапии лечебного факультета, ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0002-0313-1191.
Контактная информация: Кароли Нина Анатольевна, e-mail: nina.karoli.73@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.01.2024.
Поступила после рецензирования 15.02.2024.
Принята в печать 14.03.2024.
ABOUT THE AUTHORS:
Nina A. Karoli — Dr. Sc. (Med.), Professor of the Department of Hospital Therapy of the Faculty of Medicine, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazachya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0002-7464-826X.
Tatyana V. Kanaeva — Assistant of the Department of Hospital Therapy of the Faculty of Medicine, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazachya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0002-9451-9318.
Natalia M. Nikitina — Dr. Sc. (Med.), Professor of the Department of Hospital Therapy of the Faculty of Medicine, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazachya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0002-0313-1191.
Contact information: Nina A. Karoli, e-mail: nina.karoli.73@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 23.01.2024.
Revised 15.02.2024.
Accepted 14.03.2024.
Информация с rmj.ru