Введение
Артериальная гипертензия имеет крайне высокую распространенность не только в России, но и в мире и является одним из важнейших факторов развития сердечно-сосудистых заболеваний и осложнений, таких как инфаркт миокарда, инсульт, ишемическая болезнь сердца, хроническая сердечная недостаточность, цереброваскулярных (ишемический или геморрагический инсульт, транзиторная ишемическая атака) и почечных (хроническая болезнь почек) заболеваний [1].
Распространенность АГ увеличивается с возрастом, достигая 60% и выше у лиц старше 60 лет [2]. Поскольку наблюдаемое увеличение продолжительности жизни сопровождается постарением населения и, соответственно, увеличением количества малоподвижных пациентов с избыточной массой тела, прогнозируется, что распространенность АГ будет расти во всем мире. Согласно прогнозу к 2025 г. число пациентов с АГ увеличится на 15–20% и достигнет почти 1,5 млрд [3].
Существуют разновидности офисного измерения АД:
Измерения в клинических исследованиях. Такие измерения всегда тщательно стандартизованы, следуют протоколу. В последнее время выполняются в основном электронными приборами.
Измерения в реальной клинической практике. Без четкого соблюдения условий измерения, продолжительности отдыха, положения пациента, количества измерений, метода усреднения и т. д. Завышены по сравнению с пунктом 1 в среднем на 14/10 мм рт. ст., однако эта разница приблизительна ввиду отсутствия стандартизации методологии [4].
Автоматическое офисное измерение давления. В среднем ниже пункта 1 на 5/5 мм рт. ст. и примерно соответствует дневным значениям суточного мониторирования АД. Исключает многие ограничения офисных измерений, но требует дополнительных материальных ресурсов и малодоступно [5].
Артериальная гипертензия — важнейший фактор риска фибрилляции предсердий (ФП) — наиболее часто встречающегося устойчивого нарушения ритма сердца, нередко приводящего к серьезным последствиям и являющегося причиной преждевременной смерти больных с этой патологией. В исследованиях RACE и AFFIRM установлено, что сочетание ФП с АГ резко увеличивает риск тромбоэмболических осложнений, в том числе инсульта, несмотря на терапию антикоагулянтами [6, 7]. В настоящее время АГ рассматривается как определяющий, независимый, потенциально обратимый фактор риска развития ФП. Роль АГ в развитии ФП подтверждена в нескольких крупных клинических исследованиях: STOP-2, CAPPP, LIFE [8–10]. Именно поэтому так важно вовремя диагностировать повышение АД, для чего необходимы устройства, характеризующиеся наибольшей чувствительностью и точностью измерений. Измерение АД у больных с ФП затруднено из-за высокой вариабельности показателей. Чтобы получить репрезентативное среднее значение, АД следует измерять как можно чаще. Каждое измерение должно повторяться не менее 3 раз подряд [11], так как вариабельность АД у больных с ФП существенно выше, чем у пациентов с синусовым ритмом.
Цель исследования: выявить показания к использованию у пациентов с ФП разных типов тонометров: механического типа, автоматического типа с индикатором аритмии с манжетами на плечо и автоматического типа с индикатором аритмии с манжетами на предплечье.
Материал и методы
Исследование проводилось с января по март 2021 г. сотрудниками кафедры терапии, клинической фармакологии и скорой медицинской помощи ФГБОУ ВО МГМСУ
им. А.И. Евдокимова Минздрава России на базе многопрофильного стационара ГКБ им. С.И. Спасокукоцкого. В исследовании участвовали пациенты старше 18 лет с ФП любой этиологии, пароксизмальной формой, сроком давности не более 1 мес., а также с постоянной формой ФП (тахисистолическая форма), которые дали согласие на включение в исследование. У всех пациентов в анамнезе было указание на АГ различной степени тяжести. Продолжительность исследования для каждого пациента максимально составила 1 сут. Критерием исключения служил отказ пациента от участия в исследовании.
В исследование было включено 202 пациента, из них 122 женщины. Средний возраст обследованных составил 61,8±1,3 года. Пациенты распределены по группам в зависимости от отделения, где они находились на момент измерения АД. В каждой группе проводилось последовательное сравнение данных, полученных путем измерения механическим тонометром и автоматическими тонометрами с манжетой на плечо, а также механическим тонометром и автоматическими тонометрами с манжетой на запястье.
В работе использованы механический тонометр E-mega I (Riester), показания которого служили контролем, автоматический тонометр OMRON M2 BASIC HEM-7121-ALRU (OMRON M2 BASIC) с встроенным индикатором аритмии, автоматический тонометр OMRON RS2 HEM-6121-Ru (OMRON RS2) и автоматические тонометры других производителей (В1 и А1 — автоматические тонометры с манжетами на плечо, В2 и А2 — автоматические тонометры с манжетами на запястье (запястные тонометры)).
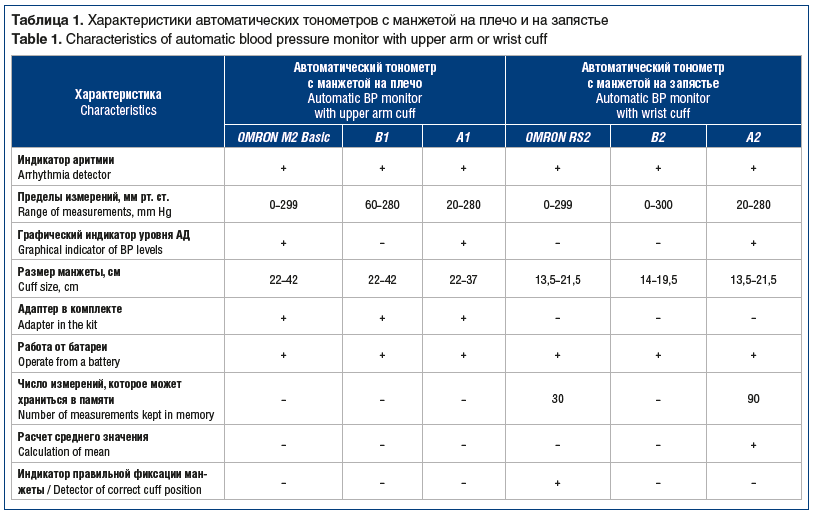
Для исследования подобрали приборы, максимально идентичные по своим техническим характеристикам, основными из которых считаем: наличие у приборов соответствующих сертификатов, наличие индикатора аритмии, размер манжеты (для правильной фиксации на плече/запястье), возможность использования от сети питания и/или от батарей. В таблице 1 представлены основные характеристики использованных тонометров, взятые с официальных сайтов компаний и из инструкций к приборам.
Измерения АД проводили трехкратно в течение суток: в 8:00,12:00 и 16:00.
Измерения осуществляли последовательно на одной и той же руке. Интервалы между измерения составляли 2–3 мин:
1-е измерение — «тренировочное» измерение механическим тонометром;
2-е измерение — «тренировочное» измерение тестируемым автоматическим тонометром;
3, 5, 7, 9-е измерения — экспериментальные измерения механическим тонометром;
4, 6, 8-е измерения — экспериментальные измерения тестируемым девайсом.
У всех пациентов, вошедших в исследование, на момент измерения АД имела место ФП, зарегистрированная на электрокардиограмме. Исследование проводилось в трех отделениях: интенсивной терапии, общей реанимации и терапевтическом отделении.
Статистическую обработку данных проводили в программе Microsoft Exel 2010. Для определения статистической значимости различий использовали U-критерий Манна — Уитни. Различия считали статистически значимыми при p≤0,05.
Результаты исследования
Первую группу составили 68 пациентов, из них 36 мужчин, находившихся на лечении в отделении реанимации. Средний возраст обследованных составил 65,4±1,1 года. У 48 пациентов диагностирована ишемическая кардиомиопатия, у 8 — постинфарктный кардиосклероз, у 12 — токсическое поражение миокарда. Состояние пациентов расценено как тяжелое.
Результаты измерений систолического (САД) и диастолического (ДАД) АД тестируемыми тонометрами с манжетой на плечо и механическим тонометром представлены на рисунке 1.
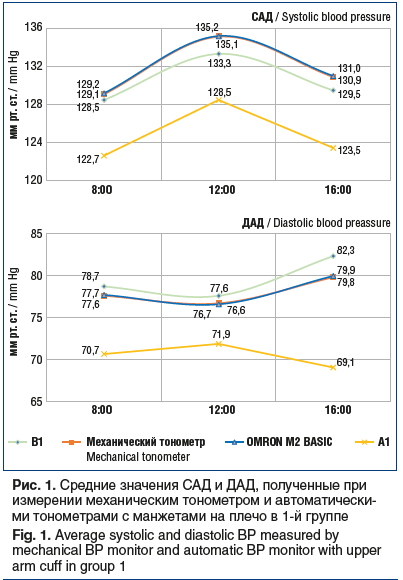
Отличия показателей САД тонометров OMRON M2 BASIC и В1 от показателей механического тонометра были статистически незначимыми (р≥0,05), минимальное отличие от показателей механического тонометра наблюдалось при измерении тонометром OMRON M2 BASIC. Отклонение показателей тонометра А1 от показателей механического тонометра составило -6,8 мм рт. ст. (p≤0,05).
Что касается значений ДАД, отклонения показателей автоматического тонометра OMRON M2 BASIC и В1 от показателей механического тонометра были статистически незначимыми и составили +0,1 и +1,5 мм рт. ст. соответственно (р≥0,05). При сравнении показателей ДАД механического тонометра и автоматического тонометра А1 разность показателей составила -7,5 мм рт. ст. (p≤0,05).
При измерении давления при помощи запястных тонометров были получены результаты, представленные на рисунке 2.
Анализ значений САД показал, что отклонение показателей тонометра В2 от значений механического тонометра составило +9 мм рт. ст. (p≤0,05), тонометра А2 — -9,2 мм рт. ст. (p≤0,05). Для тонометра OMRON RS2 отклонение было минимальным и составило +0,6 мм рт. ст. (р≥0,05).
Применительно к значениям ДАД отклонения от контрольных значений составили +6,2 мм рт. ст. (p≤0,05), -8 мм рт. ст. (p≤0,05) и +0,1 мм рт. ст. (р≥0,05) соответственно.
Таким образом, в 1-й группе пациентов отделения общей реанимации незначимые отклонения при измерении САД и ДАД от показателей механического тонометра были только у тонометров OMRON RS2 и
ОMRON M2 BASIC.
Во 2-й группе было 66 пациентов, из них 38 женщин (средний возраст всех пациентов — 57,2±3,1 года), находившихся в отделении интенсивной терапии. У 46 пациентов диагностирована ишемическая кардиомиопатия, у 10 — постинфарктный кардиосклероз, у 8 — токсическое поражение миокарда, у 2 — тиреотоксикоз. Состояние расценено как тяжелое в 35 наблюдениях, как среднетяжелое — в 31.
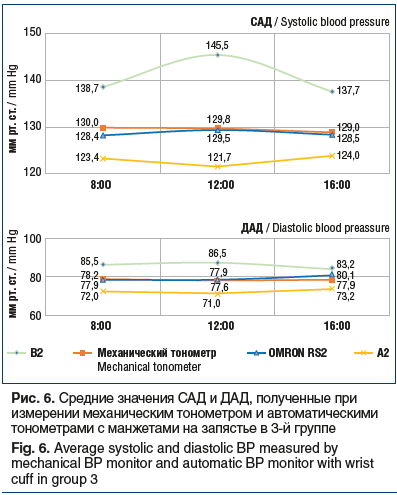
Результаты измерения АД (рис. 3) с помощью механического тонометра и автоматических тонометров с манжетой на плечо показали, что статистически значимые отклонения показателей САД на протяжении всего дня продемонстрировали приборы В1 — +9,1 мм рт. ст. (p≤0,05) и А1 — -8,7 мм рт. ст. (p≤0,05). Для тонометра OMRON M2 BASIC отклонение значения САД от результатов механического тонометра составило +0,5 мм рт. ст. (p≥0,05).
Для показателей ДАД получены следующие отклонения относительно контрольных значений механического тонометра: для автоматического тонометра В1 — +8,6 мм рт. ст. (р≤0,05), для тонометра А1 — -7,3 мм рт. ст. (р≤0,05), для прибора OMRON M2 BASIC — +0,5 мм рт. ст. (р≥0,05).
При измерении АД при помощи запястных тонометров были получены значения, приведенные на рисунке 4.
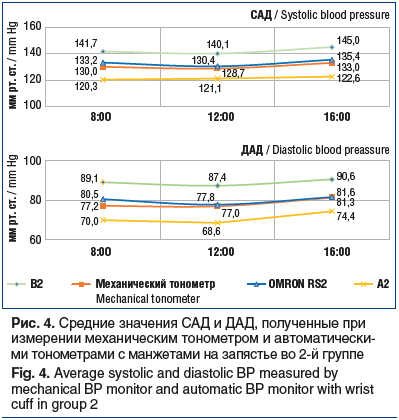
При использовании тонометра В2 отклонения значений САД относительно значений тонометра сравнения были в большую сторону — +8,4 мм рт. ст. (p≤0,05), при использовании тонометра А2 — в меньшую сторону — -9,3 мм рт. ст. (p≤0,05). Тонометр OMRON RS2 показал минимальное среднее отклонение САД — -1 мм рт. ст. (р≥0,05). Отклонения ДАД показателей автоматических тонометров от механического для В2 составило +10,5 мм рт. ст. (р≤0,05), для А2 — -7,5 мм рт. ст. (р≤0,05), для OMRON RS2 — +0,5 мм рт. ст. (р≥0,05).
Таким образом, в данной группе пациентов значения САД и ДАД при использовании тонометров OMRON M2 BASIC, OMRON RS2 статистически значимо не отличались от данных, полученных при использовании механического тонометра. Тонометры OMRON M2 BASIC, OMRON RS2 можно рекомендовать использовать у данной группы пациентов для контроля АД.
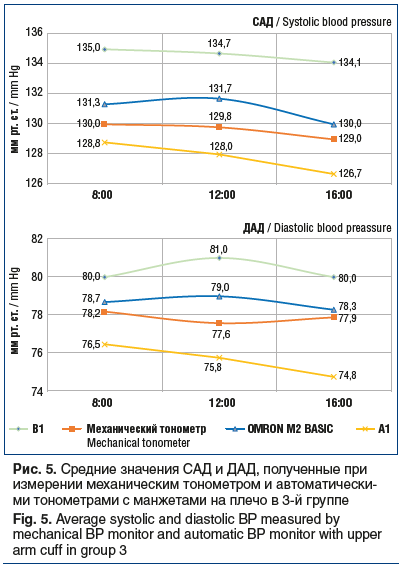
Третья группа исследования включала 68 пациентов (из них 46 женщин), средний возраст которых составил 62,6±1,5 года. У 27 пациентов выставлен диагноз ишемической кардиомиопатии, у 26 — постинфарктный кардиосклероз, у 15 — токсическое поражение миокарда. Состояние 23 пациентов расценено как среднетяжелое, 45 — как удовлетворительное. Измерения проводились в отделении терапии.
При сопоставлении значений как САД, так и ДАД, полученных при использовании автоматических тонометров, с показателями механического тонометра статистически значимых различий не получено (р≥0,05) (рис. 5).
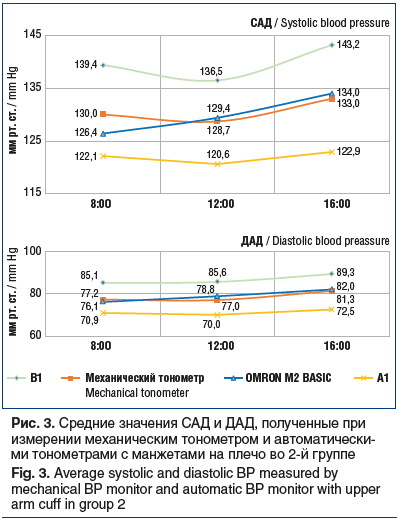
При измерении давления при помощи запястных тонометров были получены значения, представленные на рисунке 6. Для САД были выявлены следующие отклонения значений от данных механического тонометра: у тонометра В2 оно составило +10,9 мм рт. ст. (p≤0,05), у тонометра А2 — -6,5 мм рт. ст. (p≤0,05), у тонометра OMRON RS2 — -0,8 мм рт. ст. (р≥0,05).

Что касается ДАД, то отклонение от контрольных значений для тонометра В2 составило +7,1 мм рт. ст. (р≤0,05), для тонометра А2 — -5,8 мм рт. ст. (р≤0,05), для тонометра OMRON RS2 — +0,7 мм рт. ст. (р≥0,05).
Относительно 3-й группы мы можем сделать вывод, что все автоматические тонометры с манжетой на плечо и запястный тонометр OMRON RS2 определяли значения, близкие к показателям механического тонометра, и могут быть использованы для амбулаторного измерения АД у пациентов с ФП.
Обсуждение
Для достижения целевых значений АД помимо медикаментозной терапии необходимо получать объективные данные САД и ДАД, что подчас затруднено у пациентов с нарушениями сердечного ритма ввиду возрастающей со степенью тяжести возможности возникновения ошибки прибора. Полученные в трех группах пациентов данные показали, что результаты измерения АД у пациентов с аритмией любой тяжести автоматическими тонометрами OMRON M2 BASIC и OMRON RS2 близки и статистически неразличимы с результатами измерения механического тонометра.
Другие изученные приборы (А1, А2 и В1, В2) имели статистически значимые отклонения от механического измерителя АД, и эти различия были выражены тем больше, чем тяжелее была аритмия у пациента. Общая тенденция во всех группах: для тонометров A показатели АД были ниже, чем у механического тонометра, для тонометров B — выше, и эти различия были статистически значимы.
Заключение
Обеспечение контроля АД у пациентов с ФП как на стационарном, так и на амбулаторном этапе являются важным компонентом адекватного ведения пациентов с указанной патологией. Чем точнее прибор будет показывать АД у больных аритмией, тем корректнее будет антигипертензивная терапия, что особенно важно для среднетяжелых и тяжелых пациентов. И если у пациентов с легкой, стабильной аритмией можно использовать практически любой автоматический тонометр, то для более тяжелых случаев необходим прибор, который будет показывать точное значение САД и ДАД при значимо измененном ритме. Проведенное клиническое исследование показало, что в отделении реанимации возможно использование тонометров OMRON M2 BASIC и OMRON RS2. Также можно рекомендовать OMRON M2 BASIC и OMRON RS2 для измерения АД у пациентов с ФП на амбулаторном приеме и для самоконтроля АД пациентами в домашних условиях.
Благодарность
Редакция благодарит АО «КомплектСервис» за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgment
Editorial Board is grateful to JSC ComplectService for the assistance in technical edition of this publication.
069191.
Сведения об авторах:
Верткин Аркадий Львович — д.м.н., профессор, заведующий кафедрой терапии, клинической фармакологии и скорой медицинской помощи ГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; ORCID iD 0000-0001-8975-8608.
Сычева Александра Сергеевна — ассистент кафедры терапии, клинической фармакологии и скорой медицинской помощи, заведующая 3-м терапевтическим отделением Клинического центра COVID-19 ГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; ORCID iD 0000-0001-8804-9914.
Кебина Анастасия Леонидовна — ассистент кафедры терапии, клинической фармакологии и скорой медицинской помощи, заместитель главного врача по медицинской части Клинического центра COVID-19 ГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; ORCID iD 0000-0002-7570-9650.
Сергеева Елизавета Антоновна—ординатор кафедры терапии, клинической фармакологии и скорой медицинской помощи ГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1.
Малявина Мария Александровна —ординатор кафедры терапии, клинической фармакологии и скорой медицинской помощи ГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1.
Контактная информация: Сычева Александра Сергеевна, e-mail: docsycheva@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.03.2021.
Поступила после рецензирования 13.04.2021.
Принята в печать 07.05.2021.
About the authors:
Arkadiy L. Vertkin — Dr. Sc. (Med.), Professor, Head of the Department of Therapy, Clinical Pharmacology, & Emergency, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation; ORCID iD 0000-0001-8975-8608.
Aleksandra S. Sycheva — assistant of the Department of Therapy, Clinical Pharmacology, & Emergency, Head of the 3rd Therapeutic Department of the COVID-19 Clinical Center, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation; ORCID iD 0000-0001-8804-9914.
Anastasiya L. Kebina — assistant of the Department of Therapy, Clinical Pharmacology, & Emergency, Deputy Head Doctor for Medical Work of the COVID-19 Clinical Center, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation; ORCID iD 0000-0002-7570-9650.
Elizaveta A. Sergeeva — resident of the Department of Therapy, Clinical Pharmacology, & Emergency, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation.
Mariya A. Malyavina — resident of the Department of Therapy, Clinical Pharmacology, & Emergency, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation.
Contact information: Aleksandra S. Sycheva, e-mail: docsycheva@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.03.2021.
Revised 13.04.2021.
Accepted 07.05.2021.
.
Информация с rmj.ru






