Содержание статьи
Сравнительная оценка влияния нимесулида на верхние отделы желудочно-кишечного тракта
А. Е. Каратеев, доктор медицинских наук, профессор
ФГБУ НИИР им. В. А. Насоновой РАМН, Москва
Нимесулид — один из наиболее популярных в России представителей группы нестероидных противовоспалительных препаратов (НПВП). Это лекарство имеет в нашей стране репутацию эффективного и достаточно безопасного анальгетика и широко используется в различных отраслях медицины (прежде всего, в ревматологии, неврологии и травматологии), в которых имеется необходимость борьбы с острой или хронической болью [1–3].
Одной из главных особенностей российского опыта применения нимесулида является нередкое использование его продолжительными курсами. В большинстве стран мира нимесулид рассматривается прежде всего как ургентное обезболивающее средство; учитывая ограничения контролирующих органов, он назначается лишь на короткое время, обычно менее двух недель [4]. В нашей стране, напротив, нимесулид часто рекомендуют больным с хроническими заболеваниями, такими как остеоартроз (ОА), ревматоидный артрит (РА) и анкилозирующий спондилоартрит (АС). При этой патологии суммарный срок приема нимесулида у российских пациентов может достигать многих месяцев и даже лет.
Такая практика дает большой материал для оценки достоинств и недостатков лекарства, прежде всего, его безопасности.
Как известно, главной проблемой НПВП является риск развития побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы [5, 6]. При этом основным достоинством нимесулида считается хорошая гастроинтестинальная переносимость, что, собственно, определяет основное преимущество этого препарата в сравнении со многими другими НПВП [1–4, 7].
Однако четких доказательств, подтверждающих низкий риск серьезных ЖКТ-осложнений (таких как кровотечения и клинически выраженные язвы) при использовании нимесулида, относительно немного. Имеются лишь немногочисленные работы, в которых специально изучалась частота таких опасных побочных эффектов, и отдельные исследования, организованные в соответствии с жесткими современными критериями «доказательной медицины», — двойные слепые, рандомизированные и контролируемые [7–9].
В этом случае большое значение приобретает анализ частоты осложнений, которые отмечаются в реальной клинической практике. Так, в клинику ФГБУ НИИР им. В. А. Насоновой РАМН ежегодно поступает для стационарного лечения большое число пациентов с различными ревматическими заболеваниями (РЗ) — ревматоидным артритом (РА), остеоартрозом (ОА), серонегативными спондилоартритами (ССА) и др., которые в течение длительного времени принимают НПВП, в т. ч. нимесулид. В данном учреждении функционирует собственный эндоскопический кабинет, основным направлением работы которого является выявление патологии верхних отделов ЖКТ. Результаты обследования больных РЗ, которые находятся в архиве кабинета эндоскопии, позволяют получить достаточно большой материал для оценки частоты патологии верхних отделов ЖКТ, возникающей на фоне приема НПВП.
Целью настоящего исследования было оценить сравнительную частоту и характер изменений верхних отделов ЖКТ у больных РЗ, регулярно принимавших нимесулид.
Материал и методы исследования
Мы провели ретроспективный анализ результатов всех эндоскопических исследований верхних отделов ЖКТ (эзофагогастродуоденоскопия (ЭГДС)), выполненных за период 2011–2013 гг. в клинике ФГБУ НИИР им. В. А. Насоновой РАМН больным РЗ, которые не менее 1 месяца до проведения данной процедуры получали нимесулид. В качестве контроля были использованы результаты ЭГДС, проведенных в тот же период всем больным, не менее месяца получавшим другие неселективные НПВП.
Все пациенты были направлены на эндоскопическое исследование лечащими врачами в связи с наличием определенных показаний: для исключения патологии верхних отделов ЖКТ из-за наличия симптомов гастроэзофагеального рефлюкса, гастралгии или диспепсии, наличия в анамнезе язвы желудка или двенадцатиперстной кишки (ДПК), для поиска источника анемии, для проведения онкопоиска, при необходимости взятия биопсии слизистой оболочки ДПК на амилоид и др.
Критериями отбора больных для проведения анализа являлся возраст старше 18 лет и зафиксированный в медицинской документации факт регулярного использования НПВП в течение не менее 1 месяца до момента до проведения ЭГДС.
В анализ не включались данные эндоскопического исследования у больных системными РЗ, при которых поражение ЖКТ может быть проявлением висцеральной патологии: системной склеродермией, поли/дерматомиозитом, системной красной волчанкой, болезнью Бехчета и системными васкулитами. В контрольную группу также не были включены пациенты, использовавшие мелоксикам, целекоксиб и эторикоксиб; принимавшие участие (на момент проведения ЭГДС) в клинических исследованиях, в которых изучалась безопасность НПВП; направленные на ЭГДС для контроля результатов курсового лечения язвы желудка, и/или ДПК, или эрозивного эзофагита.
Суммарно за три года ЭГДС была выполнена 1048 больным, соответствующим критериям отбора и принимавшим нимесулид, а также 816 больным, использовавшим другие неселективные НПВП. Этими препаратами были в основном диклофенак, кетопрофен, индометацин, ацеклофенак и ибупрофен; лишь единичные больные регулярно принимали пироксикам, теноксикам, кеторолак или метамизол.
Клиническая характеристика больных в исследуемых группах представлена в таблице.
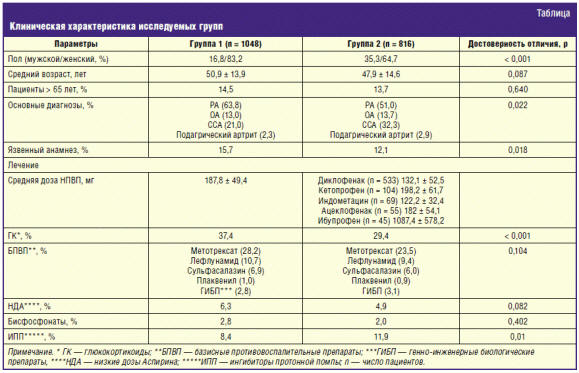
Как видно, большинство пациентов были женщины среднего возраста, страдавшие ревматоидным артритом. В целом исследуемые группы были сопоставимы — правда, в контрольной группе было достоверно больше пациентов, страдающих ССА (преимущественно анкилозирующим спондилоартритом). Этот факт объясняет более высокую долю лиц мужского пола в контрольной группе. Следует отметить, что больные, принимавшие нимесулид, чаще имели язвенный анамнез, чаще принимали глюкокортикоиды (ГК) и достоверно реже — ингибиторы протонной помпы (ИПП).
При анализе результатов ЭГДС мы учитывали выявление эрозий, под которыми подразумевался поверхностный дефект слизистой, не имеющий видимой глубины, и язв — локального повреждения стенки ≥ 5 мм, имеющего видимую глубину. При обнаружении менее 10 эрозий они описывались как «единичные», а при выявлении ≥ 10 — как «множественные».
Электронная база данных была создана с помощью программы Microsoft Office Excel 2007, статистический анализ проводился с помощью программы SPSS 10.0. Приведенные в статье цифровые значения представлены в виде M ± m. Для оценки значимости отличия количественных параметров использован t-тест Стьюдента, для качественных параметров — χ2 или точный тест Фишера.
Результаты
Общее число больных с эрозиями или язвами в группе 1 составило 244 (23,3%), в группе 2 — 272 (33,3%), р < 0,001 (рис.). При этом единичные эрозии чаще встречались у больных, принимавших нимесулид, в сравнении с получавшими другие НПВП. Но более серьезная патология — множественные эрозии и особенно язвы выявлялись в группе 1 значительно реже. Так, общее число больных, у которых на фоне приема нимесулида возникла язва желудка и/или ДПК, составило 46 (4,4%), а в контрольной группе — 119 (14,6%).
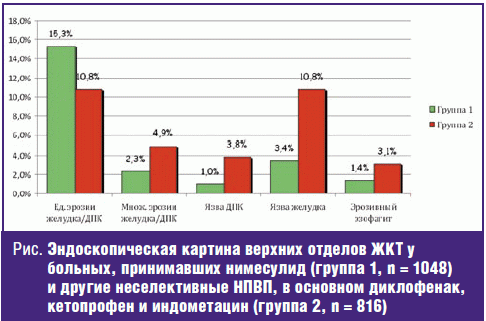
При этом наибольшее число язв у пациентов группы 2 было отмечено у тех, кто получал индометацин, кетопрофен и диклофенак — 24,6%, 15,4% и 15,0% соответственно. Эта патология существенно реже обнаруживалась на фоне приема ибупрофена — 6,7% и ацеклофенака — 3,6%. Также одна язва была выявлена у больной, использовавшей пироксикам (среди обследованных нами лиц этот препарат принимали всего трое).
Мы провели анализ влияния основных факторов риска НПВП-гастропатии — язвенного анамнеза, приема НДА и пожилого возраста (> 65 лет) на частоту язв желудка и/или ДПК.
Оказалось, что язвы значительно чаще выявлялись у лиц, имевших язвенный анамнез. Так, в группе 1 у больных с этим фактором риска суммарная частота язв желудка и/или ДПК оказалась 11,5%, без — 3,1% (р < 0,001). Аналогичная ситуация отмечалась в контрольной группе: 10,5% и 37,5% соответственно (р < 0,001).
Прием Аспирина значительно повышал риск развития язв — в группе 1 их частота составила для принимавших НДА 16,7%, не принимавших — 3,6% (р < 0,001). В группе 2 была отмечена такая же закономерность: язвы были выявлены у 25,0% принимавших и 14,3% не принимавших НДА (р = 0,002).
Пожилой возраст также ассоциировался с большей частотой выявления язв, но только у больных в группе 1. Так, у пациентов > 65 лет, принимавших нимесулид, частота язв составила 9,9%, более молодого возраста — 3,5% (р < 0,001). При этом в контрольной группе данная закономерность не прослеживалась: частота язв составила 14,8% и 14,3% соответственно.
Прием ГК и бисфосфонатов не влиял на частоту язв. Так, в группе 1 у больных, получавших ГК, язвы были выявлены у 4,1%; у не принимавших — 4,6% (р = 0,742). У принимавших и не принимавших бисфосфонаты частота язв составила 6,6% и 4,3% (р = 0,487). Такие же результаты были получены в группе 2: 16,7% и 13,9% (р = 0,214) для ГК и 11,8% и 14,6% (р = 0,605) для бисфосфонатов.
Следует отметить, что у больных, не имевших основных факторов риска (язвенного анамнеза, приема НДА и возраста > 65 лет) частота язв была намного ниже, чем в целом по группе. Тем не менее, язвы существенно чаще выявлялись в группе 2. Так, в группе 1 у 752 больных без факторов риска язвы были выявлены лишь у 16 (2,1%), а в контрольной группе — у 48 из 568 (8,5%), р < 0,001.
Мы провели анализ влияния гастропротективной терапии (регулярного приема ИПП) на частоту язв. Любопытно, но прием этих препаратов ассоциировался с более частым выявлением патологии ЖКТ. Причем если в группе 1 различие было недостоверным — частота язв составила 5,7% для получавших ИПП и 4,3% для не принимавших эти препараты (р = 0,228), то в группе 2 очень существенным — 33,3% и 12,2% соответственно, р < 0,001. С другой стороны, следует учесть, что ИПП значительно чаще использовались у пациентов, имевших те или иные факторы риска НПВП-гастропатии (язвенный анамнез, прием НДА и возраст > 65 лет). Так, применение ИПП было отмечено у 16,2% больных из группы 1, имевших вышеуказанные факторы риска, и лишь у 5,3% не имевших; аналогично, в группе 2 эти препараты получали 26,2% и 5,6%.
Отдельным объектом нашего анализа стала оценка частоты патологии пищевода. Эрозивный эзофагит был выявлен лишь у небольшого числа больных (в сравнении с патологией желудка и ДПК). Тем не менее, эрозивный эзофагит достоверно реже выявлялся у пациентов в группе 1 — у 15 (1,4%), в сравнении с 26 (3,1%) в группе 2, р = 0,03.
Такие факторы риска, как пожилой возраст и ГК, не ассоциировались с более высокой частотой патологии пищевода ни в группе 1, ни в группе 2. В то же время эрозивный эзофагит достоверно чаще выявлялся у пациентов в группе 2, получавших НДА (но не в группе 1). Прием бисфосфонатов оказался однозначно важным фактором риска — и в группе 1, и группе 2, при использовании этих препаратов эрозивный эзофагит определялся достоверно чаще (p < 0,05).
Обсуждение результатов
Как видно, серьезные изменения верхних отделов ЖКТ значительно реже возникали у больных РЗ, регулярно принимавших нимесулид, в сравнении с больными, которые использовали другие неселективные НПВП. Этот факт может рассматриваться как дополнительное подтверждение хорошей переносимости нимесулида. На фоне приема диклофенака, кетопрофена и индометацина язвы желудка и/или ДПК отмечались более чем в 3 раза чаще. При этом следует учесть, что риск развития НПВП-гастропатии у пациентов, получавших нимесулид, был выше, чем в контрольной группе: у большего числа из них отмечался язвенный анамнез, они чаще использовали НДА и реже получали эффективные гастропротекторы (ИПП). Такая ситуация, по всей вероятности, связана с тем, что лечащие врачи воспринимали нимесулид как более безопасный препарат, чем другие НПВП.
Конечно, говоря о риске НПВП-ассоциированных осложнений со стороны ЖКТ, прежде всего нужно учитывать возможность развития угрожающей жизни патологии — кровотечения и перфорации. Тем не менее, появление на фоне приема НПВП язвы желудка или ДПК (в т. ч. бессимптомных) традиционно рассматривается как наиболее важный «суррогатный маркер» опасных осложнений. На это указывает, в частности, известный британский исследователь A. Moore в своих работах, посвященных этому вопросу [10, 11].
Действительно, по современным представлениям развитие НПВП-индуцированной язвы определяется тем же патогенетическим механизмом (пептическим повреждением на фоне значительного снижения защитного потенциала слизистой, связанной со снижением продукции простагландинов), как и развитие кровотечения [10, 11]. Более того, хорошо известно, что основным источником кровотечения из верхних отделов ЖКТ являются именно язвы [12–14]. При этом риск развития язвы и кровотечения четко связан с общими факторами риска: пожилым возрастом, язвенным анамнезом и сопутствующим приемом лекарств, снижающих свертывание крови (низкие дозы Аспирина и др.) [12–14].
Следует отметить, что бессимптомные язвы возникают на фоне приема НПВП достаточно часто. По данным ряда клинических испытаний, при использовании неселективных НПВП их частота может достигать 15–25% [15, 16]. Однако мы диагностировали язвы у больных, которые были направлены для проведения ЭГДС в связи с наличием конкретных показаний — симптомов, указывающих на возможность поражения ЖКТ, или явных факторов риска. Поэтому выявленная нами патология представляется более серьезной, чем «бессимптомные» язвы, определяемые при тотальном эндоскопическом контроле в научных исследованиях.
Полученные нами данные подтверждают результаты российских ученых, изучавших вопрос безопасности нимесулида. Ранее нами был представлен обзор 21 отечественного исследования, носившего открытый характер (n = 2116), в которых эффективность и переносимость нимесулида сравнивались с другими НПВП, парацетамолом, трамадолом и гомеопатическим препаратом. Суммарно число ЖКТ-осложнений при использовании нимесулида оказалось значительно меньшим, чем на фоне приема других лекарств: диспепсия развилась у 9,1% и 10,8%; язвы желудка и/или ДПК у 1,6% и 10,6% (p < 0,001); отмена терапии из-за осложнений потребовалась у 1,4% и 2,5% пациентов (p < 0,05) [17].
Хорошо организованных исследований безопасности нимесулида, основанных на эндоскопическом контроле, немного [7, 18, 19]. Среди них следует выделить сравнение нимесулида 200 мг/сут и напроксена 1000 мг/сут, проведенное у 71 добровольца. Через 30 дней приема этих препаратов в группе нимесулида был отмечен лишь один случай развития множественных эрозий. В то же время в контрольной группе множественные эрозии развились у 44%, а язвы — у 16% [19].
Как было отмечено выше, принципиальное значение для оценки безопасности НПВП имеет риск развития опасных осложнений — прежде всего ЖКТ-кровотечения. Одним из методов изучения этого параметра являются популяционные исследования по типу случай-контроль.
Нужно сказать, что в отношении нимесулида подобные работы показывают неоднозначные результаты. Так, в масштабном исследовании финских ученых (анализ 9191 эпизода ЖКТ-кровотечений и язв) нимесулид демонстрировал достаточно высокий риск осложнений: отношение шансов (ОШ) 4,0; для диклофенака — 3,7 [20].
Иные результаты были показаны в работе итальянских ученых J. Laporte и соавт., сравнивших использование НПВП у 2813 больных, имевших эпизод ЖКТ-кровотечения, и 7193 лиц без этого осложнения в качестве контроля. Нимесулид оказался более безопасен, чем многие другие НПВП: ОШ для него составило 3,2, для диклофенака 3,7, мелоксикама 5,7, а рофекоксиба 7,2 [21].
В пользу нимесулида говорят данные более поздней работы, выполненной J. Castellsague и соавт. Авторы оценили риск серьезных ЖКТ-осложнений в одной из областей Италии, где было зафиксировано 588 827 пациентов, принимавших НПВП, и за период 2001–2008 гг. был отмечен 3031 эпизод развития ЖКТ-кровотечения или клинически выраженной язвы. Нимесулид демонстрировал низкий риск этих осложнений, соответствующий аналогичному показателю для селективных НПВП целекоксиба и рофекоксиба [22].
Наше исследование еще раз подтверждает принципиальное значение учета факторов риска перед назначением НПВП [23]. Согласно полученным данным, большинство случаев развития язв желудка и/или ДПК отмечалось у лиц пожилого возраста, при наличии язвенного анамнеза или на фоне сопутствующего приема НДА. Частота язв у лиц, имеющих любой из трех указанных выше факторов риска, в 3–5 раз превышала аналогичную частоту у пациентов, не имевших ни одного из них. Причем эта закономерность прослеживалась как при использовании нимесулида, так и препаратов контроля.
Интересным и относительно малоизученным вопросом безопасности НПВП является оценка их сравнительного влияния на пищевод [24, 25]. Хорошо известно, что прием этих препаратов повышает риск развития эрозивного эзофагита, кровотечения и пептической стриктуры, особенно при наличии гастроэзофагеальной рефлюксной болезни [26–28]. Однако до настоящего времени неясно, обладают ли селективные НПВП лучшей переносимостью в отношении пищевода [29]. Так, по данным исследования MEDAL (18-месячное сравнение эторикоксиба и диклофенака, n = 34 701), эторикоксиб, наиболее селективный НПВП, не демонстрировал преимущества по этому показателю в сравнении с препаратом контроля. Частота отмен терапии из-за проблем, связанных с пищеводом, практически не различалась и составила 0,38 и 0,41/100 пациентов-лет соответственно (р = 0,718) [30].
Наши данные показали меньшую частоту эрозивного эзофагита у больных, получавших нимесулид. Однако относительно небольшое число наблюдений не позволяет делать серьезные выводы о преимуществе нимесулида, в сравнении с другими неселективными НПВП, в отношении риска развития патологии пищевода. Требуются дальнейшие исследования для изучения этого вопроса.
Литература
- Насонов Е. Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные // Русский медицинский журнал. 2001, № 15, 6–8.
- Чичасова Н. В., Имаметдинова Г. Р., Иголкина Е. В., Насонов Е. Л. Найз в лечении хронических заболеваний суставов // Русский медицинский журнал. 2013, № 23, 1177–1185.
- Барскова В. Г. Что нам дает изучение статистики продаж нестероидных противовоспалительных препаратов в Российской Федерации? // Совр. ревматол. 2011; 3: 68–74.
- Mattia C., Ciarcia S., Muhindo A., Coluzzi F. Nimesulide: 25 years later // Minerva Med. 2010, 101 (4): 285–293.
- Crofford L. Use of NSAIDs in treating patients with arthritis // Arthritis Res Ther. 2013; 15, Suppl 3: S2. doi: 10.1186/ar4174. Epub 2013 Jul 24.
- Lanas A., Garcia-Tell G., Armada B., Oteo-Alvaro A. Prescription patterns and appropriateness of NSAID therapy according to gastrointestinal risk and cardiovascular history in patients with diagnoses of osteoarthritis // BMC Medicine. 2011, 9: 38. doi: 10.1186/1741–7015–9-38.
- Rainsford K. Nimesulide — a multifactorial approach to inflammation and pain: scientific and clinical consensus // Curr Med Res Opin. 2006, 22 (6), 1161–1170.
- Huskisson E., Macciocchi A., Rahlfs V. et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study // Curr Ther Res. 1999, 60, 253–265.
- Kriegel W., Korff K., Ehrlich J. et al. Double-blind study comparing the long-term efficacy of the COX-2 inhibitor nimesulide and naproxen in patients with osteoarthritis // Int J Clin Pract. 2001, 55 (8): 510–514.
- Moore R. A. Endoscopic ulcers as a surrogate marker of NSAID-induced mucosal damage // Arthritis Research & Therapy. 2013, 15 (Suppl 3): S4. doi:10.1186/ar4176.
- Moore A., Bjarnason I., Cryer B. et al. Evidence for endoscopic ulcers as meaningful surrogate endpoint for clinically significant upper gastrointestinal harm // Clin Gastroenterol Hepatol. 2009, Nov; 7 (11): 1156–1163. doi: 10.1016/j.cgh.2009.03.032. Epub 2009 Apr 9.
- Гельфанд Б. Р., Проценко Д. Н., Бабаянц А. В., Каратеев А. Е. Острые кровотечения из верхних отделов желудочно-кишечного тракта: от эпидемиологии до формирования концепции консервативной терапии // Инфекции в хирургии. 2013, № 4, 11–17.
- Brooks J., Warburton R., Beales I. Prevention of upper gastrointestinal haemorrhage: current controversies and clinical guidance // Ther Adv Chronic Dis. 2013, Sep; 4 (5): 206–222. doi: 10.1177/2040622313492188.
- Laine L., Curtis S., Cryer B. et al. Risk factors for NSAID-associated upper GI clinical events in a long-term prospective study of 34 701 arthritis patients // Aliment Pharmacol Ther. 2010, Nov; 32 (10): 1240–1248. doi: 10.1111/j.1365–2036.2010.04465.x. Epub 2010 Sep 23.
- Emery P., Zeidler H., Kvien T. et al. Celecoxib versus diclofenac in long-term management of rheumatoid arthritis: randomized double-blind comparison // Lancet. 1999; 354: 2106–2111.
- Hunt R., Harper S., Watson D. et al. The gastrointestinal safety of the COX-2 selective inhibitor etoricoxib assessed by both endoscopy and analysis of upper gastrointestinal events // Am J Gastroenterol. 2003, 98 (8): 1725–1733.
- Каратеев А. Е. Российский опыт применения нимесулида: обзор клинических испытаний // Consilium medicum. 2011, 13 (9), 89–95.
- Porto A., Almeida H., Cunha M., Macciocchi A. Double-blind study evaluating by endoscopy the tolerability of nimesulide and diclofenac on the gastric mucosa in osteoarthritic patients // Eur J Rheumatol Inflamm. 1994; 14 (4): 33–38.
- Bjarnason I., Thjodleifsson B. Gastrointestinal toxicity of non-steroidal anti-inflammatory drugs: the effect of nimesulide compared with naproxen on the human gastrointestinal tract // Rheumatology (Oxford). 1999. May; 38, Suppl 1: 24–32.
- Helin-Salmivaara A., Saarelainen S., Gronroos J. et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population // Scan J Gastroenterol. 2007; 42: 923–932.
- Laporte J., Ibanez L., Vidal X. et al. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents // Drug Safety. 2004, 27, 411–420.
- Castellsague J., Pisa F., Rosolen V. et al. Risk of upper gastrointestinal complications in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy // Pharmacoepidemiol Drug Saf. 2013. Apr; 22 (4): 365–75. doi: 10.1002/pds.3385.
- Burmester G., Lanas A., Biasucci L. et al. The appropriate use of non-steroidal anti-inflammatory drugs in rheumatic disease: opinions of a multidisciplinary European expert panel // Ann Rheum Dis. 2011, 70 (5): 818–822.
- Parfitt J., Driman D. Pathological effects of drugs on the gastrointestinal tract: a review // Hum Pathol. 2007 Apr; 38 (4): 527–536.
- Abitbol V., Chaussade S. Are dyspepsia or gastroesophageal reflux predictive of serious digestive events during treatment with NSAIDs? How should they be treated? // Presse Med. 2003, 32, 53–55.
- Yasuda H., Yamada M., Endo Y., Inoue K., Yoshiba M. Acute necrotizing esophagitis: role of nonsteroidal anti-inflammatory drugs // J Gastroenterol. 2006, 41, 193–197.
- Avidan B., Sonnenberg A., Schnell T., Sontag S. Risk factors for erosive reflux esophagitis: a case-control study // Am J Gastroenterol. 2001, 96, 41–46.
- Avidan B., Sonnenberg A., Schnell T. et al. Risk factors of oesophagitis in arthritic patients // Eur J Gastroenterol Hepatol. 2001, 13, 1095–1099.
- Mantry P., Shah A., Sundaram U. Celecoxib associated esophagitis: review of gastrointestinal side effects from cox-2 inhibitors // J Clin Gastroenterol. 2003, 37, 61–63.
- Laine L., Curtis S., Cryer B. et al. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the multinational etoricoxib and diclofenac arthritis long-term (MEDAL) programme: a randomized comparison // Lancet. 2007, 369, 465–473.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru