Сравнительная эффективность влагалищного и ректального применения цитокинотерапии у беременных с дисплазией шейки матки
Содержание статьи
Введение
Дисплазия шейки матки — это патологический процесс, в основе развития которого лежит длительное персистирование вируса папилломы человека (ВПЧ), приводящее к нарушению пролиферации клеток и развитию ядерной атипии [1, 2]. Среди пациенток молодого возраста распространенность вирусной инфекции крайне высока, однако возможна спонтанная элиминация вируса. Обладая слабой иммуногенностью, ВПЧ не вызывает развития стойкого пожизненного иммунитета. В связи с этим возможно повторное заражение ВПЧ или сосуществование нескольких типов вируса [3, 4]. Решающим аспектом в прогнозе исходов вирусной инфекции является состояние местного иммунитета слизистых. Во время беременности в связи с физиологическим иммунодефицитом вероятна активация вирусной инфекции и манифестирование связанных с ней заболеваний [5–7].
Дисплазия шейки матки диагностируется в 13 случаях на 10 000 беременностей. По современным рекомендациям тактика ведения таких пациенток активно-выжидательная [8, 9]. Это связано с доказанной низкой скоростью прогрессирования патологического процесса и высокой вероятностью его спонтанного регресса [10]. Риск прогрессирования тяжелой дисплазии до микроинвазивного рака во время беременности не превышает 1,1–3,6% [11].
Важным звеном защиты организма от внедрения вирусной инфекции является врожденный иммунитет [12]. Врожденная иммунная система распознает вирусы и бактерии через рецепторы распознавания образов (pattern recognition receptors — PRR), специфичных для молекулярных компонентов микроорганизмов [13]. Первым этапом взаимодействия вируса с клеткой является контакт с поверхностными Toll-подобными рецепторами (Toll like receptors — TLR). TLR представляют собой трансмембранные PRR, которые обнаруживаются как на поверхности, так и внутри клеток (в моноцитах, макрофагах, эпителиальных клетках и нейтрофилах, дендритных клетках). TLR распознают множество патоген-ассоциированных молекулярных фрагментов (Pathogen associated molecular patterns — PAMP), включая микробные компоненты клеточной стенки, белки и нуклеиновые кислоты. Передача сигналов TLR приводит к изменениям транскрипционных факторов, которые регулируют множество генов, в т. ч. кодирующих важные провоспалительные цитокины и интерферон [14, 15].
Ранее проведенные исследования показали, что использование терапии препаратом Суперлимф позволяет повысить экспрессию TLR и усилить противовирусную резистентность организма [15]. Однако представленные работы касались влагалищного применения лекарственных средств. Нас заинтересовало, можно ли оказать системное воздействие на организм и повысить напряженность факторов врожденного иммунитета не только во влагалищном биотопе. При ректальном введении лекарственных препаратов системное действие может быть оценено на основании изменений, выявленных в слизистых других локализаций, например в ротовой полости или во влагалище [15].
Целью нашего исследования явилась оценка эффективности влагалищного и ректального способа проведения цитокинотерапии у беременных с дисплазией шейки матки.
Материал и методы
Было проведено проспективное исследование, включившее 50 женщин с дисплазией шейки матки. В основную группу были включены 30 беременных, которым терапия проводилась интравагинально, в группу сравнения — 20 пациенток, которые вводили препарат ректально. С лечебной целью назначался препарат Суперлимф по 1 свече (25 ЕД) в течение 20 дней.
Препарат Суперлимф представляет собой комплекс природных противомикробных пептидов и цитокинов с активностью фактора, угнетающего миграцию макрофагов, интерлейкина-1, интерлейкина-6, фактора некроза опухоли (tumor necrosis factor — TNF), трансформирующего фактора роста. Согласно инструкции препарат обладает иммуномодулирующим, противовирусным и противомикробным эффектом, стимулируя активность моноцитов и нейтрофилов.
Критерии включения в исследование:
Умеренная дисплазия шейки матки (по данным цитологического и гистологического исследований).
Наличие ВПЧ группы высокого онкогенного риска.
Отсутствие специфического и неспецифического вагинита.
Физиологическое течение беременности.
Отсутствие соматической и аутоиммунной патологии.
Подписанное информированное согласие на участие в исследовании.
Отсутствие аллергии к белкам свиного происхождения.
9 женщин (30%) основной группы были в I триместре беременности, 11 (36,6%) — во II триместре, 10 (33,3%) — в III триместре. Срок беременности пациенток группы сравнения был 14–18 нед. (10 человек) и 28–33 нед. (10 человек).
В объем обследования пациенток обеих групп входило цитологическое исследование соскобов с экзо- и эндоцервикса (метод жидкостной цитологии NovaPrep), качественное и количественное определение ВПЧ (метод DIGENE-test), исследование показателей врожденного иммунитета. Тесты проводились на этапе включения в исследование и через 20 дней после лечения препаратом Суперлимф.
Изучение факторов врожденного иммунитета включало определение экспрессии генов TLR-9, TLR-2, HBD-1 (дефенсин) и TNF-α в эпителиальных клетках цервикального канала и многослойного плоского эпителия влагалища. Для забора материала были использованы цитощетки (тип D1) для эндоцервикса и стерильный гинекологический зонд (тип А) для влагалища. Зонды помещались в эпендорф со средой и замораживались при температуре -20 °С. Исследование проводилось на кафедре иммунологии медико-биологического факультета РНИМУ им. Н.И. Пирогова. После размораживания в каждую пробирку вносили по 450 мкл лизирующего раствора и 100 мкл суспензии клеток, пробы перемешивали на вортексе, трехкратно центрифугировали, отмывали раствором, подсушивали. В пробирки добавляли по 50 мкл РНК-буфера, выдерживали в термостате, вортексировали, центрифугировали и получали супернатант с очищенной РНК. Реакцию обратной транскрипции проводили в объеме 25 мкл. Реакционная смесь содержала 3 мкл РНК-матрицы, 1 мкл random («Синтол», Россия) и 9 мкл дважды дистиллированной H2O. Смесь инкубировали при температуре 75 °С в течение 5 мин, далее пробирки охлаждали до 4 °С. После добавляли 10 мкл смеси, состоящей из 10 х ОТ буфер 3 мкл, 100 ед. ревертазы M-MLV («Синтол», Россия). Смесь инкубировали в течение 1 ч при 37 °С. Инактивацию проводили при 92 °С в течение 10 мин. Полученную комплементарную ДНК (кДНК) хранили при -70 °С.
Статистическая обработка результатов проводилась с использованием программного обеспечения Microsoft Excel 2016 и Statistica 6.1. Сравнение показателей до и после лечения проводилось с использованием критерия Вилкоксона. Результаты считались достоверными при уровне вероятности ошибки p<0,01.
Результаты исследования
Возраст пациенток в основной группе был в пределах от 20 до 37 лет (30,4±1,5), в группе сравнения — от 22 до 36 лет (29,8±1,4). Среди пациенток большинство были повторнобеременными и повторнородящими (основная группа — 83,3%, группа сравнения — 90%).
Согласно критериям включения у всех пациенток была подтверждена умеренная дисплазия шейки матки (lowgrade squamous intraepitelial lesions — LSIL), в 100% случаев обнаружен ВПЧ группы высокого онкогенного риска. Среди типов вируса преобладали представители группы А9 (16, 31, 33 типы): в 83,3% случаев в основной группе и в 55% в группе сравнения. ВПЧ 51 и 56 типов выявлялись у 10% и 35% пациенток, а группы А7 (18 тип) — у 5,6% и 10% беременных.
До начала терапии ВПЧ группы А9 в основной группе и в группе сравнения составлял 5,6±1,2 и 5,3±0,5 Lg ДНК на 105 клеток, через 20 дней терапии он достоверно снижался до 4,3±0,2 и 4,6±0,6 Lg ДНК на 105 клеток. Для ВПЧ группы А7 до начала терапии нагрузка составляла 4,9±1,6 и 4,6±1,2 Lg ДНК на 105 клеток, через 20 дней — 2,7±0,9 и 3,3±0,6 Lg ДНК на 105 клеток.
Титр ВПЧ группы А5/А6 достоверно не менялся после терапии и составил 4,8±1,3 и 6,8±0,7 Lg ДНК на 105 клеток (до лечения) и 4,4±0,7 и 6,2±0,9 Lg ДНК на 105 клеток (после лечения).
Анализ изменения титров в зависимости от способа введения лекарственного средства показал, что влагалищное введение препарата приводило к снижению вирусной нагрузки для ВПЧ группы А9 в 1,3 раза, ВПЧ группы А7 — в 1,8 раза. При ректальном применении препарата достоверные колебания были выявлены только для ВПЧ группы А7 и проявлялись снижением титра вируса в 1,4 раза.
Среди компонентов врожденного иммунитета мы изучали экспрессию генов TLR-9, TLR-2, TNF-α и противомикробного пептида HBD-1. Результаты представлены в таблице 1.
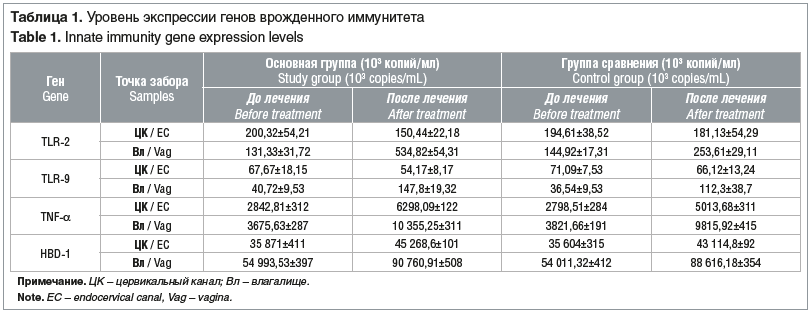
Анализ полученных результатов показал, что экзогенная цитокинотерапия оказывает модулирующее влияние на активность врожденного иммунитета вне зависимости от способа введения лекарства.
При влагалищном введении препарата отмечалось снижение уровня экспрессии генов TLR-2 и TLR-9 в клетках цервикального канала параллельно с 4- и 3,5-кратным увеличением ее во влагалище. Наиболее значимые изменения обнаружены в продукции TNF-α (его уровень возрастал в 2,5 раза в цервикальном канале и во влагалище) и дефенсина (увеличение экспрессии в эпителии цервикального канала в 1,5 раза, во влагалище — в 2 раза).
При ректальном введении препарата Суперлимф были получены сопоставимые с основной группой результаты. Однако степень увеличения экспрессии факторов врожденного иммунитета была меньше. Мы обнаружили, что образование TLR-2 и TLR-9 в цервикальном канале практически не меняется, а в эпителии влагалища возрастает в 1,75 и в 3 раза соответственно (p≤0,01). Экспрессия TNF-α и дефенсина значительно возрастает во всех исследуемых образцах. Уровень экспрессии гена TNF-α после проведения ректальной цитокинотерапии увеличивался в клетках цервикального канала в 1,8 раза, а во влагалищном эпителии — в 2,6 раза. Продукция HBD-1 повышалась в 1,2 и 1,6 раза соответственно (p≤0,01).
Заключение
Эффективность проведения цитокинотерапии была доказана ранее во многих исследованиях [7]. Целью настоящего исследования стало cравнение эффективности влагалищного и ректального способа введения лекарственного средства. В качестве критериев эффективности лечения мы использовали уровень вирусной репликации и показатели экспрессии генов факторов врожденного иммунитета.
При влагалищном применении Суперлимфа отмечено снижение вирусной нагрузки для ВПЧ группы А9 в 1,3 раза и ВПЧ группы А7 — в 1,8 раза. При ректальном применении достоверно снижался титр только ВПЧ группы А7 (в 1,4 раза). Таким образом, влагалищный способ применения препарата является предпочтительным.
Мы обнаружили, что вне зависимости от способа введения препарата цитокинотерапия повышает экспрессию генов факторов врожденного иммунитета, однако эти изменения более значимы при влагалищном пути применения Суперлимфа.
После влагалищного введения препарата в эпителиальных клетках влагалища экспрессия генов распознающих рецепторов TLR-2 и TLR-9 увеличивалась в 4 и 3,5 раза, а после ректального введения — в 1,75 и 3 раза соответственно.
Наиболее значимые изменения касались увеличения экспрессии генов TNF-α и дефенсина. При вагинальном лечении она возрастала в 2,5 и 2 раза, а при ректальном — в 2,6 и 1,6 раза соответственно.
Таким образом, влагалищный путь введения препарата Суперлимф обладает более выраженным терапевтическим эффектом, проявляющимся в повышении экспрессии факторов врожденного иммунитета в эпителии половых путей и более значимом снижении вирусной нагрузки.
Благодарность/Acknowledgment
Выражаем благодарность д.м.н., профессору Юлии Эдуардовне Доброхотовой за помощь и участие на всех этапах написания статьи.
Сведения об авторах:
1Боровкова Екатерина Игоревна — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0001-7140-262X;
1Залесская Софья Алексеевна — ассистент кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0000-0003-2881-0788;
2Степанянц Ирина Викторовна — врач акушер-гинеколог КДО, ORCID iD 0000-0003-4629-3323.
1ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
2ГБУЗ «ГКБ № 40 ДЗМ». 129336, Россия, г. Москва, ул. Таймырская, д. 6.
Контактная информация: Боровкова Екатерина Игоревна, e-mail: katyanikitina@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 12.07.2019.
About the authors:
1Ekaterina I. Borovkova — MD, PhD, Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0001-7140-262X;
1Sofia A. Zalesskaya — MD, Assistant of the Department of Obstetrics and Gynecology, ORCID iD 0000-0003-2881-0788;
2Irina V. Stepanyants — MD, ORCID iD 0000-0003-4629-3323.
1Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation.
2City Clinical Hospital No. 40. 6, Taimyrskaya str., Moscow, 129336, Russian Federation.
Contact information: Ekaterina I. Borovkova, e-mail: katyanikitina@mail.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 12.07.2019.
Информация с rmj.ru






