В статье рассматриваются современные аспекты развития болезни Паркинсона в свете последних научных данных о механизмах, являющихся триггерными при наличии соответствующих факторов генетической предрасположенности.
Болезнь Паркинсона (БП) — второе по распространенности нейродегенеративное заболевание в мире после болезни Альцгеймера (БА). По данным ВОЗ, в мире более 4 млн человек страдают БП, причем прогнозируется рост заболеваемости: если в 2005 г. число больных БП в возрасте старше 50 лет составляло 4,1–4,6 млн, то к 2030 г. их количество удвоится и достигнет 8,7–9,3 млн [1]. По эпидемиологическим показателям сплошных исследований можно примерно оценить общую численность больных БП по России приблизительно в 210 тыс. человек [2]. Согласно данным о мировой заболеваемости БП, на 1000 населения приходится 1–2 случая, причем наиболее часто в старших возрастных группах [3]. В этом аспекте рост общей продолжительности жизни в мире, а также по-прежнему спорные вопросы патогенеза БП заставили многих авторов в 2012–2017 гг. заняться проблематикой изучения этиологии данного заболевания.
Согласно современным представлениям ведущая роль в развитии нейродегенеративного процесса при БП отводится пресинаптическому белку α-синуклеину (α-syn). В нормальных условиях α-syn представлен в клетке в виде тетрамера [4], предположительно участвующего в процессах везикулярного транспорта и регуляции дофаминергической трансмиссии. Данный белок широко экспрессируется в различных отделах центральной нервной системы (ЦНС) и составляет около 1% всей массы мозга, однако точно его физиологические функции остаются неизвестными [5]. Показано, что в норме α-syn может выполнять функцию белка-шаперона [6], регулируя процесс взаимодействий белок — белок и белок — липид. Это в какой-то степени подтверждается исследованиями Emamzadeh, который в своей работе [7] показал зависимость аффинности связывания α-syn с липопротеидами мембран от соотношения липопротеиды/белок. В том же исследовании Emamzadeh на основе своих наблюдений и исследований других авторов выделил и систематизировал функции α-syn (табл. 1) [7].
До сих пор неясными остаются причины повышения агрегация α-syn. Имеющиеся на настоящий момент теории о генетической предрасположенности к данному процессу объясняют лишь семейные формы БП и мало затрагивают спорадические формы.
Велико влияние генетического полиморфизма на развитие БП. Поскльку, на наш взгляд, текущие исследования не затрагивают в полной мере влияния других факторов на развитие БП, то на сегодняшний день приходится говорить о практически полной генетической детерминированности БП.
При этом накоплено немало данных, рассматривающих механизмы развития БП как совокупность генетических, иммунных, средовых и метаболических факторов, приводящих в конечном итоге к развитию доклинической формы
БП и дальнейшему ее прогрессированию с появлением клинической симптоматики. Важно отметить, что α-syn, помимо своего классического токсического действия, которое он оказывает на нервные клетки, обладает еще и влиянием на метаболизм дофамина (DA) [6, 7], а также на метаболизм гамма-аминомасляной кислоты (ГАМК), участвуя в регуляции процессов ее высвобождения из синаптических везикул. По данным последних исследований, сама ГАМК является регулятором процессов высвобождения α-syn из синаптических везикул, в которых она связана C-концевым фрагментом с их липидной мембраной [8]. Активация каналов SUR1-
, расположенных на мембране ГАМК-ергических нейронов, вызывает гиперполяризацию мембраны и снижение выброса ГАМК. Локально более низкие уровни ГАМК уменьшают активацию рецепторов ГАМКB на соседних глутаматергических нервных окончаниях. В результате ингибирование окружающих каналов Ca
прекращается, и повышение содержания внутриклеточного Ca
вызывает выброс α-syn (рис. 1а). Закрытие каналов SUR1-
приводит к деполяризации мембраны и увеличению высвобождения ГАМК. Повышенные уровни ГАМК вызывают повышенную активацию ГАМКB-рецепторов в глутаматергических терминалах, ингибируя окружающие каналы Ca2+ и, таким образом, уменьшая высвобождение α-syn [10] (рис. 1б).
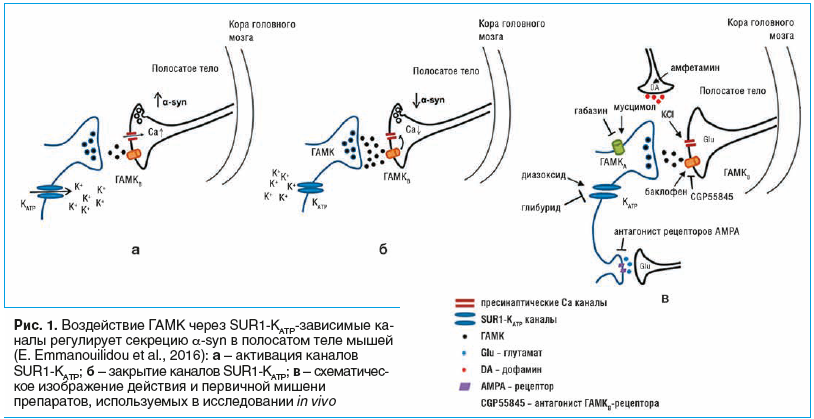
Важно подчеркнуть, что исследователи в последнее время все чаще говорят о БП не только как о нейродегенеративном, но и как о хроническом нейровоспалительном заболевании. Данная гипотеза не только укладывается в первичную роль генетического детерминизма БП, но и связывает патогенез БП с другими нейродегенеративными заболеваниями, такими как деменция с тельцами Леви, болезнь Альцгеймера и рассеянный склероз, открывая перспективу создания осмысленной концепции БП как мультифакторного заболевания. При этом нейровоспаление может являться связующим звеном в цепочке взаимодействия комплекса экзо- и эндогенных факторов, влияющих на развитие и патогенез БП. Данный обзор литературы максимально систематизирует новые аспекты патогенеза БП, обнаруженные при изучении метаболических и гистологических изменений, происходящих в организме пациентов при БП.
Содержание статьи
- 1 Аспекты метаболизма α-syn в нейронах головного мозга
- 2 Прионная гипотеза
- 3 БП и ось «кишечник — мозг»: роль микробиоты кишечника в патогенезе заболевания
- 4 Морфологические и биохимические особенности тканей кишечника при БП
- 5 Гипоталамо-гипофизарно-надпочечниковая ось как один из возможных путей патогенеза БП
- 6 Нейровоспаление и БП
- 7 Заключение
Аспекты метаболизма α-syn в нейронах головного мозга
В норме α-syn связан с липидными мембранами клетки и участвует в везикулярном транспорте и хранении нейромедиаторов в нервной клетке [9, 10]. При этом сам α-syn является белком-шапероном, и в комплексе с белками SNARE (soluble N-ethylmaleimidesensitive-factor attachment protein receptor) участвует в высвобождении DA из нервных клеток [11]. Ранее считалось, что в его деградации в клетке участвует убиквинтин, однако последние исследования [12] показали, что в случае БП это может осуществляться напрямую протеосомами 19S и 20S, а убиквинтин присоединяется в последующем и участвует лишь в формировании телец Леви. Тем не менее убиквинтин-протеосомный компонент не является ведущим [13] и обычно включается лишь на более поздних этапах БП.
In vivo секреция α-syn может зависеть от перекрестного взаимодействия ГАМК-ергических нейронов с глутаматергическими терминалями [9]. Как видно из данного исследования, этот процесс является Ca2+-зависимым. Это достаточно важно, поскольку объясняет возрастные изменения, связанные с метаболизмом α-syn, входящие в гипотезу митохондриальной дисфункции как основы развития
БП [14, 15]. Эти же изменения митохондриального метаболзима являются материальным субстратом для некоторых наследственных форм БП, ассоциированных с мутантными формами PARK 1, 2, 5, 6, 7, 8, 9, 13.
DA может подвергаться самопроизвольному самоокислению, при нормальном внутриклеточном рН и при наличии молекулярного кислорода, в токсичные и реакционноспособные DA-хиноны, супероксидные свободные радикалы и перекись водорода [16]. Более того, супероксид может быть либо превращен в перекисные формы супероксиддисмутазами, либо в лабильные, но очень реакционноспособные и цитотоксические пероксинитритные радикалы в присутствии оксида азота. Следовательно, любые факторы, влияющие на синтез, хранение, высвобождение и повторный захват, будут иметь значение для увеличения концентрации цитоплазматического DA и уровень окислительного стресса в DA-нейронах. При этом важно подчеркнуть, что α-syn играет большую роль в метаболизме DA, затрагивая почти каждый его аспект, включая ингибирование транскрипции тирозингидроксилазы (TH) (вероятно, путем снижения активности гена Nurr1) [17], ингибирование активности TH посредством связывания с дефосфорилированной формой TH и поддержание TH в неактивной форме [18], инициирование транспортировки везикул путем взаимодействия нескольких белков (таких как тубулин, кальретикулин, SNARE-белки и т.д.) [19], регулирование рециркуляции везикул, хранение DA и высвобождение путем поддержания множества пресинаптических везикул в «резервных» или «покоящихся» пулах [20], снижение активности белка-переносчика дофамина (DAT) путем формирования стабильного комплекса с DAT [21]. Белок α-syn может помочь поддерживать гомеостаз обмена DA в нормальных условиях в DA-нейронах, сохраняя нейроны в здоровом состоянии; при этом, потеря его нормальных функций может привести к нарушению гомеостаза, что, в свою очередь, ведет к селективной дегенерации DA-нейронов в патологических состояниях [22].
Важнейшим фактором, влияющим на развитие БП, является способность поврежденных нейронов экспрессировать α-syn в виде экзосом, содержащих его в аггрегированном состоянии [22]. Таким образом, скорость развития данной патологии может нарастать экспоненциально, а α-syn при этом играет роль не только фактора агрессии, но и фактора развития патологии.
Ключевыми компонентами на ранних этапах БП являются: наследственные мутации, оксидативный стресс или митохондриальная дисфункция [23]; наличие хотя бы одного из трех компонентов может способствовать патологии метаболизма α-syn и развитию БП (рис. 2). При этом понятия «оксидативный стресс» и «митохондриальная дисфункция» можно включить в комплексное понятие «хроническое нейровоспаление», что на данный момент является ведущей теорией в патогенезе БП. Далее представлены наиболее актуальные на данный момент механизмы, объясняющие запуск этого процесса на уровне головного мозга.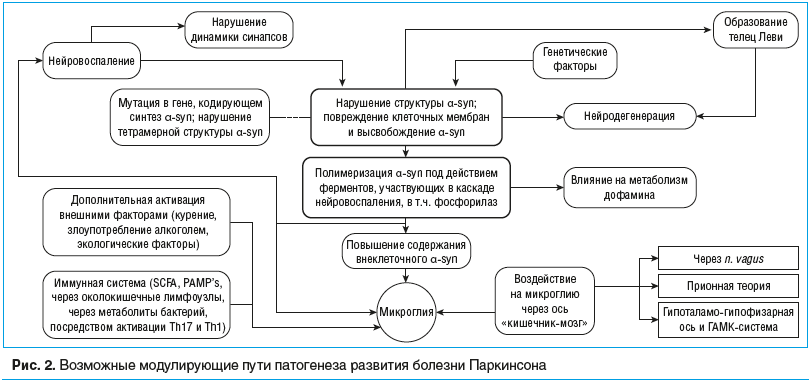
Прионная гипотеза
С одной стороны, дисрегуляция оси «кишечник — мозг» при БП может приводить к дисфункции кишечника, которая имеет место более чем у 80% пациентов с БП. С другой стороны, эта дисрегуляция может также вносить существенный вклад в патогенез самой БП. Еще в модели Braak et. al. в 2005 г. [24] говорилось о стадийности распространения аггрегатов α-syn в головном мозге.
Это предположение легло в основу прионной модели БП и объясняло, в частности, ранние ольфакторные нарушения у пациентов с доклинической стадией БП. Также были описаны механизмы межнейрональной передачи α-syn [8], что дополняет прионную гипотезу БП. Показано, что вагусные моторные аксоны и терминали в кишечнике являются α-syn-положительными и что некоторые из этих преганглионарных эфферентов заканчиваются на α-syn-положительных нейронах в Ауэрбаховых сплетениях желудка и двенадцатиперстной кишки при развитии БП [25]. Эти и дополнительные наблюдения помогают дополнить постулаты, включенные в модель Braak’а, предлагающую механизм развития и распространения нейропатии при БП [26].
БП и ось «кишечник — мозг»: роль микробиоты кишечника в патогенезе заболевания
Обнаружено, что у пациентов с БП отмечается снижение представительства типа Bacteroidetes и рода Prevotella в их стуле, что сопровождается снижением содержания короткоцепочечных жирных кислот (SCFA). В качестве симбиотических кишечных бактерий Prevotella участвуют в образовании слизи слизистой оболочки кишечника и продуцировании SCFA посредством ферментации пищевых волокон. Уменьшение абсолютного числа Prevotella вызывает уменьшение количества слизи в кишечнике и увеличение проницаемости стенки кишечника, повышение локальной и системной восприимчивости к воздействию бактериальных антигенов и эндотоксинов, тем самым вызывая экспрессию и неправильное расположение большого количества α-syn. Сами SCFA участвуют в метаболизме энтероцитов, при этом нарушение их баланса вызывает изменения со стороны последних, связанные, в частности, с повышением проницаемости. Воспалительные изменения, наблюдаемые у пациентов с БП и на моделях животных с БП, связаны с повышенной проницаемостью стенки кишечника [12].
Также показано, что микробиота с микроорганизмами, полученными от больных БП, способствует развитию двигательной дисфункции [13]. Показаны достоверные отличия между микрофлорой кишечника здоровых людей и больных БП [14].
Имеются данные, показывающие качественные и количественные изменения микробиоты кишечника у больных БП, коррелирующие, в частности, с продолжительностью заболевания (табл. 2) [27].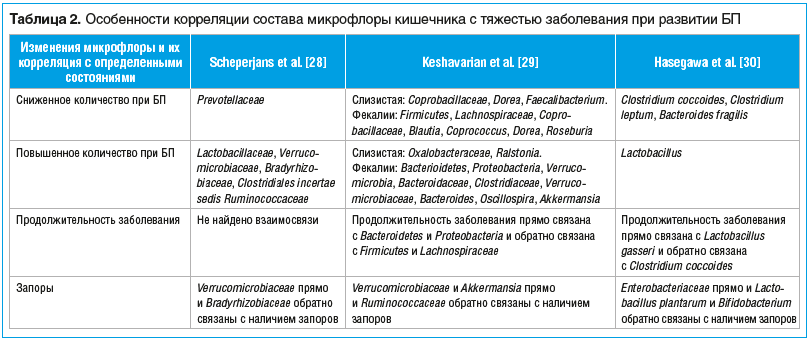
Наибольшее внимание современные исследователи уделяют бактериям Lactobacillaceae, Prevotellaceae и Bacteroidaceae. Показана корреляция между состоянием кишечной микрофлоры и стадией БП [31], что в будущем может дополнить прогностическую и терапевтическую модель заболевания. Однако, на наш взгляд, наибольшее внимание требуется уделять именно изменению содержания метаболитов бактерий как наиболее перспективному подходу в плане систематизации данных с исследовательской и прогностической целью.
В ходе исследований отечественных авторов выявлена взаимосвязь между такими клиническими характеристиками БП, как форма болезни, стадия, тяжесть моторных и немоторных проявлений и родовой состав микробиоты кишечника больных БП. Более половины (54,8%) микроорганизмов кишечника больных БП имеют ассоциации с теми или иными проявлениями заболевания. Несмотря на то, что причинно-следственные связи между изменениями в составе микробиоты кишечника и патогенезом БП не ясны до конца, вероятно, некоторые микроорганизмы могут являться предикторами менее благоприятного прогноза. Перспективным представляется исследование возможностей профилактики нейродегенеративных заболеваний, направленной в первую очередь на нормализацию таксономических соотношений и разнообразия микрофлоры кишечника в группах риска [32]. Тем не менее гетерогенность таксономических взаимосвязей при БП не позволяет говорить о роли какого-либо конкретного микроорганизма или группы микроорганизмов в развитии этого заболевания [33]. Куда больший интерес представляют метаболические последствия изменения нормальной микрофлоры кишечника. Keshavarzian в своей работе [29] представил метаболические изменения, связанные, в частности, с нарушением качественного соотношения биосинтетической активности микрофлоры кишечника у больных БП. На наш взгляд, изменения микрофлоры являются лишь последствием первичных изменений, происходящих в кишечнике, о которых будет сказано далее. Тем не менее и сами бактерии через свои метаболиты могут влиять на состояние стенки кишечника, поэтому данный вопрос до сих пор остается дискутабельным.
Морфологические и биохимические особенности тканей кишечника при БП
Многие свидетельства говорят о повышении проницаемости стенки кишечника [34], которое при этом коррелирует со стадией БП. В какой-то мере эти изменения может объяснить то, что пищевые волокна являются основным субстратом для синтеза короткоцепочечных жирных кислот, являющихся метаболитом для колоноцитов, в т.ч. бутирата. При этом сокращение содержания последнего может нарушить барьерную функцию вследствие нарушения обменных процессов в колоноцитах и способствовать воспалению. Тот факт, что при различных аутоиммунных заболеваниях, включая сахарный диабет 1-го и 2-го типа, синдром раздраженного кишечника, ревматоидный артрит и болезнь Бехчета, снижался уровень Prevotella, может указывать на снижение продукции SCFA (таких как пропионат), что, в свою очередь, благоприятствует воспалительным состояниям при БП и нарушению барьерной функции кишечника [35, 36]. Таким образом, мы считаем, что изменения кишечника, связанные с диетой пациента, влияют на течение доклинической стадии БП. При этом до сих пор остается непонятным соотношение моторных и гастроинтестинальных проявлений БП во времени. Так, описывается изменение функции кишечника у мышей с избыточным накоплением α-syn в сплетениях кишечника [37]. Важно также и понимание того, что кишечник и кишечная микробиота являются ведущим звеном в развитии и модулировании функционирования иммунной системы. В биоптатах толстого кишечника больных БП было повышено содержание матричной РНК по сравнению со здоровыми пациентами [38]. Возможно, эти цитокины, а также механизмы, запускаемые при активации воспаления в кишечнике, могут влиять на проницаемость гематоэнцефалического барьера, и на развитие «хронического» иммунного ответа в ЦНС в течение слабоактивного воспаления в кишечнике. Изменение содержание α-syn — еще одна характерная особенность кишечника больных БП. У них наблюдались достоверно более высокие уровни α-syn по сравнению с контрольной группой пациентов того же возраста [39–45].
Гипоталамо-гипофизарно-надпочечниковая ось как один из возможных путей патогенеза БП
Гипоталамо-гипофизарно-надпочечниковая ось является важнейшим звеном в формировании ответной реакции на стресс и во многом обусловливается выбросом кортикостероидов в кровь. Было показано, что гиперкортикостероидемия вызывает кишечный дисбиоз, в особенности это касается Clostridium и Bacteroides [46], и что при этом нарушается функция эпителия толстого кишечника [47], отчего в дальнейшем может усилиться дисбиоз и еще больше активироваться иммунный ответ в кишечнике [48–49]. Более того, непосредственно глюкокортикоиды могут модулировать иммунный ответ в ЦНС, приводя к нарушению адекватности ответа микроглии на антигенную стимуляцию [50]. При этом было показано, что дисбиоз может напрямую влиять на экспрессию рецепторов ГАМК в ЦНС [51], что также может служить фактором развития БП и укладывается в представленные выше сведения о роли рецепторов ГАМК в метаболизме α-syn.
Нейровоспаление и БП
Как известно, бактерии кишечника играют огромную роль в развитии и модулировании процессов иммунной системы. Были показаны механизмы молекулярной мимикрии некоторых бактерий кишечника, которые могут индуцировать воспаление в кишечнике и, далее, в ЦНС [52].
Дисбиоз и нарушение функции эпителия кишечника, связанные с нарушением питания или другими факторами, могут привести к распознаванию бактериального амилоида как патоген-ассоциированного молекулярного паттерна (PAMP) и к активации TLR2-рецепторов, TLR1-рецепторов и кластера дифференцировки 14 (CD14) [53–55]. Эти молекулы также экспрессируются на нейронах и могут активироваться тейхоевыми кислотами и бета-амилоидом (Aβ), что, на наш взгляд, может играть важную роль в развитии спорадических форм БП вследствие активации воспаления. Представляет интерес наблюдение, показывающее, что бактериальный амилоид распознается врожденной иммунной системой как PAMP и инициирует ответ, включающий TLR1 и TLR2, CD14, ядерный фактор «каппа-би» (NFkB) и индуцируемую NO-синтазу (iNOS). При этом активация iNOS вызывает отдельный интерес, поскольку α-syn в тельцах Леви содержится в качестве нитрифицированного фрагмента [46]. Кроме того, экспрессия CD14 в микроглиальных клетках участвует в клиренсе Aβ [55], а врожденная активация иммунной системы бактериальным амилоидом может изменить гомеостаз Aβ в головном мозге. Таким образом, взаимосвязь между локальной иммунной системой кишечника и головным мозгом существует как по гуморальному, так и по клеточному механизму: с одной стороны, экспрессируемые провоспалительные (например, интерлейкины IL-1, IL-6, IL-23 и IL-12 ) цитокины участвуют в активации RAS и нарушении баланса биохимических процессов в микроглии [49, 56], а с другой — возможно прямое проникновение T-клеток в головной мозг, в особенности после кратковременной его ишемии, что было показано в исследовании Benakis [57]. Более того, было показано, что α-syn может непосредственно передаваться в головной мозг через nervus vagus [58], в дальнейшем вызывая прогрессирование заболевания. И, сверх того, было доказано, что после усиления экспресии α-syn в клетках кишечных сплетений через несколько месяцев обнаруживается повышенное содержание α-syn в крови. Было выяснено, что между кишечником и головным мозгом существует двусторонняя связь [59]. Доказано также, что хроническое воспаление в кишечнике увеличивает уязвимость дофаминергических нейронов в ЦНС. В модели хронического воспаления кишечника было показано достоверное снижение числа дофаминергических нейронов. Также примечательно, что воспаление кишечника увеличивает проницаемость гематоэнцефалического барьера, что в совокупности с другими факторами может играть роль в активации нейровоспаления и стимулировании развития БП [60–61].
Заключение
Представленные данные отображают проблему, сложившуюся в области поиска истинной причины развития нейродегенеративных заболеваний. Огромное количество исследований, проводимых в мире, наглядно показывают заинтересованность ученых данной проблемой и необходимость обретения единой точки зрения на этиологию болезни Паркинсона, что может радикально повлиять на подход к лечению. Терапия любого заболевания должна включать этиологическое, патогенетическое и симптоматическое лечение, поэтому, не зная механизмов развития патологии, мы не можем проводить полноценное лечение. В случае с БП выпадает первое звено — этиологическое.
Из-за недостаточности знаний лечение БП направлено лишь на торможение и уменьшение степени нейродегенерации в нигростриарных нейронах (нейропротекторная терапия) и нормализацию биохимического дисбаланса (симптоматическая терапия). Сегодня нейропротекторная терапия является перспективной для возможного уменьшения темпа прогрессирования БП. К средствам с предполагаемым нейропротекторным действием при БП относятся препараты с антиоксидантным эффектом (ингибиторы моноаминоксидазы), агонисты дофаминовых рецепторов, ингибиторы транспорта дофамина [62]. Подобную тактику используют и западные коллеги.
На сегодняшний день, исходя из полученных сведений об этиологии и патогенезе БП, уже предложены новые пути лечения этого заболевания:
противовоспалительная терапия как элемент профилактики БП [63];
воздействие на Ca2+-зависимые каналы [64];
анти-α-syn терапия [65];
терапия ингибиторами киназ [66];
антиоксидантная терапия [67];
профилактика дисбиоза [68];
таргетированная профилактика развития БП в группах риска по данному заболеванию путем применения лечебной физкультуры [67].
Таким образом, все перечисленные идеи и гипотезы должны быть глубоко изучены и масштабно оценены как еще один (а не единственно верный) механизм развития данной патологии.
Актуально рассматривать БП в качестве полиэтиологического заболевания, приходящего к своему «расцвету» через множество патогенетических путей, изучение которых, на наш взгляд, должно быть мультидисциплинарной, комплексной проблемой. Поиск воздействия на патогенез БП актуален не только в целях лечения, но и, что наиболее важно, в целях предотвращения развития данной патологии.
Информация с rmj.ru


