Для цитирования: Авдошенко К.Е. Современный подход к восстановительному лечению пациентов после пластических операций на лице // РМЖ. 2007. №19. С. 1396
Современные технологии пластической и реконструктивно–восстановительной хирургии челюстно–лицевой области позволяют достичь высоких эстетических и функциональных результатов во многом благодаря совершенствованию хирургических методик, широкому внедрению в практику эндоскопической техники. Следует отметить, что многие из них сопровождаются обширной мобилизацией кожных, кожно–жировых лоскутов, вмешательством на поверхностной мышечно–апоневротической системе, надкостнице. Очевидно, что такая травматизация тканей вызывает в организме ответную реакцию защитно–приспособительного типа, которая проявляется совокупностью патофизиологических изменений, вызванных метаболическими и воспалительными (иммунными) реакциями, индуцированными операционной травмой: развитием воспалительного отека, микроциркуляторных нарушений, приводящих к возникновению тканево–трофических расстройств.
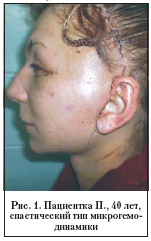
Нами проведено изучение динамики микроциркуляторных показателей в коже у 106 пациенток в возрасте от 40 до 68 лет, которым выполнялась хирургическая коррекция атрофии кожи лица и шеи, с неосложненным течением послеоперационного периода. По данным лазерной допплеровской флоуметрии к 7–м суткам послеоперационного периода у пациенток преобладает спастический (84%) тип микрогемодинамики (табл. 1), характеризующийся значительным снижением показателя микроциркуляции (>50%), обусловленным уменьшением притока артериальной крови в микроциркуляторное русло за счет спазма приносящих артериол. Эти изменения объясняются значительным повышением симпатических влияний вплоть до денервационной гиперчувствительности сосудов к гуморальным факторам регуляции сосудистого тонуса на фоне операционной травмы, что способствует уменьшению притока крови в микроциркуляторное русло. Клинически это проявляется бледностью кожного покрова лоскутов (рис. 1).
У 16 % пациенток отмечался спастически–застойный тип микрогемодинамики, характеризовавшийся снижением перфузии (<50%), выраженными застойными явлениями в венулярном отделе микроциркуляторного русла и стазом на уровне капилляров.
Одновременно с нарушениями проницаемости кровеносных сосудов изменяется также и проницаемость лимфатических капилляров. Все эти процессы ведут к гипоксии и тканевому ацидозу, который еще больше усугубляет прежние расстройства.
В связи с этим в одних резистивных сосудистых терминалях развивается спазм гладкой мускулатуры, в других – парез, что приводит к расстройству периферической гемодинамики с появлением в тканях очагов ангиоспастической ишемии и ангиопаретического полнокровия, сочетающихся с веноспастическим замедлением или даже застоем кровотока, венокапиллярной гиперемией и сладжированием крови.
Важно подчеркнуть, что функциональные нарушения в микрососудах часто сочетаются с повреждением структур их стенки и повышением ее проницаемости, что неизбежно завершается тканево–трофическими расстройствами. В некоторых случаях осложненное течение послеоперационного периода может стать причиной неудовлетворительного послеоперационного результата.
С целью создания оптимальных условий для благоприятного послеоперационного заживления тканей, уменьшения отека и связанного с ним болевого синдрома, а также сокращения периода нетрудоспособности необходимо осуществлять комплексный подход к восстановительному лечению данной группы пациентов.
Наряду с широко используемыми медикаментозными средствами антибактериального и противовоспалительного действия целесообразно применять физические методы лечения.
В основе работы любого из них лежит применение одного или комбинации физических факторов. Это достаточно простой, безболезненный, неинвазивный и эффективный способ коррекции возникших нарушений.
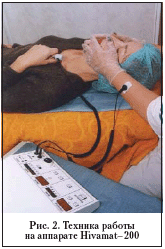
Начиная со 2–3–х суток послеоперационного периода, для устранения и профилактики образования отека возможно использование УВЧ–терапии и низкочастотной магнитотерапии. В случае инфицирования раны патогенетически обосновано применение красной лазеротерапии (max=0,632 мкм) или микротоковой терапии. В результате воздействия этими факторами происходит активация клеточного дыхания, антиоксидантной системы, снижается концентрация токсических метаболитов в очаге воспаления, стимулируется фагоцитоз. Для коррекции возникающих микроциркуляторных нарушений необходим дифференцированный подход. При наличии у пациента выраженного послеоперационного отека мягких тканей, сопровождающегося спазмом приносящих артериол, что клинически проявляется бледностью кожных покровов, целесообразно применение электростатического массажа с использованием аппаратного комплекса Hivamat–200 (рис. 2).
За счет выраженного вазодилатирующего, лимфодренажного, угнетающего действия на симпатическую иннервацию сосудистой стенки эффективно увеличивается перфузия в травмированных тканях, нормализуется тонус различных звеньев микроциркуляторного русла, уменьшается венозный застой.
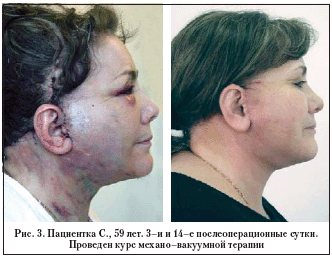
Если преобладающим симптомом являются застойные явления в коже, тогда патогенетически обосновано применение механо–вакуумной терапии с использованием аппаратного комплекса «Lift 6». Благодаря сочетанию приемов механического массажа с вакуумной терапией достигается выраженный венотонизирующий эффект, способствующий уменьшению застойных явлений в венулярном колене микроциркуляторного русла (рис. 3).
Начиная с 7–10–х суток послеоперационного периода происходит формирование послеоперационного рубца. На этом этапе целесообразно применение ультразвуковой терапии или электрофореза с противорубцовыми препаратами. Благодаря их разволокняющему и дефиброзирующему действию можно контролировать процесс рубцевания.
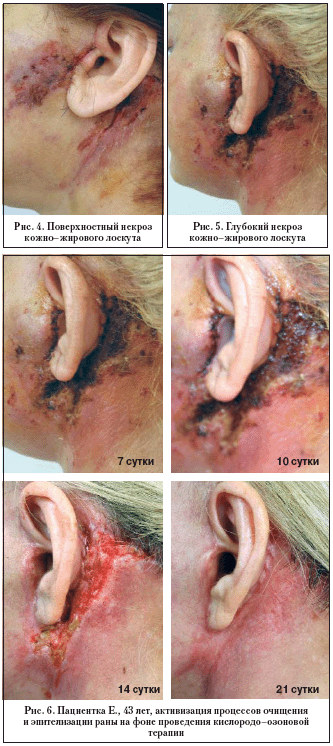
Тканево–трофические расстройства иногда завершаются формированием краевых поверхностных или полнослойных некрозов кожно–жировых лоскутов (рис. 4,5). Наличие таких изменений ведет к значительному (до 6–8 недель) удлинению сроков реабилитации и зачастую способствует развитию гипертрофических рубцов на месте заэпителизировавшихся ран.
В связи с этим необходим поиск новых наиболее эффективных способов лечения ран, отвечающих современным представлениям о развитии раневого процесса. Современным направлением в лечении ран является кислородо–озоновая терапия. Основу локального инъекционного применения озона составляют научные знания о физиологических и биохимических механизмах его действия, полученные в ходе многочисленных исследований. По данным Вольфа (1979), гибель клетки и ткани представляет собой результат длительной, необратимой гипоксии клетки. Путем использования реакционно–активных и метастабильных молекул озона на еще обратимых стадиях гипоксемии можно предотвратить развитие трофических расстройств в тканях. Антигипоксическое действие объясняется стабилизирующим влиянием озона на мембрану эритроцита, что препятствует агглютинации и способствует улучшению вязкости крови. Доказано, что подкожные инъекции озона способствуют нормализации не только местного кровообращения, но и кровообращения во всем организме, улучшая общее состояние пациента уже после нескольких инъекций. В случае развития трофических нарушений в кожно–жировых лоскутах применение кислородо–озоновой терапии в ранние сроки после операции позволяет приостановить развитие тканево–трофических расстройств, а обкалывание кислородо–озоновой смесью участков некрозов способствует скорейшему очищению ран и активизации их эпителизации (рис. 6).
Таким образом, своевременное, поэтапное применение новейших методов физиотерапии и аппаратной косметологии позволяет предотвратить развитие выраженной воспалительной реакции в ответ на операционную травму, значительно уменьшить болевой синдром, нормализовать работу микроциркуляторного русла, что, в свою очередь, ведет к сокращению сроков восстановительного периода пациентов.
Проведенные физикальные обследования позволили подтвердить результаты клинических наблюдений и оценить эффективность патогенетического подхода к применению различных физических факторов после хирургических вмешательств в челюстно–лицевой области.

Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Предыдущая статья
Следующая статья
Информация с rmj.ru




