Современные возможности использования интерферонов в комплексной терапии острых респираторных инфекций у детей
Э. Э. Локшина *, кандидат медицинских наук
О. В. Зайцева *, доктор медицинских наук, профессор
Л. Н. Мазанкова **, доктор медицинских наук, профессор
Т. А. Чеботарева **, кандидат медицинских наук
Н. А. Коровина **, доктор медицинских наук, профессор
Х. И. Курбанова **
В. В. Малиновская ***, доктор биологических наук, профессор
Т. С. Гусева ***
О. В. Паршина ***
*ГОУ ВПО МГМСУ, **ГОУ ДПО РМАПО, ***ФГБУ «НИИЭМ им. Н. Ф. Гамалеи», Москва
В настоящее время острые респираторные вирусные инфекции (ОРВИ) являются наиболее массовыми инфекционными заболеваниями и у детей в возрасте до пяти лет занимают 70–90% от общей структуры заболеваемости. Дети в возрасте от одного года до пяти лет чаще болеют ОРВИ, что объясняется постепенной утратой иммунитета, приобретенного от матери, и несовершенством собственной иммунной защитной системы. Кроме того, известно, что у детей, находящихся в организованных детских коллективах (детские сады), ОРВИ возникают в среднем 8–10 раз на первом году посещения, 5–6 раз на втором, 3–4 раза на третьем.
Рассматривая вопросы распространенности острых респираторных заболеваний у детей, необходимо помнить об особенностях врожденного и адаптивного иммунитета. Это обусловлено Th2-направленностью иммунного ответа, несостоятельностью макрофагально-фагоцитарного звена, возрастными особенностями функционирования системы интерферонов (ИФН), снижением концентрации компонентов комплемента при альтернативном пути воспаления и продукции иммуноглобулинов классов G и A, незрелостью Т- и В-лимфоцитов [1–3]. Более частым эпизодам ОРИ у детей раннего возраста по сравнению со взрослыми способствуют анатомо-физиологические особенности дыхательной системы, прежде всего мукоцилиарной и сурфактантной системы, особенности строения бронхов.
Для системы ИФН также характерны возрастные особенности. По мере развития ребенка происходит поэтапное созревание системы ИФН. Однако синтез ИФН у детей, особенно раннего возраста, значительно снижен по сравнению с таковым у взрослых. Поэтому несовершенство иммунитета и нейроэндокринной регуляции может приводить к повышенной восприимчивости к инфекционным заболеваниям, а также увеличивать частоту и тяжесть ОРИ. Кроме того, и другие факторы способны оказывать влияние на изменения в интерфероногенезе, такие как нарушение питания, загрязнение окружающей среды, воздействие радиации. У часто болеющих детей, находящихся на искусственном вскармливании, живущих в условиях повышенной радиации, а также подвергшихся внутриутробному или постнатальному инфицированию, снижена способность лейкоцитов к продукции ИФН. Воздействие экопатогенных факторов может приводить к сенсибилизации детского организма, существенно снижая его резистентность к вирусным и бактериальным инфекциям [4].
ОРВИ, имея разную этиологию, схожи по эпидемиологии, патогенезу и имеют общую симптоматику, требуют терапии до идентификации возбудителей, и в этом случае важная роль отводится средствам, влияющим на иммунную систему и повышающим неспецифическую резистентность организма, а также обладающим широким спектром действия на многочисленные возбудители ОРВИ.
К этой группе препаратов относятся ИФН. ИФН — естественные цитокины, обладающие универсальными антивирусными свойствами: способностью к подавлению репликации многих РНК- и ДНК-содержащих вирусов благодаря ингибированию процессов транскрипции и трансляции вирусных матриц. Кроме того, ИФН являются медиаторами иммунитета, повышают эффективность неспецифических защитных реакций: усиливают цитотоксичность сенсибилизированных лимфоцитов и NK-клеток, активность макрофагов, а также способствуют восстановлению нарушенного гомеостаза и оказывают иммуномодулирующее действие.
Из препаратов ИФН для лечения и профилактики ОРВИ у детей наиболее широко применяется лекарственное средство Виферон, мазь, который представляет собой комплексный препарат интерферона человеческого рекомбинантного альфа-2, с токоферола ацетатом на основе ланолина безводного и вазелина медицинского. Содержание ИФН в 1 г мази — 40000 МЕ.
В ряде случаев местное применение препаратов интерферона даже более эффективно, чем системное, так как позволяет добиться активации мукоцилиарных факторов защиты при меньшем расходе препарата. При введении препарата в носовые ходы Виферон действует в месте первичного внедрения и размножения респираторных вирусов на эпителиальные клетки слизистой оболочки носа.
Для оценки безопасности, переносимости и лечебной эффективности препарата Виферон, мазь (интерферон человеческий рекомбинантный альфа-2) при лечении ОРВИ и гриппа у детей нами было проведено мультицентровое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование.
Материалы и методы
Работа осуществлялась в эпидсезон 2007–2008 гг. на трех клинических базах: кафедра педиатрии ГОУ ВПО МГМСУ Росздрава (Детская городская клиническая больница Святого Владимира) под руководством проф. О. В. Зайцевой, кафедра детских инфекционных болезней с курсом детской дерматовенерологии ГОУ ДПО РМАПО Росздрава (проф. Мазанкова Л. Н.) и кафедра педиатрии ГОУ ДПО РМАПО Росздрава (проф. Коровина Н. А.) на базе отделений Тушинской детской городской больницы. Исследование проводилось в строгом соответствии с требованиями Хельсинкской декларации (WMA, 1964) и Декларации о политике в области обеспечения прав пациентов в Европе (WHO/EURO, 1994).
Рандомизировано 100 детей в возрасте от одного года и до 9 лет 10 месяцев, из них 65 (65%) мальчиков и 35 (35%) девочек. В возрастной структуре обследованных пациентов преобладали дети младшего возраста (от одного года до трех лет — 69%), дети от трех до семи лет составили 28% и старше семи лет — 3%.
Критериями включения в исследование были: пациенты с клинически установленным диагнозом «острая респираторная вирусная инфекция или грипп»; форма тяжести заболевания: среднетяжелая; госпитализация не позднее 48 часов с момента заболевания; возраст от одного года до 18 лет; информированное согласие родителей пациента или уполномоченных лиц на участие в исследовании, лабораторное подтверждение диагноза респираторного вирусного заболевания с помощью полимеразной цепной реакции (ПЦР).
Критериями исключения из исследования были: наличие гиперчувствительности, аллергические реакции на компоненты препарата; наличие тяжелых сопутствующих заболеваний (сахарный диабет, туберкулез, хронические заболевания печени и почек, онкологические заболевания в любой стадии, ВИЧ); несоблюдение пациентом назначений врача; применение других иммуномодуляторов за 4 недели до начала исследования и в период исследования.
Распределение пациентов по группам осуществлялось методом случайной выборки. Группа А — получала препарат серии 233 (50 детей), группа Б — получала препарат серии 144 (50 детей). Группы наблюдаемых детей были сопоставимы.
По внешнему виду препараты Виферон и плацебо не отличались, упаковки — баночки с мазью (12 г) зашифрованы под разными номерами серий (233 и 144).
Этиологическая расшифровка ОРВИ проводилась методом ПЦР в лаборатории легионеллеза ГУ НИИЭМ им. Н. Ф. Гамалеи РАМН. Обработку проб смывов со слизистой носа проводили с использованием наборов пробоподготовки «Проба-НК» производства фирмы «ДНК-Технология». Амплификацию и детекцию вирусной ДНК проводили с использованием интеркалирующего красителя SYBR-green на амплификаторе для проведения ПЦР в реальном времени ICycler IQ фирмы Bio-Rad (США). Содержание цитокинов, интерферонов и IgA определяли иммуноферментным методом (тест системы фирмы «Вектор-Бест», Новосибирск).
Статистический анализ данных выполнялся с использованием пакета программ Statistica 6.1 (StatSoft, Inc., США).
Дети получали препарат Виферон или плацебо в следующих дозировках, в зависимости от возраста: детям от одного года до двух лет 2500 МЕ 3 раза в день, от двух до 12 лет 2500 МЕ 4 раза в день, распределяя равномерно в оба носовых хода после промывания физиологическим раствором. Длительность терапии составила 5 дней.
Результаты исследования
Оценку эффективности проводили у 90 детей, полностью завершивших исследование. Критериями оценки терапевтической эффективности препарата являлись сроки и темпы обратного развития основных проявлений болезни: нормализация температуры, исчезновение симптомов интоксикации, респираторных симптомов, общая длительность заболевания, частота и характер осложнений.
У всех детей отмечались проявления катарального воспаления в носоглотке (заложенность носа, ринит, признаки ларинготрахеита) в той или иной степени выраженности, у каждого второго — симптомы острого стеноза гортани, а в ряде случаев — признаки бронхита, иногда с развитием бронхообструктивного синдрома (БОС).
До начала лечения у детей рандомизированных групп для выявления этиологии ОРВИ были взяты смывы из носа.
Этиология заболевания была установлена у большинства наблюдавшихся детей на основе клинической интерпретации, обнаружения вирусов в смывах со слизистой носа методом ПЦР (табл. 1).
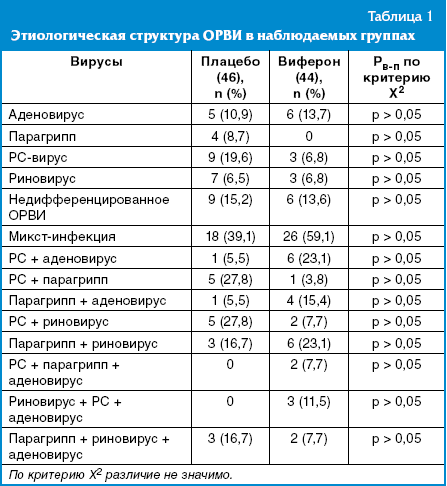
Этиологическая структура представлена следующими возбудителями: аденовирус у 11 (12,9%), парагрипп — у 4 (4,7%), РС-вирус — у 12 (14,1%), риновирус — у 10 (11,8%), смешанная инфекция у 44 детей (51,8%) в различных сочетаниях. Доминировало участие РС-вируса и аденовируса — преимущественно в сочетании друг с другом или с другими респираторными вирусами, при этом у 10 детей удалось выявить более трех возбудителей.
Длительность лихорадки при течении ОРВИ составляла от 0 до 5 дней, в среднем по группам: Виферон — 1,56 ± 0,2 суток, плацебо — 1,82 ± 0,2 суток (р > 0,05). Отсутствие значимых различий влияния терапии на продолжительность лихорадки, возможно, связано с применением жаропонижающей терапии при повышении температуры выше 38,5 °С.
Выявлена тенденция к более быстрому купированию токсикоза у детей, получавших Виферон: через 1–2 суток от начала лечения его проявления отсутствовали у 40,8% наблюдаемых, а в группе плацебо лишь у 10,4% (р < 0,05), общая продолжительность токсикоза 3,15 ± 0,31 и 3,7 ± 0,27 суток (р > 0,05) соответственно. Значимыми также оказались различия в сроках восстановления двигательной активности в наблюдаемых группах. На 3-й день терапии вялость сохранялась у 30,7% детей в группе плацебо и у 4,5% детей, получавших Виферон (р < 0,05).
Влияние терапии на респираторный синдром выражалось в достоверном сокращении длительности сухого кашля до 1,3 ± 0,14 дня в группе, получавшей Виферон (р < 0,05), против 1,95 ± 0,22 дня в группе плацебо, кроме того, достоверно быстрее отмечалась трансформация сухого кашля во влажный в группе получавших Виферон (2,25 ± 0,1 против 2,8 ± 0,15 в группе плацебо (р < 0,05)). Это отразилось на ускорении нормализации общего состояния детей в группе получавших Виферон.
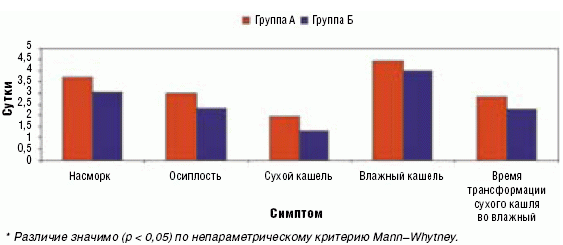
Рис. Средняя продолжительность катаральных симптомов в наблюдаемых группах
Особо следует отметить тенденцию положительного влияния препарата Виферон на продолжительность осиплости — купирование симптома на 15 часов быстрее, чем в группе плацебо (по средним показателям в группе Виферона 2,3 ± 0,23 и в группе плацебо 3,0 ± 0,24 суток) (рис.).
Для оценки противовирусного эффекта лечения оценивалась элиминация этиологически значимых вирусов в смывах из носоглотки после терапии. При анализе данных нашего исследования было выявлено, что терапия человеческим рекомбинантным ИФН-альфа-2 в сочетании с витамином Е имеет достоверные различия с препаратом плацебо в элиминации этиологических вирусов как при варианте моно-, так и при варианте микст-инфекции (табл. 2).
Полная элиминация вируса после лечения произошла в группе плацебо у 28,0% больных при моноинфекции, при микст-инфекции у 55,5%, в группе получавших Виферон у 91,6% и 88,5% соответственно, различия значимы (р < 0,05).
У части детей обеих групп при исследовании смывов из носоглотки после проведенной терапии отмечена контаминация дополнительными этиологически незначимыми вирусами, по-видимому, связанная с условиями пребывания детей в стационаре. Значительно реже регистрация «новых» вирусов отмечалась после терапии препаратом Виферон — у 13 больных (29,5%) против 23 (50%) в группе плацебо (р < 0,05 по точному критерию Фишера) (табл. 3).
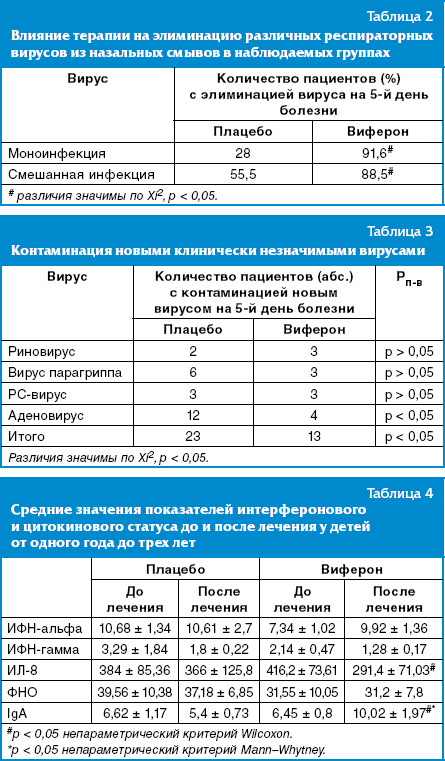
Выраженный протективный эффект против аденовируса выявлен у препарата Виферон, мазь, контаминация данным вирусом происходила в 3 раза реже, чем в группе плацебо.
Для объективизации оценки иммунологической эффективности терапии с учетом сведений литературы о возрастных различиях интерфероногенеза и цитокиновых взаимодействий анализ проводился в двух возрастных подгруппах: от одного года до трех лет (n = 61), старше трех лет (n = 29).
Диапазон иммунологических показателей у детей от одного года до трех лет до лечения в острый период заболевания составил ИФН-альфа 2,8–29,5 пг/мл, ИФН-гамма 0,1–8,56 пг/мл, ФНО — 8,26–323,9 пг/мл, ИЛ-8 — 3,38–2308,56 пг/мл, IgA — 3,7–11,4, что несколько отличалось от этих же показателей старшей возрастной группы (табл. 4).
В процессе исследования показано, что влияние на показатели местного иммунитета в процессе лечения не было сильно выраженным. Тем не менее, ИФН-альфа в группе детей, получавших Виферон, повышался по сравнению со стартовыми значениями, в группе плацебо динамики отмечено не было. Средние значения ИФН-гамма несколько снижались по сравнению с исходным уровнем, что характерно для детей с ОРВИ, причем более интенсивное снижение отмечено в группе плацебо. ИЛ-8 является активным участником острой воспалительной реакции, средние значения его снижались в 1,5 раза в группе Виферона после терапии, что свидетельствует о более быстром купировании местной воспалительной реакции на фоне проводимого лечения (p < 0,05). Средние значения ФНО существенно не изменились после лечения ни в одной из групп.
Значимое повышение среднего уровня секреторного IgA наблюдалось в группе Виферона после лечения с 6,45 ± 0,8 мг/л до 10,02 ± 1,97 мг/л (p < 0,05) и статистически значимо превалировало по сравнению с группой плацебо. Секреторный IgA является основным защитным фактором, препятствующим проникновению вирусов в эпителиальные клетки респираторного тракта, возможно, это объясняет протективный эффект лечения в отношении контаминации новыми вирусами в группе получавших Виферон, мазь.
В старшей возрастной группе достоверных различий в изменениях местного иммунитета получено не было (табл. 5).

В группе плацебо исходное среднее значение ИФН-гамма было выше (16,95 ± 5,45 пг/мл), чем в группе Виферона (2,75 ± 0,74 пг/мл), в связи с этим сравнение динамики этого показателя оказалось некорректным.
Средние показатели ИЛ-8 до начала лечения в разгар заболевания были достаточно высокими (группа плацебо — 526,41 ± 269,53 пг/мл, группа Виферона 945,5 ± 233,96 пг/мл). По окончании лечения в группе плацебо показатели практически не изменились (564,89 ± 270,03 пг/мл), в группе Виферона отмечено существенное снижение (420,68 ± 128,13 пг/мл), что может свидетельствовать об уменьшении воспалительного процесса.
Таким образом, учитывая результаты проведенного исследования, можно говорить о высокой эффективности человеческого рекомбинантного ИФН-альфа-2 в сочетании с токоферолом. Виферон оказывал положительное влияние на течение заболевания: уменьшалась продолжительность катаральных симптомов (сухого кашля), ускорялась трансформация сухого кашля во влажный, ускорялись темпы купирования токсикоза, темпы нормализации общего состояния. Отмечен выраженный противовирусный эффект, заключающийся как в элиминации этиологически значимых вирусов в смывах из носоглотки у большего процента больных (91,6% против 28%), так и в снижении контаминации «новыми» вирусами в группе детей, получавших Виферон. Влияние на иммунологические параметры выявлено в исследовании тоже только в группе, получавшей Виферон, мазь — у детей в младшей возрастной группе от одного года до трех лет значимо повышался уровень секреторного IgA, а также происходило существенное снижение уровня ИЛ-8 в обеих возрастных группах.
Безопасность исследуемых препаратов учитывалась у всех больных, хотя бы раз получивших препарат. Критериями безопасности явились возникновение нежелательных явлений, серьезных нежелательных явлений, их связь с приемом препарата.
У 97% пациентов в целом применение препарата было признано безопасным. Наряду с этим описан ряд нежелательных явлений у четырех детей (по два ребенка из каждой группы) (ринорея, чихание, жжение слизистой носа), топически соответствующий месту нанесения, и гиперемия слизистой носа в этой же области, оцениваемых во время терапии, что, по-видимому, связаны с основой, входящей в состав препарата. Достоверных различий при оценке данных нежелательных явлений в обеих группах не было.
Таким образом, результаты проведенного мультицентрового рандомизированного двойного слепого плацебо-контролируемого клинического исследования подтверждают высокую терапевтическую эффективность и безопасность препарата Виферон, мазь у детей раннего возраста и позволяют рекомендовать использование препарата Виферон, мазь в комплексной терапии ОРВИ и гриппа.
Литература
- Рачинский С. В., Таточенко В. К. Болезни органов дыхания у детей: Рук-во для врачей. М., 1987. 495 с.
- Инфекции респираторного тракта у детей раннего возраста / Под ред. проф. Г. А. Самсыгиной. 2006, с. 143.
- Макарова С. А. Клинико-функциональные особенности бронхообструктивного синдрома у детей раннего возраста и способы его коррекции. Автореферат диссертации на соискание ученой степени к.м.н. 14.00.09. Год защиты: 2004. С. 17.
- Зайцева О. В. Препараты интерферона в повседневной практике врача // Медицинская кафедра. 2002, № 3, с. 50–55.
- Нестерова И. В. Интерфероны в клинической практике. Труды XVI Российского национального конгресса «Человек и лекарство». Москва, 6–10 апреля 2009, т. 1, с. 315–335.
- Нестеров И. В. Препараты интерферона альфа в клинической практике // Российский аллергологический журнал. 2010, № 2, с. 43–52.
- Ершов Ф. И., Григорян С. С., Орлова Т. Г. и др. Противовирусная терапия ОРВИ у детей // Детские инфекции. 2006, № 3, с. 56–61.
- Jefferson T. O., Tyerell D. Antivirals for the common cold // Cochrane Database of Systematic Reviews. 2005, Issue 3. Published by John Wileyd@Sons Ltd., 2005.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





