Современные аспекты нарушений сосудисто-тромбоцитарного звена гемостаза у больных корью
Содержание статьи
Введение
В настоящее время во всем мире отмечается рост заболеваемости корью. По данным ВОЗ, ежегодно в странах Европы (Австрия, Румыния, Болгария, Бельгия, Чехия, Венгрия, Франция, Германия, Швеция, Италия, Португалия, Исландия, Испания, Швейцария) регистрируют более 2000 случаев, в т. ч. среди взрослого населения. По мнению Европейского центра профилактики и контроля заболеваний, основной причиной эпидемии является резкое уменьшение количества привитых детей [1–4]. Несмотря на предпринятые безопасные и экономически эффективные меры профилактики, направленные на успешное осуществление программы элиминации кори в Российской Федерации (РФ) к 2015 г. и снижение ее инцидентности на большинстве территорий страны, заболевание не утратило своей актуальности [5]. Так, за 2018 г. показатель заболеваемости этим острым высококонтагиозным вирусным заболеванием вырос в 3,5 раза по сравнению с аналогичным периодом 2017 г. и составил 1,73 на 100 тыс. человек, число заболевших — 2538 [6]. На сегодняшний день весьма широко представлены вопросы, затрагивающие проблемы эпидемиологии, иммунопрофилактики и профилактики кори. Известно, что внедрение вируса кори происходит через эпителий слизистой оболочки верхних дыхательных путей и конъюнктивы с последующим проникновением в подслизистую оболочку и регионарные лимфатические узлы и формированием высокой концентрации вируса в лимфатических узлах, селезенке, печени, миндалинах, фолликулах, миелоидной ткани костного мозга к середине инкубационного периода [7].
В последние годы было доказано, что патогенные и аттенуированные вирусы кори дикого типа используют CD46 в качестве рецептора входа в клетку [8], который также известен как мембранный кофакторный белок, экспрессируемый всеми клетками человека (кроме эритроцитов), в т. ч. тромбоцитами [9]. Данный факт не исключает, что определенную роль в патогенезе кори выполняют и тромбоциты, поскольку в основе экзантемы, являющейся патогномоничным синдромом этой вирусной инфекции, лежат нарушения микроциркуляции, повреждение стенок сосудов в виде периваскулярного отека, диапедеза эритроцитов с повышением их агглютинации, геморрагий и, в части случаев, некрозов. Развитие тяжелых осложнений, таких как коревой энцефалит, кератит с полной потерей зрения, панэнцефалит, пневмония, а также высокий риск прерывания беременности являются вероятным следствием проявления некупированного тромбогеморрагического синдрома [7, 10]. Помимо этого, некоторые исследователи среди атипичных форм кори выделяют геморрагическую, сопровождающуюся множественными кровоизлияниями на кожных покровах, гематурией и меленой — «черную корь» [11].
Однако, по данным литературы, исследования гемостаза на современном уровне, с преимущественным акцентом на сосудисто-тромбоцитарное звено гемостаза, у больных корью систематически не проводились.
Цель исследования: определить роль нарушений сосудисто-тромбоцитарного звена гемостаза у больных корью.
Материал и методы
За период 2017–2018 гг. на базе отделений ГБУЗ ИКБ № 2 ДЗМ и клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора было проведено клинико-лабораторное наблюдение и обследование 40 больных с диагнозом «корь», верифицированным методом иммуноферментного анализа с определением класса IqM. У больных, включенных в группу исследования, болезнь протекала в среднетяжелой форме без осложнений. Возраст пациентов составлял 36,9±9,2 года, при этом преобладали лица мужского пола (62,5%). Контрольную группу составили 20 практически здоровых лиц. В основном (75%) больные поступали на 2-е сут от момента появления высыпаний, что соответствовало 6,3±0,9 дня от начала болезни. В 16,7% случаев выявляли позднюю госпитализацию, связанную либо с поздним обращением за специализированной медицинской помощью (6,7%), либо с появлением высыпаний на 8–9-й день болезни (10,0%). В 87% случаев заражение происходило в результате контакта с больными корью.
Для оценки референсных значений показателей гемостаза было обследовано 20 практически здоровых лиц в возрасте 33,9±0,4 года, объединенных в контрольную группу.
Агрегационную активность тромбоцитов изучали с помощью индуктора АДФ в базовой концентрации 2×10–5 М на агрегометре AP-2110 («Солар») и оценивали по степени агрегации (V%).
Активность фактора Виллебранда определяли на агрегометре LA 230 (НПОБИОЛА) тест-системой Виллебранд-тест НПО «Ренам», D-димер — на автоматизированном коагулогическом анализаторе Sysmex CS5100 системой D-DimerINNOVANCE, Siemens.
Статистическую обработку данных проводили с использованием программы STATISTICA 10 Stat.Soft.Inc с применением параметрических и непараметрических методов.
Результаты исследования и обсуждение
В 78,6% случаев корь характеризовалась острым началом с подъемом температуры тела до фебрильных значений, а у остальных регистрировали субфебрилитет с переходом в высокую пирексию в течение 4 сут. В этот период у больных отмечали выраженную слабость, светобоязнь, интенсивную головную боль разлитого характера, нарушение сна, сухой лающий кашель с развитием в динамике осиплости голоса, обильные выделения слизистого характера из носа. Кожные покровы были гиперемированы, горячие на ощупь, отмечали пастозность лица. С первых дней лихорадки у больных появлялись симптомы катарального конъюнктивита и склерита в виде инъецированности сосудов с проявлениями болезненности при движении глазных яблок.
В 80,1% случаев в момент поступления больных в стационар констатировали лимфаденопатию. Пальпировались в основном подчелюстные, передние и средние шейные лимфоузлы, безболезненные и не спаянные с окружающими тканями. Слизистая ротоглотки была гиперемирована, отмечали энантему на мягком и твердом небе, а также гипертрофию миндалин. В 61,4% случаев на слизистой оболочке щек регистрировали пятна Бельского — Филатова — Коплика, которые сохранялись в среднем до 9-го дня болезни.
Многие клиницисты у взрослых также регистрировали начало кори с катарального синдрома [12], другие отмечали к концу катарального периода некоторое снижение температуры [1]. В нашем же наблюдении температура тела выше 38 °С у больных сохранялась более 2 сут в период разгара, который был ознаменован появлением розеолезно-папулезных элементов сыпи на 4-е сут болезни у всех больных.
По данным литературы, одним из основных симптомов, которые учитываются при дифференциальной диагностике инфекционных заболеваний, протекающих с экзантемами, является этапность высыпаний, свойственная кори: вначале они появляются на лице, к началу 2-х сут распространяются на шею, верхнюю часть груди и верхние конечности, а к концу — на туловище и нижние конечности [7, 13]. Однако у 9 наблюдаемых нами пациентов сроки появления элементов сыпи сокращались до нескольких часов. Высыпания были представлены розеолами и папулами, склонными к слиянию, в результате чего сыпь приобретала розеолезно-папулезный характер у всех наблюдаемых больных, тогда как некоторые исследователи регистрировали данный симптом только в 84,1% случаев [12]. Элементы экзантемы становились крупными, неправильной формы, интенсивно розовой окраски. Следует отметить, что у 2 пациентов на 6-й день болезни отмечали единичные петехии в месте естественных складок кожи и регистрировали положительный симптом щипка.
С 9-го дня болезни элементы сыпи начинали регрессировать через стадию пигментации также поэтапно, но в обратном порядке относительно их появления в течение 2–4 сут.
При этом температура тела постепенно снижалась до нормальных значений. В результате продолжительность лихорадки у наблюдаемых больных составила 8,9±0,4 дня.
По литературным данным, развитие пигментации при кори связано с полнокровием и диапедезом эритроцитов в период разгара с последующим преобразованием гемоглобина в гемосидерин, при этом диапедез обусловлен выходом форменных элементов крови через стенки капилляров в связи с нарушением их тонуса и проницаемости [7], что послужило основанием для более детального исследования роли сосудисто-тромбоцитарного звена гемостаза у наблюдаемых больных.
Среди клинических симптомов, свидетельствующих о патологических нарушениях со стороны органов дыхания, выделяли катар верхних дыхательных путей. Аускультативные изменения в легких отмечены в виде жесткого дыхания с момента поступления в стационар у 86,4% больных, а у 15,4% в сроки 8,3±0,4 дня болезни регистрировали влажные рассеянные мелкопузырчатые хрипы. У этих больных на рентгенограмме легких выявляли признаки интерстициальной пневмонии. Со стороны сердечно-сосудистой системы регистрировали тахикардию до 90 уд./мин на фоне пирексии. Со стороны пищеварительной системы наблюдались: снижение аппетита, в единичных случаях (7,1%) гепатомегалия и повышение концентрации общего билирубина за счет прямой фракции, повышение активности АЛТ и АСТ выявляли в 21,4% случаев.
По данным ряда исследователей, изменения в крови при кори в основном затрагивали лейкоцитарное звено в виде лейкопении со сдвигом лейкоцитарной формулы влево, а также ускорение скорости оседания эритроцитов, что свидетельствовало о значимости иммунологических изменений в патогенезе кори [7, 11, 12]. Однако при этом состояние гемостаза оценивали лишь фрагментарно и только в случаях тяжелого течения кори с развитием бактериальных осложнений.
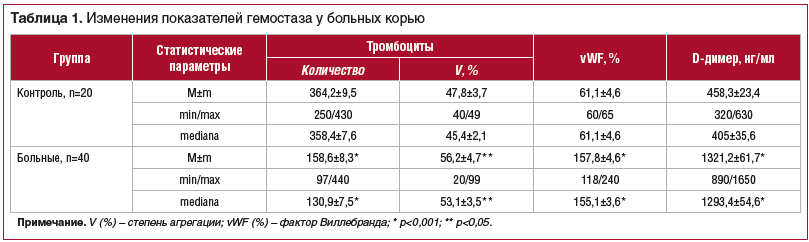
В настоящее время установлена прямая зависимость гемостаза от патологических нарушений иммунной системы при многих инфекционных болезнях. Доказано, что активированные тромбоциты являются мощным и универсальным агентом иммунных и воспалительных эффекторных клеток. Они устанавливают связь между гемостазом и иммунной системой, осуществляя распознавание, функции сигнализации, передачи биологической информации и организации сложных физиологических и патологических воспалительных реакций [14–17]. В связи с этим одной из задач данного исследования явилось изучение состояния сосудисто-тромбоцитарного звена гемостаза. В общем анализе крови общее число лейкоцитов достигало 6,5±0,2×109/л, и только при поступлении в единичных случаях (13,6%) регистрировали лейкоцитоз от 9,9 до 14,8×109/л и лейкопению до 4,0×109/л (9,1%). При этом в 97,1% случаев отмечали повышенное количество палочкоядерных нейтрофилов до 13,4±2,4% с максимальным значением 32%. Число эритроцитов значимо не изменялось и составляло в среднем 4,48±1,5×1012/л, тогда как со стороны тромбоцитарного ростка в 66,7% случаев регистрировали тромбоцитопению с минимальными значениями до 97×109/л (табл. 1). При этом MPV и PDW оставались в пределах контрольных значений (7,6±0,5 фл и 16,9±0,3%). Учитывая статистически значимое уменьшение количества тромбоцитов без изменения соотношения их гетерогенных популяций, а также специфическую реакцию со стороны палочкоядерных нейтрофилов, можно утверждать, что тромбоцитопения является характерным симптомом при современном течении кори и ее возникновение можно объяснить интенсивным расходом кровяных пластинок как первичного барьера на пути распространения вируса в организме.
Средние значения степени агрегации тромбоцитов указывали на повышение их функциональной активности (см. табл. 1). Однако у четверти больных отмечали снижение степени агрегации в среднем до 30,4%, среди них у половины — до 23%. В то же время у 27,5% больных регистрировали максимальные значения гиперагрегации. При этом скорость агрегации статистически значимо не изменялась, и только у больных при минимальных значениях агрегации уменьшалась и скорость. В 73,6% случаев регистрировали вторую волну агрегации, в т. ч. среди больных со сниженными показателями степени и скорости агрегации. Важно отметить, что у больных с наличием единичных петехий агрегация тромбоцитов была снижена до 24% и отсутствовала вторая волна на агрегатограмме.
Одним из маркеров повреждения сосудистой стенки является фактор Виллебранда. Он обеспечивает прикрепление тромбоцитов к участку поврежденного сосуда [18]. У всех наблюдаемых больных было отмечено статистически значимое увеличение активности фактора Виллебранда до 157,8±7,58%, что указывает на сохраняющееся воспаление и повреждение сосудистой стенки у пациентов с корью. При этом минимальные значения у больных превышали средние цифры у пациентов контрольной группы более чем в 1,5 раза.
Тест на D-димеры является определяющим исследованием при подозрении на тромботические нарушения. Повышение концентрации D-димеров выше средних значений контроля в данном исследовании регистрировали в 75% случаев, при этом в 35% случаев значения были выше 1000 нг/мл и только у 2 больных достигали 890 нг/мл (см. табл. 1).
Заключение
Результаты данного исследования показали, что развитие инфекционного процесса в организме больных корью сопровождается выраженными нарушениями в сосудисто-тромбоцитарном звене гемостаза в виде значительного повреждения сосудистой стенки, что, в свою очередь, на первых этапах сопровождается повышенным потреблением тромбоцитов для восстановления эндотелия, т. к. они содержат фактор роста эндотелия сосудов и тем самым являются единственными форменными элементами крови, которые осуществляют регенеративные процессы в поврежденной сосудистой стенке. Нельзя исключить также и факт изоляции вируса кори тромбоцитами как первичным барьером на пути внедрения возбудителя. Эти процессы требуют повышенного расхода кровяных пластинок, поэтому к моменту появления высыпаний возникает дефицит кровяных пластинок, проявляющийся тромбоцитопенией, но при этом они сохраняют функциональную активность с умеренным повышением. Однако выявление гипоагрегации тромбоцитов в некоторых случаях дает основание рассматривать истощение тромбоцитарного ростка, что может влиять на развитие геморрагического синдрома у этих больных.
Таким образом, в настоящее время у больных корью наблюдаются нарушения состояния сосудисто-тромбоцитарного звена гемостаза, и они могут носить определяющий характер для тяжести течения и исходов болезни. Поэтому для определения критериев риска возникновения осложнений со стороны гемостаза, а также для прогноза заболевания необходимо продолжить дальнейшее, более детальное изучение динамики всех звеньев гемостаза у больных корью.
Информация с rmj.ru






