Содержание статьи
Введение
Со времени возникновения вспышки новой коронавирусной инфекции (COVID-19), увеличившейся впоследствии до масштабов пандемии, получены многочисленные данные о ее возможных клинических манифестациях. Хотя наиболее часто наблюдаются респираторные симптомы и признаки, количество сообщений о неврологических проявлениях заболевания возрастает [1]. Среди них одним из редких является синдром Гийена — Барре (СГБ), на момент написания этой статьи опубликованы данные о 37 таких случаях [2].
В настоящее время СГБ трактуется как вариант постинфекционных аутоиммунных нейропатий. В большинстве случаев манифестации СГБ предшествует инфекция Campylobacter jejuni [3]. Цитомегаловирус, вирус Эпштейна — Барр, вирус Зика, вирус гепатита Е, вирус гриппа А, Mycoplasma pneumoniae также ассоциированы с СГБ [4]. У небольшого количества пациентов СГБ развивается после других провоцирующих событий, таких как вакцинация и операции [5, 6].
Согласно имеющимся экспериментальным и клиническим данным патогенез СГБ обусловлен не прямым невропатическим действием инфекционного агента, а иммунным ответом на предшествующую инфекцию с перекрестным реагированием с компонентами периферических нервов по механизму молекулярной мимикрии [4]. Иммунный ответ может быть направлен на миелин или аксоны периферических нервов, что приводит к демиелинизирующей и аксональной формам СГБ [3]. Вероятно, этот патогенез относится и к SARS-CoV-2-индуцированному СГБ, учитывая сроки развития данного состояния (обычно после 10-го дня от начала COVID-19) и отсутствие РНК возбудителя в ликворе пациентов [2].
Особенности иммунопатогенеза COVID-19 определяют риск развития на его фоне не только СГБ, но и таких аутоиммунных заболеваний и синдромов, как антифосфолипидный синдром, болезнь Кавасаки и иммунные цитопении [7]. Очевидно, что спектр возможных аутоиммунных ассоциаций СГБ в настоящее время окончательно не определен. По данным греческих исследователей, при обследовании небольшой когорты пациентов с COVID-19 тяжелого течения (29 пациентов), не имевших анамнестических указаний на аутоиммунную/ревматическую патологию, антинуклеарные антитела были обнаружены у 10 (34%) пациентов, антинейтрофильные цитоплазматические антитела — у 2 (7%, у одного из них в высоком титре), антикардиолипиновые антитела —
у 10 (34%), антитела к циклическому цитруллинированному пептиду — у 1 (3%) пациента [8].
Для накопления данных о СГБ как одном из аутоиммунных проявлений COVID-19 приводим описание двух случаев заболевания у пациентов нашего стационара.
Клиническое наблюдение № 1
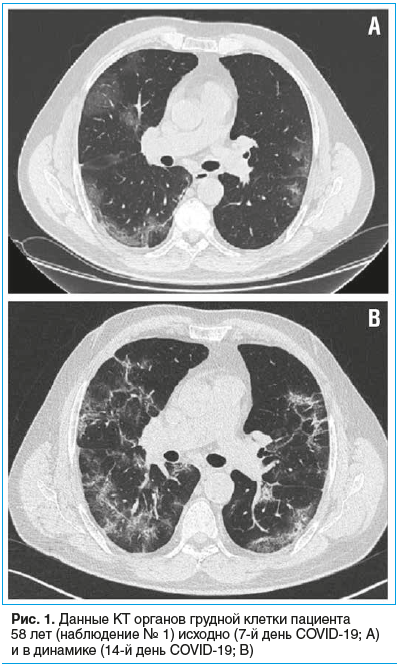
Пациент 58 лет был госпитализирован в инфекционное отделение с вероятным диагнозом COVID-19. За неделю до госпитализации возник сухой кашель, имело место повышение температуры тела до 38,0 °C. При компьютерной томографии (КТ) органов грудной клетки выявлены двусторонние интерстициальные изменения легочной ткани по типу матового стекла, поражение легочной ткани составило 68% (рис. 1А).
При поступлении: температура тела 38,8 °C, сатурация кислорода (SpO2) при дыхании комнатным воздухом 88%, частота дыхательных движений (ЧДД) 16 в минуту, частота сердечных сокращений (ЧСС) 104 в минуту, артериальное давление (АД) 130/80 мм рт. ст. Пациент не имел вредных привычек и сопутствующих заболеваний, за исключением ожирения (ИМТ 31,8 кг/м2). Отмечались следующие клинически значимые отклонения в лабораторных показателях: повышение уровня нейтрофилов (6,35×109/л, норма 2,0–5,8×109/л), лимфоцитопения (0,56×109/л, норма 1,2–3,2×109/л) при нормальном уровне лейкоцитов (7,3×109/л, норма 4,0–9,0×109/л), повышение уровня фибриногена (7,3 г/л, норма 1,9–4,3 г/л), C-реактивного белка (СРБ) (127,2 мг/л, норма 0–5,0 мг/л), ферритина (689 нг/мл, норма 30–400 нг/мл).
Пациенту была назначена терапия азитромицином, гидроксихлорохином, дексаметазоном и эноксапарином натрия, проводилась кислородотерапия (при инсуффляции кислородом SpO2 95%). Диагноз COVID-19 был подтвержден положительным результатом исследования орофарингеального мазка на SARS-CoV-2, выполненного методом полимеразной цепной реакции в реальном времени (ПЦР-РВ). В последующем этиотропная терапия была заменена на лопинавир/ритонавир и интерферон β-1b в связи с развитием одышки, увеличением общего объема поражения легочной ткани до 80% и появлением свежих участков интерстициальных изменений в легких при повторной КТ органов грудной клетки (рис. 1B).
На 13-й день от манифестации COVID-19 у пациента впервые возникли неврологические симптомы: боль в нижней части спины, слабость в нижних конечностях. В течение последующих нескольких дней отмечалось прогрессирование мышечной слабости в нижних конечностях и ее появление в верхних конечностях, вплоть до невозможности самостоятельно сидеть и вставать; кроме того, возникла давящая боль в левой половине грудной клетки и наблюдалось периодическое повышение АД в пределах значений, соответствующих 1-й степени артериальной гипертонии. На ЭКГ отклонения от нормы не наблюдались, тропонин в сыворотке крови не обнаружен, что позволило исключить острый коронарный синдром. При лабораторном обследовании также был выявлен тромбоцитоз (572×109/л, норма 150–400×109/л), повышение уровня аланинаминотрансферазы (АлАТ) (88,1 Ед/л, норма 0,0–41,0 Ед/л), ферритина (1046 нг/мл), снижение содержания СРБ (16,3 мг/л).
При неврологическом осмотре выявлено: мышечная сила — 2 балла в нижних конечностях и 3 балла в верхних конечностях по 5-балльной шкале, глубокие рефлексы снижены, более выраженное снижение — в нижних конечностях. Исследование спинномозговой жидкости (СМЖ): цитоз 13×106/л (норма 0,0–4,0×109/л), белок 2,49 г/л (норма 0,15–0,45 г/л). Таким образом, учитывая прогрессирующую двигательную слабость восходящего характера с развитием тетрапареза, снижение глубоких сухожильных рефлексов, умеренный плеоцитоз и повышение уровня белка в СМЖ — диагностические критерии СГБ, был установлен диагноз [1]. В пользу диагноза СГБ также свидетельствовали симметричность поражений и наличие боли [2]. Было начато лечение внутривенным иммуноглобулином (ВВИГ) в дозе 0,4 г/кг в сутки в течение 5 дней.
На 3-й день от начала терапии ВВИГ появилась осиплость голоса без нарастания одышки, но улучшились значения лабораторных показателей: нормализация содержания CРБ (1,0 мг/л), повышение уровня лимфоцитов (1,02×109/л). На КТ органов грудной клетки — положительная динамика в виде значительного снижения плотности, уменьшения протяженности изменений в легких с наличием линейных консолидаций преимущественно в задних отделах легких, объем поражения уменьшился до 65%. После завершения курса терапии ВВИГ у пациента появились галлюцинации, дезориентация в пространстве и времени, дестабилизация гемодинамики с тахикардией 130 уд/мин, снижением АД до 65/30 мм рт. ст., тахипноэ (ЧДД 38 в минуту) с SpO2 68%, хрипы в легких, макрогематурия. Была начата инвазивная вентиляция легких (ИВЛ), инотропная поддержка допамином, норэпинефрином.
При исследовании газового состава артериальной крови выявлен метаболический ацидоз без респираторной компенсации: pH 7,13 (норма 7,35–7,45), HCO3– 14,1 ммоль/л (норма 21,0–28,0 ммоль/л), pCO2 44,0 мм рт. ст. (норма 32,0–48,0 мм рт. ст.). В коагулограмме — удлинение активированного частичного тромбопластинового времени (47,3 с, норма 28,6–38,2 с), протромбинового времени (16,7 с, норма 11,5–14,5 с), снижение протромбина (по Квику) (62%, норма <70%), нормальное содержание фибриногена (2,7 г/л), повышение уровня D-димера (2,91 нг/мл). Оценка по шкале диагностики диссеминированного внутрисосудистого свертывания (ДВС-синдрома) Международного общества тромбоза и гемостаза (ISTH, International Society of Thrombosis and Haemostasis) составила 5 баллов, что соответствовало диагнозу ДВС-синдрома. При интубации трахеи возникла кровоточивость слизистой ротоглотки, перешедшая в кровотечение, которое было остановлено передней тампонадой носа, применением этамзилата, транексамовой кислоты и неоднократными инфузиями свежезамороженной плазмы. В связи со значительной кровопотерей (снижение уровня гемоглобина с 123 г/л до 67 г/л) проводилась трансфузия эритроцитарной взвеси.
Также отмечалась задержка мочи с развитием острого почечного повреждения (ОПП), соответствующего II стадии (повышение уровня креатинина сыворотки крови в 2,1 раза по сравнению с исходным уровнем в течение 7 дней, с 66 мкмоль/л до 141 мкмоль/л), со значительным повышением уровня мочевины (36,6 ммоль/л, норма 3,0–9,2 ммоль/л), гиперкалиемией (6,1 ммоль/л, норма 3,5–5,0 ммоль/л), гипонатриемией (127 ммоль/л, норма 135–150 ммоль/л). Отмечались значительный лейкоцитоз (45,9×109/л) за счет нейтрофилов (41,6×109/л) с повышением уровня прокальцитонина до 1,2 нг/мл (норма 0,0–0,5 нг/мл), лейкоцитурия (76 в п/зр, норма0–5 в п/зр) и бактериурия (бактерии сплошь в п/зр, норма 0–2 в п/зр). В связи с наличием бактериальной инфекции заподозрен сепсис. Оценка по шкале SOFA составила 6 баллов, что делало правомочным диагноз сепсиса. Была начата терапия меропенемом с дальнейшим добавлением фосфомицина.
На фоне антибактериальной, инфузионной, трансфузионной терапии отмечалось улучшение состояния пациента, регресс лейкоцитурии, частичное восстановление функции почек (креатинин 41 мкмоль/л, скорость клубочковой фильтрации 123 мл / мин / 1,73 м2, мочевина 4,4 ммоль/л при сохранении задержки мочи), были прекращены ИВЛ и инотропная поддержка.
С 22-го дня от манифестации СГБ — повышение мышечной силы, сначала мышц верхних конечностей, затем нижних. На 46-й день была выполнена электронейромиография (ЭНМГ) (табл. 1), полученные данные соответствовали критериям диффузного первично-демиелинизирующего поражения периферических нервов с вторичным аксональным повреждением [9].
Проводилось восстановительное лечение (лечебная гимнастика). На 46-й день мышечная сила в левой верхней конечности — 3 из 5 баллов (максимальное снижение за время заболевания до 2 баллов), в правой — 2 из 5 баллов (максимальное снижение до 2 баллов), в нижних конечностях — 1 из 5 баллов (максимальное снижение до 0 баллов).
Клиническое наблюдение № 2
Пациент 58 лет был госпитализирован в инфекционное отделение с вероятным диагнозом COVID-19 (8-й день от начала симптомов). Первые симптомы заболевания — сухой кашель, одышка. На 5-й день — онемение нижних и верхних конечностей.
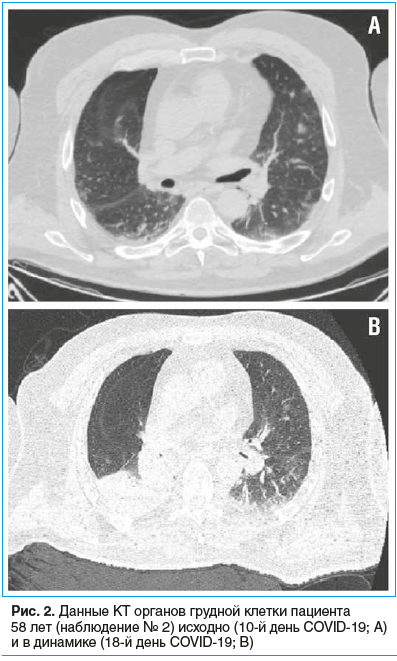
При поступлении: температура тела 36,5 °C, SpO2 при дыхании комнатным воздухом 97%, ЧДД 18 в минуту, ЧСС 100 в минуту, АД 140/80 мм рт. ст. ИМТ 38,1 кг/м2. Пациент имел в анамнезе артериальную гипертонию, принимал эналаприл. Неврологический осмотр: нарушение чувствительности по полиневритическому типу, сенситивная атаксия без изменений мышечной силы. На КТ органов грудной клетки определялись субплеврально расположенные участки интерстициальной инфильтрации по типу матового стекла, поражение легочной ткани составляло 15% (рис. 2А). РНК SARS-CoV-2 из материала орофарингеального мазка методом ПЦР-РВ не обнаружена.
В лабораторных показателях имелись следующие отклонения от нормальных значений: повышение уровней фибриногена (4,96 г/л), D-димера (1361,7 нг/мл),
ферритина (1252 нг/мл), ИЛ-6 (95,4 пг/мл, норма 0,0–3,3 пг/мл), АлАТ (57,2 Ед/л, норма 0,0–41,0 Ед/л), аспартатаминотрансферазы (АсАТ) (48,3 Ед/л, норма 0,0–38,0 Ед/л), тромбоцитоз (465×109/л). Начато лечение гидроксихлорохином, азитромицином, надропарином кальция.
На 5-й день от появления неврологических симптомов возникла слабость в нижних и верхних конечностях. Выявлено снижение мышечной силы как в верхних (4 из 5 баллов), так и в нижних (4 из 5 баллов) конечностях. При КТ головного мозга без внутривенного контрастирования патологических изменений не было за исключением умеренного расширения субарахноидальных пространств. Мышечная слабость быстро прогрессировала. На 7-й день мышечная сила в верхних и нижних конечностях составляла 1 из 5 баллов, глубокие рефлексы нижних и верхних конечностей были крайне слабыми, отсутствовали коленные и ахилловы рефлексы, выявлялось нарушение тактильной, болевой чувствительности по полиневритическому типу («перчатки» и «носки»), у пациента появилось ощущение неполного вдоха (SpO2 92% на фоне инсуффляции кислородом через носовые канюли со скоростью 10 л/мин). Выполнено исследование СМЖ: цитоз 106/л, белок 0,82 г/л. Таким образом, с учетом прогрессирующей мышечной слабости с развитием тетрапареза, снижения глубоких сухожильных рефлексов, повышения содержания белка в СМЖ без плеоцитоза (альбумино-цитологическая диссоциация), был установлен диагноз СГБ. Антитела к ганглиозидам (GM1, GM2, GM3, GDa, GDb, GT1b, GQ1b) отсутствовали. Возможности проведения ЭНМГ с целью уточнения варианта заболевания не было.
В течение двух дней после постановки диагноза — снижение кашлевого, небного рефлексов, прогрессирование нарушения чувствительности до уровня коленных суставов, снижение мышечной силы до 0/5 баллов в нижних и верхних конечностях, отсутствие глубоких рефлексов на нижних конечностях, возникновение дизартрии, прогрессирование дыхательной недостаточности (SpO2 90% на фоне инсуффляции кислородом через носовые канюли со скоростью 8 л/мин в прон-позиции, ЧДД 26 в минуту). У пациента развилось ОПП, соответствующее III стадии (повышение уровня креатинина сыворотки крови в 4,6 раза по сравнению с исходным уровнем в течение 7 дней, с 82,4 мкмоль/л до 381,0 мкмоль/л), с повышением уровня мочевины до 15,2 ммоль/л. Отмечалось нарастание уровня фибриногена (5,9 г/л), ЛДГ (434,8 Ед/л, норма 135–225 Ед/л), ферритина (1975 мкг/л), снижение содержания ИЛ-6 (19,1 пг/мл), СРБ был незначительно повышен (7,0 мг/л). При исследовании газового состава артериальной крови выявлен метаболический ацидоз без респираторной компенсации: pH 7,24, HCO3– 19,5 ммоль/л, pCO2 46,9 мм рт. ст.
Далее — резкое снижение SpO2 до 60%, дыхание Чейна — Стокса, дестабилизация гемодинамики (АД 70/50 мм рт. ст.). Потребовалось проведение ИВЛ, инотропной поддержки норэпинефрином. Было начато лечение СГБ плазмообменом. Оба метода лечения СГБ — ВВИГ и плазмообмен — были доступны, и для них не было противопоказаний. Однако, принимая во внимание значительное нарушение функции почек, в данной клинической ситуации предпочтительным казался плазмообмен (выполнено 5 сеансов).
Повторная КТ органов грудной клетки: ателектаз нижней доли правого легкого, положительная динамика в виде субтотального регресса двусторонней полисегментарной вирусной пневмонии (рис. 2B). В общем анализе крови — лейкоцитоз (22,8×109/л), преимущественно за счет нейтрофилов (20,4×109/л). Был диагностирован диффузный двусторонний эндобронхит, начата антибактериальная терапия эртапенемом. Неоднократно рецидивировала фебрильная лихорадка (40,0 °C), которую не удавалось снизить антипиретическими препаратами; для достижения управляемой нормотермии применялся аппарат Arctic Sun.
Несмотря на проводимую терапию, существенно возрос уровень креатинина (697 мкмоль/л) на фоне олигурии, СРБ (415,2 мг/л), в общем анализе крови — тромбоцитопения (81×109/л), лейкоцитоз (46,9×109/л) за счет нейтрофилов (45,1×109/л), лимфоцитопения (0,89×109/л). При УЗИ органов брюшной полости выявлена гепатомегалия. Прокальцитонин был значительно повышен (16,2 нг/мл). По результатам микробиологического исследования бронхоальвеолярного лаважа — рост полирезистентной к антибактериальным препаратам Klebsiella pneumoniae, крови — рост K. pneumoniae, Enterococcus faecalis. Тестирование по шкале SOFA показало 14 баллов, что соответствовало диагнозу сепсиса. Была осуществлена коррекция антибактериальной терапии с заменой ранее назначенных препаратов на полимиксин В, фосфомицин и тигециклин, на фоне которой произошло снижение лейкоцитоза до 13,6×109/л, СРБ до 24,5 мг/л, содержания креатинина до 338 мкмоль/л, но нарастание уровня ферритина >2000 нг/мл, АсАТ до 1077 Ед/л, АлАТ до 456,9 Ед/л. На 18-й день от появления симптомов СГБ на фоне возрастающей потребности в инотропной поддержке возникла фибрилляция желудочков и наступила смерть.
Обсуждение
В обоих клинических наблюдениях имелись типичные проявления COVID-19: респираторные симптомы (одышка, сухой кашель), лимфоцитопения, интерстициальная пневмония с изменениями легочной ткани по типу матового стекла. Пациенты — мужчины 58 лет, что характерно для случаев СГБ, развившихся на фоне COVID-19 (преобладающий возраст больше 50 лет, средний возраст 58,7 года). Интервал от 5 до 13 дней от появления первых симптомов COVID-19 до манифестации СГБ схож с интервалом при СГБ, возникающем после других инфек-ций [2, 11]. На фоне симптомов СГБ определялся тромбоцитоз, вероятно, как реакция на инфекцию. У наших пациентов СГБ протекал более тяжело — им потребовалось проведение ИВЛ, у обоих развились сепсис и ОПП, приведшие к смерти одного из пациентов. В первом клиническом случае цитоз в СМЖ составлял более 5×106/л, но менее 50×106/л (13×106/л), что редко встречается при СГБ как на фоне COVID-19 (6%), так и после других перенесенных инфекций (15%), но не исключает данного диагноза [12].
Антитела к ганглиозидам могут быть связаны с различными формами СГБ [3]. Однако лабораторное тестирование на антитела к ганглиозидам, отличным от GQ1b (ассоциированы с синдромом Миллера — Фишера, являющегося вариантом СГБ), обычно не проводится из-за ограниченной клинической применимости. Безусловно, столкнувшись с новым заболеванием, COVID-19, развитием на его фоне СГБ и неполным пониманием патогенеза обоих состояний, мы предположили, что продукция антител может отличаться от таковой в тех случаях, когда СГБ развивается после иных инфекций. Согласно данным J.B. Caress et al. [2] антитела к ганглиозидам отсутствовали у 15 из 17 пациентов. В нашем случае определение антител к ганглиозидам выполнялось одному пациенту и они не были обнаружены.
Заключение
Недостатком обследования наших пациентов является невыполнение ЭНМГ и определения антител к ганглиозидам у второго пациента, отсутствие исследования СМЖ на SARS-CoV-2 у обоих пациентов, что позволило нам установить точный вариант заболевания лишь у одного пациента и ограничило в понимании патогенеза СГБ при COVID-19. Однако представленные нами наблюдения будут вкладом в накопление данных и помогут при проведении дополнительных исследований.
.
Информация с rmj.ru





