Содержание статьи
Роль цитокинов и факторов роста в формировании и
прогрессировании рефлюкс-нефропатии у детей
И. В. Зорин, доктор медицинских наук
А. А. Вялкова, доктор медицинских наук, профессор
ГБОУ ВПО ОрГМУ МЗ РФ, Оренбург
В последнее десятилетие пристальное внимание в механизмах прогрессирования
хронических заболеваний почек уделяется цитокинам и факторам роста [1–7].
Цитокины — это продуцируемые клетками белково-пептидные факторы,
осуществляющие короткодистантную регуляцию межклеточных и межсистемных
взаимодействий. Цитокины определяют выживаемость клеток, стимуляцию или
ингибирование их роста, дифференцировку, функциональную активацию и апоптоз
клеток [8, 9]. Цитокины — гормоноподобные молекулы, действие которых на
клетку-мишень опосредуется высокоспецифичными высокоаффинными мембранными
рецепторами [10]. В отличие от классических гормонов большинство цитокинов
является молекулами локального (паракринного) действия. Они продуцируются и
утилизируются клетками, находящимися в тесной близости. Возможно и аутокринное
действие цитокинов, т. е. действие на ту же клетку, которая секретировала данный
цитокин. После выделения клетками-продуцентами цитокины имеют короткий период
полувыведения из кровотока. До 50% циркулирующих цитокинов интернализуется в
течение 30 минут. Выведение катаболизированных цитокинов из организма
осуществляется печенью и почками [11].
К системе цитокинов в настоящее время относят около 200 индивидуальных
полипептидных веществ [12]. Среди всех известных к настоящему времени
секретируемых клетками регуляторных факторов две группы цитокинов являются
наиболее хорошо изученными и в связи с этим наиболее часто используемыми в
диагностических целях. Это факторы роста и цитокины иммунной системы [13].
Действие цитокинов и факторов роста тесно связано с физиологическими и
патофизиологическими реакциями организма. При этом происходит модуляция как
локальных, так и системных механизмов защиты. Одной из важнейших функций системы
цитокинов и факторов роста является обеспечение согласованного действия
иммунной, эндокринной и нервной систем в ответ на стресс [14]. Усиление
продукции определенных цитокинов воспаления или факторов, стимулирующих рост
лимфоцитов, может лежать в основе некоторых заболеваний. В то же время снижение
уровня ряда цитокинов и факторов роста также способно провоцировать заболевание
[15–18].
Поскольку цитокины и факторы роста являются локальными медиаторами, более
целесообразно измерять их уровни в соответствующих тканях после экстракции
тканевых протеинов или в естественных жидкостях, например, в слезе, смывах из
полостей, моче, спинномозговой жидкости и т. д. Уровни цитокинов и факторов
роста в сыворотке или других биологических жидкостях отражают текущее состояние
работы иммунной системы, т. е. синтез цитокинов клетками организма in vivo
[19–22].
При оценке уровней цитокинов и факторов роста необходимо помнить, что
цитокины являются антигеннеспецифическими факторами. Поэтому специфическая
диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью
определения уровня тех или иных цитокинов невозможна [1]. Тем не менее, изучение
уровней цитокинов и факторов роста позволяет получить информацию о
функциональной активности различных типов иммунокомпетентных клеток; о тяжести
воспалительного процесса, его переходе на системный уровень и прогнозе; о
соотношении процессов активации Т-хелперов 1-го и 2-го типов, что очень важно
при дифференциальной диагностике ряда инфекционных и иммунопатологических
процессов; о стадии развития ряда аллергических и аутоиммунных заболеваний [2,
8, 12]. Кроме того, определение уровней цитокинов и факторов роста используется
при применении новых иммуномодулирующих препаратов на основе рекомбинантнных
цитокинов и их антагонистов для изучения фармакокинетики этих препаратов, а
также их способности индуцировать синтез других цитокинов [23, 24].
Материалы и методы исследования
Цель исследования — оценить роль цитокинов и факторов роста в формировании и
прогрессировании рефлюкс-нефропатии (РН) у детей.
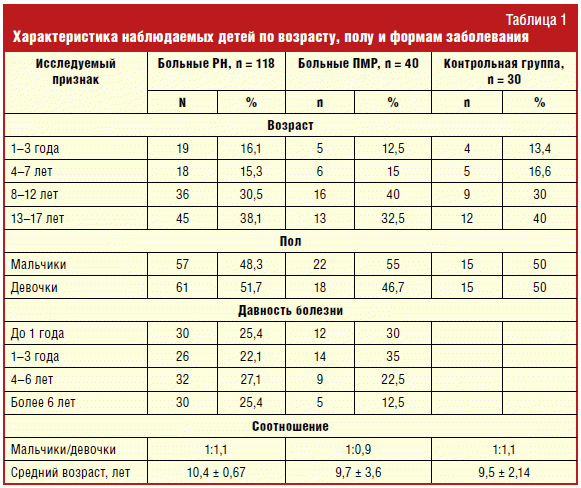
Проведено обследование 188 детей, в том числе 118 детей с РН на разных
стадиях интерстициального фиброза; 40 пациентов с пузырно-мочеточниковым
рефлюксом (ПМР) без признаков тубулоинтерстициального поражения почек (ТИПП), 30
детей контрольной группы (табл. 1).
Критерии включения пациентов в клиническое обследование:
- добровольное информированное согласие родителей ребенка на участие в
клиническом обследовании; - возраст пациентов от 1 года до 17 лет включительно;
- наличие верифицированных диагнозов по международным критериям: ПМР
(комитет по интернациональному изучению пузырно-мочеточникового рефлюкса,
1981), РН (J. M. Smellie, 1985) [25].
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом обследовании;
- двусторонняя РН;
- двусторонний ПМР;
- ХБП III–V (С3-С5).
В результате проведенного обследования выделены следующие группы клинического
наблюдения:
1) дети с ПМР без признаков ТИПП (n = 40);
2) дети с рефлюкс-нефропатией А (n = 30);
3) дети с рефлюкс-нефропатией В (n = 30);
4) дети с рефлюкс-нефропатией С (n = 30);
5) дети с рефлюкс-нефропатией D (n = 28).
Контрольную группу составили условно здоровые дети (n = 30).
При постановке диагноза РН использована классификация, предложенная J. M.
Smellie, основанная на степени нефросклероза, верифицированная по результатам
проведенной нефросцинтиграфии:
- А — наличие не более 2 очагов нефросклероза;
- В — выявление более 2 очагов нефросклероза с сохранением участков
неизмененной паренхимы; - С — генерализованные изменения почечной паренхимы, уменьшение почки в
размерах; - D — конечная стадия сморщивания почки, с сохранением менее 10%
функционирующей паренхимы [25].
Диагноз ПМР верифицировался на основании критериев, разработанных Комитетом
по интернациональному изучению пузырно-мочеточникового рефлюкса в 1981 г. по
степени заброса рентгеноконтрастного вещества и дилатации чашечно-лоханочной
системы почек [25].
Клинико-параклиническое обследование детей проводилось в ГБУЗ ГКБ № 6 г.
Оренбурга.
Нефросцинтиграфия, позволившая верифицировать степени рефлюкс-нефропатии,
проводилась на базе отделений радиоизотопной диагностики ГБУЗ Оренбургская ОКБ.
Всем детям проводилось определение в моче, экскретируемой за 24 часа,
цитокинов интерлейкина-1 (ИЛ-1), интерлейкина-6 (ИЛ-6), интерлейкина-8 (ИЛ-8),
интерлейкина-10 (ИЛ-10), факторов роста: фактора некроза опухоли-α (ФНО-α),
трансформирующего фактора роста-β (ТФР-β). Сбор мочи проводился на общем режиме
в течение суток; забор образцов, по 15 мл каждый, осуществляется из общего
объема после измерения суточного диуреза. Образцы мочи хранились при –20 °C до
проведения анализа. Для измерения уровней изучаемых цитокинов и факторов роста
использовались наборы для иммуноферментного анализа: «The BioSource Human IL-1α
ELISA», «The BioSource Human IL-6 ELISA», «The BioSource Human IL-8/NAP-1 ELISA»,
«The BioSource Human IL-10 ELISA», «The BioSource Human TNF-α ELISA», «The
BioSource Human TGF-β1 ELISA» (Biosource, США). Выполнение исследований методом
иммуноферментного анализа (ИФА) проводилось на многофункциональном анализаторе «Clima»
(Финляндия).
Всем детям проведена оценка функционального состояния почек по пробам Реберга
с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых
кислот, аммиака. Верификация хронической болезни почек (ХБП) проводилась на
основании критериев NKF/КDOQI (National Kidney Foundation/Kidney Disease
Outcomes Quality Initiative) [26, 27].
Статистическая обработка материала произведена путем вычисления средней
арифметической (М), ошибки средней (m) с помощью биометрических методов анализа,
коэффициента Стьюдента (t) с последующим нахождением уровня достоверности
различий (р) по таблицам. Достоверным считали различие при р < 0,05.
Результаты исследования
При сравнении результатов суточной экскреции с мочой цитокинов и факторов
роста больных с ПМР без признаков нефросклероза, детей с рефлюкс-нефропатией на
разных стадиях ТИПП установлены существенные различия и тенденции выделения
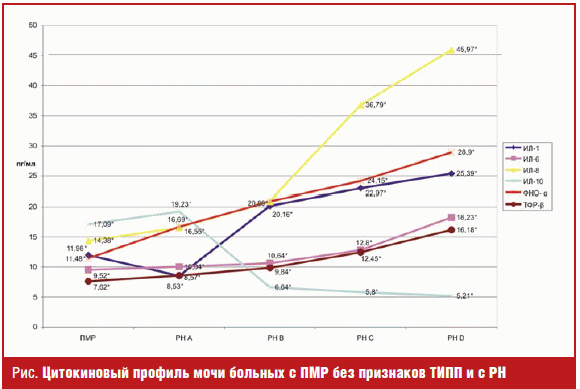
интерлейкинов у пациентов всех сравниваемых групп (рис.).
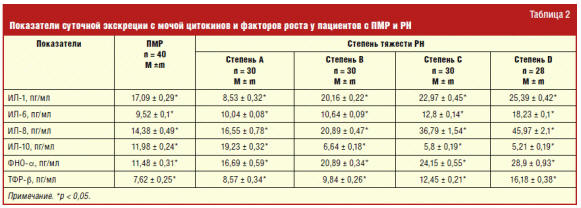
Нами доказаны существенные различия (p < 0,001) суточной экскреции с мочой ИЛ-1 у детей с ПМР без признаков нефросклероза и у пациентов на разных стадиях прогрессирования РН. По мере формирования РН происходит снижение суточной экскреции с мочой ИЛ-1. Так, у пациентов с ПМР без признаков склерозирования тубулоинтерстициальной ткани почек уровень суточной экскреции с мочой ИЛ-1 составил 17,09 ± 0,29 пг/мл, в то время как у больных с РН А он был 8,53 ± 0,32 пг/мл. По мере прогрессирования РН происходит увеличение суточной экскреции с мочой ИЛ-1, составляя у детей с РН D 25,39 ± 0,42 пг/мл.
Нами установлены различия (p < 0,001) суточной экскреции с мочой ИЛ-6 у детей с ПМР без признаков нефросклероза и пациентов с РН на разных стадиях ТИПП. При формировании склеротических изменений в почках у детей с ПМР происходит увеличение продукции ИЛ-6, что доказывается результатами суточной экскреции с мочой этого интерлейкина у детей с ПМР (9,52 ± 0,1 пг/мл) и РН А (10,04 ± 0,08 пг/мл). По мере прогрессирования ТИПП доказано увеличение продукции ИЛ-6 у пациентов с РН.
Установлено, что у детей из группы с ПМР без признаков нефросклероза уровень
суточной экскреции с мочой ИЛ-8 был ниже (14,38 ± 0,49 пг/мл), чем у пациентов с
начальными признаками ТИПП (РН А — 16,55 ± 0,78 пг/мл). По мере прогрессирования
ТИПП, что соответствует стадиям РН, установлено дальнейшее увеличение суточной
экскреции с мочой ИЛ-8.
Доказано, что по мере формирования склеротических изменений в почках у
пациентов с ПМР происходит увеличение продукции и экскреции с мочой ИЛ-10. Так,
у детей с ПМР уровень суточной экскреции с мочой ИЛ-10 составлял 11,98 ± 0,24 пг/мл,
в то время как у пациентов с РН А, то есть начальной стадией ТИПП, он составлял
19,23 ± 0,32 пг/мл. По мере прогрессирования ТИПП отмечалось снижение экскреции
в суточном объеме мочи ИЛ-10.
При сравнении результатов суточной экскреции с мочой факторов роста больных с
ПМР без признаков ТИПП, детей с РН на разных стадиях ТИПП установлены
статистически значимые различия экскреции факторов роста у пациентов
сравниваемых групп.
Нами доказаны существенные различия (p < 0,001) суточной экскреции с ФНО-α у детей с ПМР без признаков нефросклероза и у пациентов на разных стадиях прогрессирования РН. По мере формирования, а затем прогрессирования ТИПП происходит увеличение суточной экскреции с мочой ФНО-α. Так, у пациентов с ПМР без признаков ТИПП уровень суточной экскреции с мочой ФНО-α составил 11,48 ± 0,31 пг/мл, в то время как у больных с начальными признаками ТИПП (РН А) он был 16,69 ± 0,59 пг/мл. По мере прогрессирования ТИПП у пациентов с РН показатели суточной экскреции с мочой ФНО-α существенно увеличивались и составляли у детей с РН D 28,9 ± 0,93 пг/мл.
Нами установлены различия (p < 0,001) суточной экскреции с мочой ТФР-β у детей с ПМР без признаков ТИПП и пациентов с РН на разных стадиях прогрессирования ТИПП. При формировании ТИПП у детей с ПМР происходит увеличение продукции ТФР-β, что доказывается результатами суточной экскреции с мочой этого фактора роста у детей с ПМР (7,62 ± 0,25 пг/мл) и РН А (8,57 ± 0,34 пг/мл). По мере прогрессирования ТИПП доказано увеличение продукции ТФР-β у пациентов с РН (табл. 2).
Обсуждение
В результате проведенного исследования нами установлен разнонаправленный
характер экскреции цитокинов и факторов роста у детей с РН.
При формировании РН происходит увеличение продукции и экскреции таких
цитокинов, как ИЛ-10, ИЛ-6, ИЛ-8, факторов роста ФНО-α, ТФР-β. В то же время
установлено снижение выработки и экскреции с мочой ИЛ-1.
При прогрессировании РН происходит увеличение продукции и экскреции цитокинов
ИЛ-1, ИЛ-6, ИЛ-8, факторов роста ФНО-α, ТФР-β при снижении выработки и экскреции
с мочой ИЛ-10.
Анализ суточной экскреции с мочой цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10) и
факторов роста (ФНО-α, ТФР-β) свидетельствует о преобладании продукции и
экскреции провоспалительных, просклеротических цитокинов и факторов роста над
противовоспалительными, что подтверждает превалирование процесса фиброгенеза над
воспалением по мере прогрессирования РН [28–32].
Литература
-
Ваганова Т. В. Клинико-диагностическое значение вазоактивных
систем при нефропатиях у детей. Автореф. дис. … канд. мед. наук. Томск, 2007.
22 с. -
Демьянов А. В., Котов А. Ю. Диагностическая ценность исследования
уровней цитокинов в клинической практике // Цитокины и воспаление. 2003. № 3.
С. 20–35. -
Кальметьева Л. Р. Роль молекулярных медиаторов в патогенезе
патологии почек у детей // Цитокины и воспаление. 2011. Т. 10. № 4. С.
130–135. -
Маянский А. Н. Цитокины и медиаторные функции уроэпителия в
воспалительных реакциях мочевыводящей системы // Цитокины и воспаление. 2003.
№ 4. С. 3–9. -
Ратнер М. Я. Современные представления о значении медиаторов в
патогенезе фиброза почечного интерстиция // Тер. архив. 1997. № 12. С. 87–88. -
Fliser D., Kollerits В., Neyer U. et al. Fibroblast growth factor
23 (FGF23) predicts progression of chronic kidney disease: the Mild to
Moderate Kidney Disease (MMKD) Study // J Am Soc Nephrol. 2007. Vol. 18. P.
2600–2608. -
Klahr S., Morrissey J. J. The role of vasoactive compounds,
growth factors and cytokines in the progression of renal disease // Kidney Int
Suppl. 2000. V. 75. P. S7–14. -
Кетлинский С. А., Симбирцев А. С. Цитокины. СПб: Фолиант, 2008.
С. 23. -
Козлов В. А. Некоторые аспекты проблемы цитокинов // Цитокины и
воспаление. 2002. № 1. С. 5–8. -
Симбирцев А. С. Цитокины: классификация и биологические функции
// Цитокины и воспаление. 2004. № 2. С. 16–22. - The Cytokine Handbook/Ed. A. W. Thomson and M. T. Lotze. London, San Diego:
Academic Press, 2003. 56 p. -
Славянская Т. А., Сепиашвили Р. И. Роль цитокинов в
иммунопатологии // Аллергология и иммунология. 2004. Т. 5, № 1. С. 42. -
Burton C. Y., Combe C., Walls J., Harris K. P. Secreciуn of
chemokins and cytokins by human tubular epithelial cells in response to
proteins // Nephrol. Dial. Transplant. 1999. Vol. 14. № 11. P. 2628–2633. -
MacRae V. E., Wong S. C., Farquharson C. Cytokine actions in
growth disoders associated with pediatric chronic inflammatory diseases (review)
// Int. J Mol Med. 2006. Vol. 18. P. 1011–1018. -
Nairn J., Hodge G., Henning P. Intracellular cytokines in
peripheral blood leucocytes in children with chronic renal failure //
Pediatrics Nephrology. 2006. Vol. 21. P. 251–256. -
Ninan G. K., Jutley R. S., Eremin O. Urinary cytokines as markers
of reflux nephropathy // J Urol. 1999. V. 162, № 5. P. 1739–1742. -
Кучеренко А. Г., Паунова С. С., Смирнов И. Е. и др. Цитокины при
некоторых формах обструктивных уропатий у детей // Вопросы современной
педиатрии. 2004. № 2. С. 82–83. -
Маянский А. Н. Цитокины и медиаторные функции уроэпителия в
воспалительных реакциях мочевыводящей системы // Цитокины и воспаление. 2003.
№ 4. С. 3–9. -
Смирнов И. Е., Хворостов И. Н. Цитокины и апоптоз при
обструктивных уропатиях у детей // Российский педиатрический журнал. 2007. №
6. С. 31–35. -
Хворостов И. Н., Зоркин С. Н., Смирнов И. Е. Значение определения
уровня цитокинов при обструктивных уропатиях у детей // Вестник Волгоградского
медицинского университета. 2005. № 2 (14). С. 45–49. -
Демьянов А. В., Котов А. Ю. Диагностическая ценность исследования
уровней цитокинов в клинической практике // Цитокины и воспаление. 2003. № 3.
С. 20–35. -
Topaloglu Dr. R. Progression to renal failure // Turkish Journal
of Pediatrics. 2005. Vol. 47. P. 3–8. -
Segerer S., Nelson P. J., Schlondorff D. Chemokines, chemokine
receptors, and renal disease: From basic science to pathophysiologic and
therapeutic studies // J Am Soc Nephrol. 2000; 11, p. 152–176. -
Wong W., Singh A. K. Urinary cytokines: clinically useful markers
of chronic renal disease progression? // Current Opinion in nephrology and
hypertension. 2001. V. 6. P. 807–811. -
Smellie J., Normand C. Bacteriuria, reflux and renal scarring //
Arch Dis Child. 1975. V. 50. P. 581–583. - K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation
Classification Stratification // A J K D. 2002. № 39 (2 Suppl. 1). P. 1–266. - National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative
clinical practice guidelines for chronic kidney disease in children and
adolescents: evaluation, classification, and stratification // Pediatrics.
2003. Vol. 111. P. 1416–1421. -
Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б.
Интерлейкины и фактор некроза опухоли у детей с рефлюкс-нефропатией // Вопросы
современной педиатрии. 2003. Т. 2, № 1. С. 267–268. -
Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б.,
Ревенкова JI. A., Гольцова H. JI. Цитокины в формировании
рефлюкс-нефропатии у детей // Нефрология и диализ. 2003. Т. 5, № 3. С.
207–211. -
Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б., Цукерман
Л. И., Хворостов И. Н. Факторы роста при рефлюкс-нефропатии у детей //
Вопросы современной педиатрии. 2004. Т. 3, № 2. С. 85. -
Паунова С. С. Патогенетические основы нефросклероза // Нефрология
и диализ. 2005. № 2. С. 130–135. -
Паунова С. С. Патогенетические основы формирования
рефлюкс-нефропатии у детей. Автореф. дис. … докт. мед. наук. М., 2004. 25 с.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru






