Содержание статьи
Введение
Ежегодно более 300 млн пациентов во всем мире подвергаются различным оперативным вмешательствам. Несмотря на большое количество методик стратификации риска и прогнозирования периоперационных осложнений, их доля по-прежнему остается высокой даже при плановых хирургических вмешательствах [1, 2]. В последние десятилетия отмечается увеличение процента людей пожилого и старческого возраста в популяции. Распространенность операций среди пациентов старших возрастных групп превышает таковую у более молодых пациентов в среднем в 4 раза [3], при этом частота выполнения хирургических вмешательств возрастает ежегодно [4]. Исход оперативного лечения определяется рядом факторов, среди которых срочность выполнения операции, особенности хирургической техники, изменения, развивающиеся в организме под воздействием основного заболевания и сопутствующей патологии. С возрастом прогноз ухудшается [5, 6]. Это связано с изменяющимся функциональным состоянием организма под влиянием возраст-ассоциированных процессов, хронической патологии, медикаментозной терапии, что суммарно оказывает значимое влияние на переносимость операции. Возраст пациента считается важным фактором риска развития периоперационных осложнений и летальности, однако более значимой в плане прогноза является именно степень изменения исходной функциональной активности организма и возможность активации его резервов в ответ на операционное вмешательство и связанные с ним изменения гомеостаза [7, 8].
Важным направлением клинической геронтологии является улучшение качества жизни пациентов старших возрастных групп. Зачастую обширные хирургические вмешательства и развивающиеся после них осложнения приводят к увеличению зависимости от посторонней помощи, вплоть до полной потери мобильности, что дополнительно увеличивает риск депрессии, усугубляет степень выраженности основных гериатрических синдромов [8, 9]. В данном аспекте крайне важным является поиск методов, способных в предоперационном периоде дать достаточно надежный прогноз вероятности появления периоперационных осложнений и степени их тяжести, риска развития летального исхода.
В данной статье проведены анализ методик, использующихся для стратификации риска периоперационных осложнений, и оценка возможности и перспектив их использования для пациентов старших возрастных групп.
Основные механизмы развития периоперационных осложнений
Вне зависимости от вида операции наиболее распространенными осложнениями периоперационного периода являются сердечно-сосудистые (нестабильность артериального давления, нарушения ритма сердца, инфаркт миокарда), вентиляционные (дыхательная недостаточность, особенно при обширных вмешательствах, торакальных операциях), инфекционные осложнения [10].
Риск их возникновения, тяжесть течения определяются рядом факторов, которые могут быть разделены на 3 группы [11]:
Факторы, определяющие исходное состояние организма пациента перед операцией (вид основного заболевания и степень его прогрессии, наличие и степень выраженности сопутствующей патологии, принимаемые лекарственные препараты, функциональное состояние организма).
Факторы, непосредственно связанные с операцией (объем и техника хирургического вмешательства, особенности анестезии, срочность и длительность операции, объем кровопотери).
Особенности изменения метаболизма под воздействием операционного стресса.
Несмотря на неоспоримую важность второй группы факторов, особенности, связанные с исходным статусом организма больного и степенью активации функциональных резервов под влиянием операционного стресса, остаются ведущими в патогенезе осложнений, их значимость возрастает у пациентов старших возрастных групп [5–7]. В связи с этим необходим поиск методик, способных дать максимально определенный, персонализированный подход к прогнозированию риска осложнений плановых операций у пациентов пожилого и старческого возраста. Это позволит уточнить показания к оперативному лечению, при необходимости применить дополнительные меры предоперационной подготовки — преабилитацию, благодаря этому уменьшить длительность пребывания пациента в стационаре, улучшить качество его жизни, снизить риск развития фатальных осложнений.
Одним из ключевых факторов, связанных с периоперационными осложнениями, является особенность реакции организма на операционный стресс. Операционный стресс можно определить как комплекс изменений, происходящих в организме в ответ на операционную травму [12], что подразумевает ряд взаимосвязанных нейроэндокринных, метаболических, иммунологических и гематологических реакций. Эти изменения, по сути, являются аллостатической реакцией, активным процессом адаптации посредством выработки медиаторов и изменения метаболизма, которые способствуют восстановлению и поддержанию гомеостаза [13]. В ответ на операционное повреждение происходит мобилизация стресс-реализующих систем организма [14], действие которых осуществляется за счет повышения активности гипоталамо-гипофизарно-надпочечниковой и симпато-адреналовой систем. Следствием является повышение концентрации основных гормонов стресса — кортизола и катехоламинов [15], степень увеличения концентрации которых коррелирует с тяжестью хирургического вмешательства [16]. К наиболее значимым с клинических позиций изменениям под влиянием операционного стресса можно отнести следующие: положительный инотропный эффект, централизацию кровообращения, периферическую вазоконстрикцию, увеличение объема циркулирующей крови, гиперкоагуляцию, гипергликемию, преобладание процессов катаболизма [12, 15]. Результатом являются повышение нагрузки на миокард, увеличение потребления кислорода органами и тканями, дистрофические изменения. Гиперпродукция катехоламинов и глюкокортикостероидов может привести к резкой централизации кровообращения и гипоперфузии и, как следствие, гипоксии органов и тканей, провоцирует накопление лактата, развитие метаболического ацидоза, повреждение клеточных мембран [17]. Поэтому важны не только своевременная и достаточно быстрая активация компенсаторно-приспособительных реакций организма в ответ на операционный стресс, но и их своевременное прекращение под воздействием стресс-лимитирующей системы. Она включает в себя совокупность центральных и периферических регуляторных механизмов, которые реализуются посредством увеличения продукции гамма-аминомасляной кислоты, серотонина, опиоидов, простагландинов, оксида азота [14].
Невозможность в достаточной степени перестроить метаболизм в ходе операции, адекватно ответить на возрастающие «запросы» (например, в результате хронических заболеваний, сопровождающихся нарушениями метаболизма, структурными изменениями внутренних органов) приводит к появлению неблагоприятных реакций — так называемых «критических инцидентов», результатом которых могут явиться различные по структуре и степени выраженности интра- и послеоперационные осложнения. Таким образом, важна степень мобилизации функциональных резервов организма под действием происходящих нейроэндокринных изменений. Несмотря на общность изменений, происходящих в организме под воздействием операционного стресса, степень активации функциональных резервных возможностей индивидуальна [18, 19]. Функциональный резерв — это уровень работы, которая может быть выполнена на нагрузке, уровень которой превышает привычную [20]. Показано, что сниженная физическая работоспособность взаимосвязана с уровнем смертности и частотой развития послеоперационных осложнений, увеличивает длительность восстановительного периода [21, 22].
Факторы, влияющие на течение периоперационного периода и развитие осложнений у больных старше 60 лет
Возраст-ассоциированные изменения организма в сочетании с имеющимися хроническими заболеваниями у пациентов старших возрастных групп могут значимо влиять на функционирование организма и, как результат, приводить к изменению ответной реакции на воздействие операционного стресса, недостаточной активации функциональных резервов. К ним относятся изменение состава тела, несоответствие энергетических ресурсов и потребности в энергии, дизрегуляция сигнальных систем поддержания гомеостаза [23, 24]. По мере старения отмечается прогрессирующее снижение чувствительности рецепторов гипоталамо-гипофизарной системы, уменьшение количества нейронов гипоталамуса, гиппокампа и лимбической системы, вследствие чего нарушается регуляция секреции надпочечников; возрастает уровень базального кортизола [25]. Согласно результатам проведенных исследований у пациентов старших возрастных групп выявляется более высокий уровень кортизола во время операции в сравнении с более молодыми больными [26]. С другой стороны, с возрастом уменьшается количество рецепторов к гамма-аминомасляной кислоте и серотонину, их секреция [27], что может способствовать более медленному и недостаточному вовлечению стресс-лимитирующих механизмов. У больных пожилого и старческого возраста чаще встречаются нарушения нутритивного статуса [28, 29]. Это приводит к уменьшению энергетического резерва, ухудшает процессы регенерации, способствует уменьшению синтеза митохондриальных белков, необходимых для аэробного метаболизма. Большему риску осложнений подвержены больные с синдромом старческой астении и преастенией [30].
Основные подходы к стратификации периоперационных рисков
Для прогнозирования риска развития периоперационных осложнений в настоящее время широко используются различные методики, большинство которых дает возможность изолированной оценки деятельности какого-либо органа или системы органов (например, эхокардиография и электрокардиография в покое и с нагрузкой, исследование функции внешнего дыхания, сцинтиграфия легких). Широкое распространение благодаря простоте и доступности в использовании получили прогностические шкалы и индексы (шкала РОSSUM и ее модификации, ASA, индексы Lee, Goldman), основанные на данных об имеющихся у пациента заболеваниях, возрасте и отдельных лабораторных показателях [31, 32]. Главным недостатком, снижающим их прогностическую ценность, является низкая взаимосвязь с функционированием организма при стрессе [33, 34]. Поставленным целям в большей степени отвечают функциональные тесты, которые дают информацию об уровне нагрузки, переносимой пациентом, что позволяет косвенно оценить функциональные резервы. Низкая функциональная активность, выявляемая при помощи индекса активности Duke (Duke Activity Status Index, DASI), коррелирует с уровнем послеоперационной летальности и показала прогностическую значимость для оценки риска развития инфаркта миокарда в раннем послеоперационном периоде и спустя 30 дней после операции [35]. Однако следует отметить, что интерпретация полученных с помощью данной методики результатов может быть ошибочной из-за неверной субъективной оценки пациентом своих физических возможностей. Более объективные данные можно получить при использовании теста с 6-минутной ходьбой [36, 37], однако на конечный результат могут оказывать влияние уровень мотивации пациента, особенности проведения инструктажа. Кроме того, данный тест позволяет оценить реакцию организма на нагрузку, близкую по уровню к физиологической.
Перспективным для комплексной оценки функционирования организма в различных условиях является кардиореспираторное нагрузочное тестирование (КАРЕН-тест). Данный метод позволяет провести одномоментную регистрацию большого количества показателей, характеризующих деятельность сердечно-сосудистой, дыхательной систем в покое, в условиях возрастающей нагрузки, а также в период восстановления [38]. В зависимости от имеющейся у пациента патологии возможно использование тредмила или велоэргометра, выбор протокола нагрузки (непрерывно возрастающая или ступенчатая) [39, 40]. В таблице 1
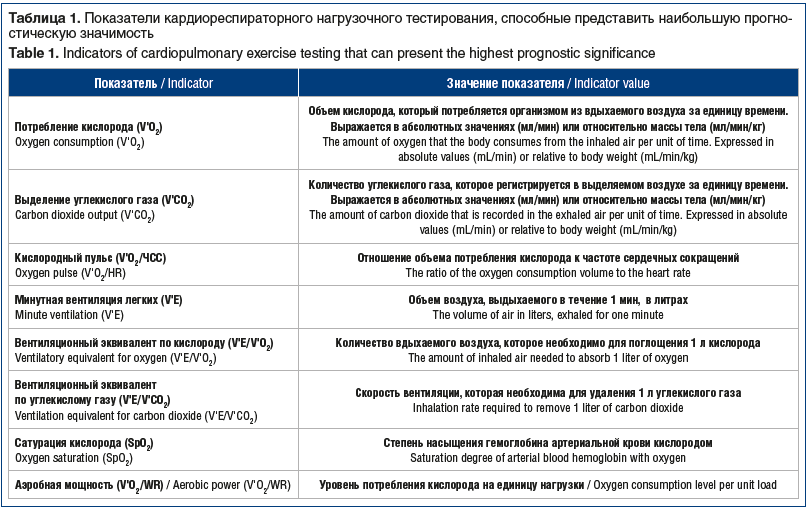
представлены показатели КАРЕН-теста, интерпретация которых может иметь наибольшую прогностическую значимость [38–40].
Оценка функциональных возможностей организма при помощи КАРЕН-теста для прогнозирования риска неблагоприятных событий периоперационного периода является патогенетически обоснованной. По мере нарастания нагрузки включаются адаптационные механизмы, происходит изменение метаболизма. Увеличиваются потребление кислорода органами и тканями, частота сердечных сокращений, происходит изменение сердечного выброса, вентиляционно-перфузионного соотношения, перераспределение кровотока, активация симпатической нервной системы. Регистрируется увеличение потребления кислорода и выделение углекислого газа в выдыхаемом воздухе. По мере истощения аэробных ресурсов начинается переход на анаэробный метаболизм, что позволяет поддерживать необходимую продукцию энергии [41], при этом регистрируется увеличение выделения углекислого газа по отношению к количеству потребляемого кислорода [38]. Этот момент называется порогом анаэробного окисления (анаэробным порогом, ПАНО). Согласно литературным данным уровень потребления кислорода на ПАНО менее 11 мл/мин/кг является предиктором высокого риска послеоперационных осложнений [42]. Отмечена также высокая прогностическая значимость уровня потребления кислорода на максимально достигнутой пациентом нагрузке (пиковое потребление кислорода, V’O2peak). В рекомендациях Американской коллегии торакальных хирургов уровень V’O2peak <10 мл/мин/кг расценивается как предиктор неблагоприятного исхода при резекционных операциях на легких [43]; при уровне V’O2peak <14 мл/мин/кг
отмечено значимое увеличение осложнений после трансплантации сердца [44].
Сниженный уровень V’O2peak показал свою взаимосвязь с риском развития послеоперационных осложнений и при других видах хирургических манипуляций. Согласно результатам метаанализа, проведенного в 2019 г. Kalesan et al. [45], имеется прямая взаимосвязь между уровнем работоспособности, значением V’O2peak и частотой развития периоперационных осложнений и летальности. Авторами было выделено 14 исследований, в которых пациентам в предоперационном периоде было выполнено кардиореспираторное нагрузочное тестирование. Общая численность обследуемых составила 1748 человек, возрастной диапазон — 32–75 лет. В последующем этим больным были проведены плановые хирургические операции различного профиля (абдоминальные, торакальные, сосудистые, гинекологические), в послеоперационном периоде оценивались летальность и появление осложнений в 30-дневный период. Больший уровень V’O2peak был тесно взаимосвязан с меньшим уровнем послеоперационной летальности и осложнений в течение 1 мес. после выполнения хирургического вмешательства. Полученные результаты согласуются с исследованиями Smith и et al. (2009) [46], Kumar et al. (2018) [47], Sheill et al. (2020) [48]. Исследования, оценивающие значимость влияния уровня V’O2peak на ПАНО, показывают неоднозначные результаты: от высокой прогностической роли [49] до отсутствия значимой взаимосвязи [35, 45], что может объясняться различиями анализируемых групп пациентов по возрастному показателю и требует проведения дальнейших исследований.
Заключение
Кардиореспираторное нагрузочное тестирование позволяет оценить реакцию организма на нагрузку и функциональные резервы, что дает возможность получить данные о состоятельности компенсаторно-приспособительных механизмов и в целом о функциональных возможностях организма пациента, а также уточнить прогноз послеоперационного исхода и лечения. Степень изменений метаболизма и вовлечения функциональных резервов, выявляемая при помощи КАРЕН-теста, коррелирует со степенью изменений организма в ходе операции, что подтверждается многочисленными исследованиями. Ценность полученных при кардиореспираторном нагрузочном тестировании результатов увеличивается для пациентов старших возрастных групп, имеющих полиморбидную патологию, возрастные изменения организма, т. к., в отличие от других методик, дает возможность объективной и комплексной оценки функционирования организма. Несмотря на большое количество исследований, посвященных применению и прогностической роли КАРЕН-теста, на данный момент отсутствуют четко определенные референсные значения получаемых результатов для пациентов старше 60 лет, что определяет перспективы проведения дальнейших исследований в этой области. Следует уделить дополнительное внимание прогностической возможности других показателей, регистрируемых при кардиореспираторном нагрузочном тестировании, которые в дальнейшем могут стать основой разработки диагностических алгоритмов, направленных на уточнение показаний к плановому оперативному лечению и стратификацию риска осложнений и летальности у пациентов старших возрастных групп.
Сведения об авторах:
Троцюк Дина Витальевна — аспирант кафедры организации здравоохранения и общественного здоровья ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет»; 308015, Россия, г. Белгород, ул. Победы, д. 85; ассистент кафедры внутренних болезней им. проф. Б.И. Шулутко ЧОУВО «СПбМСИ»; 195271, Россия, г. Санкт-Петербург, Кондратьевский пр., д. 72А; ORCID iD 0000-0002-0833-4385.
Медведев Дмитрий Станиславович — д.м.н., профессор, профессор кафедры ЛФК и спортивной медицины ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; заведующий отделом физиологической оценки и медицинской коррекции ФГУП «НИИ ГПЭЧ» ФМБА России; 192019, Россия, г. Санкт-Петербург, ул. Бехтерева, д. 1; ORCID iD 0000-0001-7401-258X.
Зарипова Зульфия Абдулловна — к.м.н., доцент, руководитель центра аттестации и аккредитации ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-2224-7536.
Чиков Александр Евгеньевич — к.б.н., доцент, заведующий лабораторией спортивной гигиены ФГУП «НИИ ГПЭЧ» ФМБА России; 192019, Россия, г. Санкт-Петербург, ул. Бехтерева, д. 1; ORCID iD 0000-0003-0860-9171.
Контактная информация: Троцюк Дина Витальевна, e-mail: dinatrotsyuk@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.03.2021, поступила после рецензирования 11.04.2021, принята в печать 28.04.2021.
About the authors:
Dina V. Trotsyuk — post-graduate student of the Department of Public Health Management, National Research University «Belgorod State University»; 85, Pobedy str., Belgorod, 308015, Russian Federation; Assistant Professor of the Department of Internal Diseases named after Prof. B.I. Shulutko, Saint-Petersburg Medico-Social Institute; 72A, Kondratievskii prospect, Saint-Petersburg, 195271, Russian Federation; ORCID iD 0000-0002-0833-4385.
Dmitriy S. Medvedev — Dr. of Sci. (Med.), Professor, Professor of the Department of Physical Therapy and Sports Medicine, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., Saint-Petersburg, 191015, Russian Federation; Head of the Department of Physiological Assessment and Medical Correction, Research Institute of Hygiene, Occupational Pathology and Human Ecology, of the Federal Medical-Biological Agency; 1, Bekhtereva str., Saint-Petersburg, 192019, Russian Federation; ORCID iD 0000-0001-7401-258X.
Zulfiya A. Zaripova — Cand. of Sci. (Med.), Associate Professor, Head of the Center for Certification and Accreditation, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., Saint-Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-2224-7536.
Alexander E. Chikov — Cand. of Sci. (Biology), Associate Professor, Head of the Laboratory of Sports Hygiene, Research Institute of Hygiene, Occupational Pathology and Human Ecology, of the Federal Medical-Biological Agency; 1, Bekhtereva str., Saint-Petersburg, 192019, Russian Federation; ORCID iD 0000-0003-0860-9171.
Contact information: Dina V. Trotsyuk, e-mail: dinatrotsyuk@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.03.2021, revised 11.04.2021, accepted 28.04.2021.
.
Информация с rmj.ru





