Содержание статьи
Резистентность Helicobacter pylori к антимикробным препаратам
по результатам бактериологического тестирования
В. И. Симаненков*, 1, доктор медицинских наук, профессор
Н. В. Захарова*, доктор медицинских наук, профессор
А. Б. Жебрун**, доктор медицинских наук, профессор, член-корреспондент РАН
А. В. Сварваль**, кандидат медицинских наук
И. В. Савилова*
Р. С. Ферман**
* ГБОУ ВПО СЗГМУ им. И. И. Мечникова, Санкт-Петербург
** НИИ ЭиМ им. Пастера, Санкт-Петербург
Эрадикация H. pylori у инфицированных пациентов, страдающих
хроническим гастритом, язвенной болезнью, функциональной диспепсией и другими
H. pylori-ассоциированными заболеваниями, является основной стратегией
предотвращения развития некардиального рака желудка [1]. В любой клинической
ситуации, при которой врач сомневается в необходимости диагностировать инфекцию
H. pylori и провести уничтожение микроорганизма, дополнительным и крайне
актуальным аргументом в пользу этих мероприятий должен стать профилактический
эффект эрадикации относительно возникновения рака желудка, особенно у пациентов
с отягощенным наследственным анамнезом [2].
H. pylori имеет широкий спектр чувствительности к антимикробным
препаратам. «Дикие» штаммы H. pylori чувствительны in vitro к
бета-лактамным антибиотикам (за исключением цефсулодина), макролидам,
нитроимидазолам, нитрофуранам, тетрациклинам, фторхинолонам, фосфомицину,
фениколам, аминогликозидам, хлорамфениколу, рифампицину и препаратам висмута
[3]. Однако далеко не все препараты используются в схемах эрадикации. Так,
применение хлорамфеникола ограничено из-за токсического действия (особенно на
костный мозг), аминогликозидов из-за особенностей фармакокинетики (они являются
катионными гидрофильными соединениями, которые плохо проникают через мембраны
путем пассивной диффузии и не всасываются из кишечника) [4]. В схемы эрадикации
входит лишь ограниченный набор препаратов (кларитромицин, амоксициллин,
метронидазол, тетрациклин, левофлоксацин и препараты висмута) [5].
Резистентность H. pylori к антимикробным препаратам является
определяющим фактором эффективности существующих режимов эрадикации
микроорганизма [6]. При резистентности к кларитромицину, превышающей 15–20%,
стартовая антихеликобактерная терапия не обеспечивает приемлемого уровня
эрадикации 85–90% [6].
Целью данной работы было получение данных о состоянии первичной
антибиотикорезистентности штаммов H. pylori, выделенных от пациентов в
Санкт-Петербурге.
Материал и методы исследования
Исследование по протоколу SHELF проводилось в Санкт-Петербурге с мая 2013 по
июнь 2014 года. Одобрение было получено в центральном и локальном научном
этическом комитете в соответствии с принципами Хельсинкской декларации. В
исследовании использовались гастробиоптаты пациентов, соответствующих следующим
критериям.
Критерии исключения:
1) пациенты, ранее получавшие антимикробную
терапию для эрадикации H. pylori;
2) пациенты, получавшие антибиотики из группы макролидов в течение одного года,
предшествовавшего данному исследованию;
3) пациенты, участвующие в любых других клинических исследованиях;
4) пациенты, получавшие ингибиторы протонного насоса и препараты висмута в
течение двух недель, предшествовавших данному исследованию;
5) больные, принимающие антибактериальную терапию на момент забора материала.
Критерии включения:
1) мужчины и женщины в возрасте от 18 до 65 лет;
2) пациенты с инфекцией H. pylori, подтвержденной быстрым уреазным
тестом гастробиоптата, полученного при проведении эзофагогастродуоденоскопии (ЭГДС);
3) решение врача в рамках рутинной клинической практики и диагноза пациента
провести ЭГДС с забором биоптата.
Во время ЭГДС у всех больных осуществлялся забор гастробиоптатов для
микробиологического исследования. Биопсийный материал помещался в пробирку типа
«эппендорф» со стерильным 20% раствором глюкозы и хранился до отправки в
лабораторию в условиях холодильника при +4 °C. В течение 2–4 часов
гастробиоптаты доставлялись в лабораторию для посева. Посевы осуществлялись в
соответствии с отработанной методикой культивирования [8].
В качестве основы питательной среды для выделения и культивирования H.
pylori использовался колумбийский агар. Каждый образец биопсии высевался
параллельно на две чашки Петри с агаром, содержащим антибиотики в следующих
концентрациях: ванкомицин в концентрации 6 мкг/мл, триметоприм, в концентрации 2
мкг/мл (растворяли в спирте) и амфотерицин В (или налидиксовую кислоту) в
концентрации 2–10 мкг/мл.
Инкубация посевов осуществлялась в микроаэрофильных условиях при содержании
кислорода около 5%. Для этих целей использовались анаэростаты системы GasPac100
c газогенерирующими пакетами типа GasPak (BBL CampyPak Plus Microaerophilic
System envelopes with Palladium Catalyst).
На кровяной питательной среде на 5–7 сутки H. pylori формировал
мелкие, круглые, гладкие, прозрачные, влажные колонии диаметром около 1 мм.
Колонии H. pylori, полученные в результате первичного посева
биопсийного материала, использовали для приготовления мазков, окраски их по
Граму и постановки уреазного теста.
Решение вопроса о принадлежности выделенной культуры к роду Helicobacter
выносили на основании характерной морфологии выделенных колоний, а также
набора тестов: морфологии культуры в мазке, окрашенном по Граму, и наличии
характерных биохимических свойств (способности к продукции уреазы). Типичные
клетки H. pylori при микроскопии имели вид тонких изогнутых
нежно-розовых палочек.
Антибиотикорезистентность выделенных штаммов H. pylori изучали,
используя метод серийных разведений, который основан на регистрации ингибиции
роста микроорганизма на питательном агаре, содержащем определенные концентрации
антибиотика. Определяли чувствительность штаммов H. pylori к
кларитромицину, амоксициллину, левофлоксацину, метронидазолу и тетрациклину.
Рабочие концентрации исследуемых антибактериальных препаратах в агаре были
следующими:
- амоксициллин — 0,25; 0,12; 0,06 мкг/мл;
- кларитромицин — 1,0; 0,5; 0,25; 0,12 мкг/мл;
- левофлоксацин — 2,0; 1,0; 0,5 мкг/мл;
- метронидазол — 16; 8; 4 мкг/мл;
- тетрациклин — 2,0; 1,0; 0,5 мкг/мл.
Среды и растворы антибактериальных препаратов готовили непосредственно перед
использованием.
На чашки Петри с ростом H. pylori добавляли по 1–2 мл стерильного
физиологического раствора и снимали бактериальную массу. Инокулюм наносили
бактериологической петлей на поверхность чашки Петри с селективной кровяной
средой с определенной концентрацией антибиотика, равномерно распределяя по
поверхности. Затем чашки Петри помещали в анаэростат и инкубировали при
температуре 37 °С в течение 3–5 суток. После окончания инкубации отмечали чашку
с концентрацией антибактериального препарата, вызывающей полное подавление роста
микробов. Контроль чистоты роста культуры оценивали по посеву на чашку Петри с
селективной кровяной средой без добавления антибиотиков.
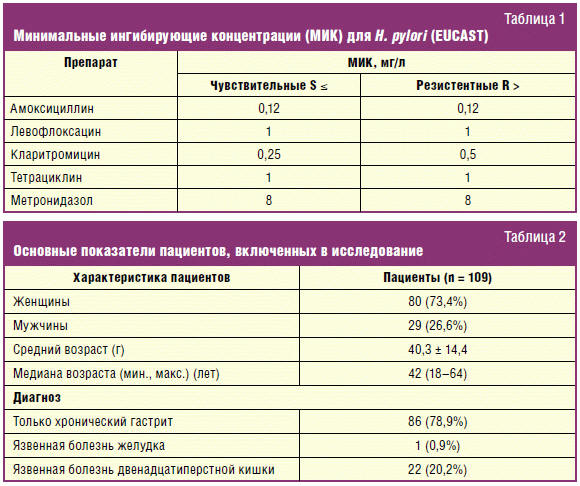
Данный метод позволил подразделить штаммы H. pylori на
чувствительные и устойчивые [9]. Критерии распределения штаммов по степени
чувствительности приведены в табл. 1.
На каждого пациента, гастробиоптат которого использовался в исследовании,
заполнялась индивидуальная регистрационная карта (ИРК), которая дублировалась в
базе данных Microsoft Access Database и содержала демографические,
анамнестические данные, результаты проведенных исследований.
Статистический анализ
Статистический анализ выполнялся с помощью программного пакета IBM® SPSS®
Statistics, версия 21.0.
Демографические и анамнестические показатели анализировались с помощью
методов описательной статистики. Для дихотомических показателей резистентности
были представлены 95% доверительные интервалы для долей резистентности к тому
или иному антибиотику. Подобный статистический анализ проводился в отношении
выявления наличия H. pylori и выявления резистентности к антибиотикам.
Результаты исследования
В исследовании использовались гастробиоптаты 109 пациентов в возрасте от 18
до 64 лет. Возраст, пол и диагноз пациентов представлены в табл. 2.
У пациентов были диагностированы различные заболевания, ассоциированные с
H. pylori. Наиболее частой нозологией являлся хронический гастрит — 78,9% (n
= 86). Язвенная болезнь двенадцатиперстной кишки (ДПК) диагностирована у 20,2% (n
= 22), а язвенная болезнь желудка — у 0,9% (n = 1).
Инфицирование H. pylori было подтверждено у всех пациентов уреазным
тестом. Бактериологическим методом микроорганизм выделен лишь у 56 пациентов,
что составило 51,4% (95% ДИ: 42,0%, 60,8%). Такой процент отражает технические
трудности, связанные с транспортировкой и культивированием микроаэрофильного
микроорганизма.
Чувствительность H. pylori к антимикробным препаратам удалось
определить у 48 выделенных штаммов. Из-за скудного роста культуры в 8 случаях
оценить антибиотикограмму было невозможно.
Таким образом, в анализ резистентности были включены 48 штаммов хеликобактера,
выделенных от 48 пациентов. Среди анализируемых изолятов H. pylori
штаммов, 17 (42,5%) были резистентны к метронидазолу, 13 (27,1%) — к
левофлоксацину, 12 (25%) — к кларитромицину. Кроме того, было выявлено 3 (6,3%)
штамма, устойчивых к амоксициллину. Все тестируемые штаммы были чувствительны к
тетрациклину. В случаях выявления резистентности к трем и более группам
антимикробных препаратов, штамм хеликобактера относили к полирезистентным. В
ходе исследования 5 (11,1%) микроорганизмов были полирезистентными (табл. 3).
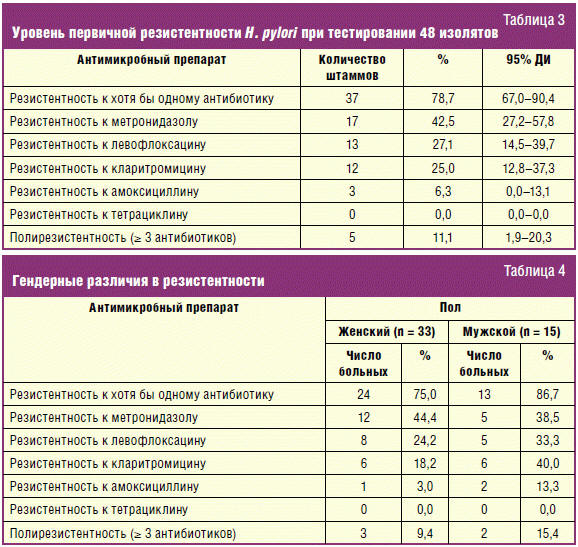
Двойная резистентность к кларитромицину и метронидазолу обнаружена у 2 (4,4%)
изолятов, метронидазолу и левофлоксацину — у 4 (8,3%) микроорганизмов. Все
штаммы, резистентные к амоксициллину, были устойчивы к кларитромицину.
Частота встречаемости резистентных штаммов отличалась среди мужчин и женщин,
однако данный факт сложно интерпретировать из-за малой выборки (табл. 4).
При анализе частоты резистентности к кларитромицину выявлены различия по
нозологиям. Так, у 14 пациентов, страдающих язвенной болезнью, было 5 (35,7%)
случаев выделения штаммов H. pylori, резистентных к кларитромицину. В
то же время у 34 больных, у которых был диагностирован только хронический
гастрит, частота выделения резистентных штаммов к кларитромицину была ниже — 7
(20,6%). Однако этот факт сложно интерпретировать из-за ограниченного числа
наблюдений.
Обсуждение
Согласно Маастрихтским рекомендациям IV пересмотра, уровень резистентности
H. pylori к кларитромицину в популяции является определяющим фактором при
выборе схемы эрадикации [10]. Подобно другим патогенам, хеликобактер имеет
региональные особенности резистентности. Резистентность напрямую коррелирует с
частотой назначения антимикробных препаратов и утвержденными протоколами выбора
антибиотиков [11]. Невозможно экстраполировать данные о резистентности,
выявленные в одной стране, на другую, в силу значительных региональных различий
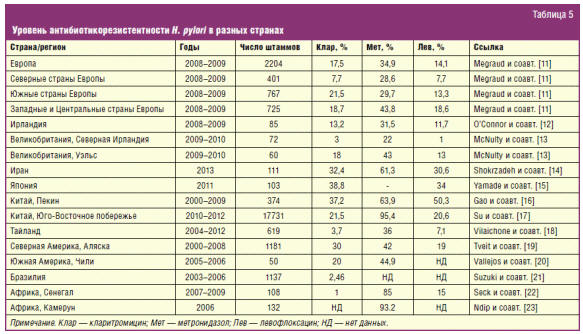
чувствительности микроорганизмов. Так, резистентность к кларитромицину в
Нидерландах составляет всего 5,6%, тогда как резистентность H. pylori к
данному антибиотику в Австрии достигает 35,4% [11]. Уровень устойчивости к
метронидазолу в Пекине составил 63,9%, а на Юго-Восточном побережье Китая —
95,4% [16, 17]. Для анализа антибиотикорезистентности H. pylori в мире
нами были отобраны наиболее масштабные исследования, проводимые с 2000 по 2013
год. Проанализировано 13 исследований, из которых 3 европейских, 5 азиатских, 2
африканских и 3 американских. Более подробно уровень резистентности к
антибиотикам H. pylori в различных странах приведен в табл. 5.
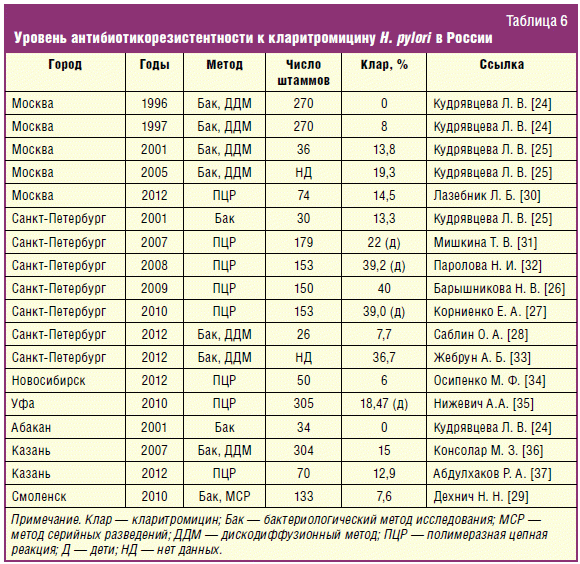
При анализе результатов исследований по антибиотикорезистентности H.
pylori на территории России обращает на себя внимание рост уровня
резистентности H. pylori к кларитромицину. Так, в 1996 г. в г. Москве
не было выявлено резистентных штаммов к кларитромицину. Уже в 1999 г. уровень
резистентности H. pylori к кларитромицину составил 17,1%, в 2000 г.
16,6%, в 2001 г. 13,8%, а в 2005 г. уже 19,3% [24, 25]. При интерпретации
показателей резистентности важно учитывать методику определения
чувствительности. Так, при использовании только генотипического метода
полимеразной цепной реакции (ПЦР) возможны сложности в интерпретации
результатов. Примером могут служить данные, полученные в Санкт-Петербурге —
39–40% резистентных штаммов по данным ПЦР [26, 27]. В то же время резистентность
к кларитромицину при оценке дискодиффузионным методом, который тоже имеет
определенные ограничения, составила всего 7,7% [28].
Наибольшую информативность представляют данные о резистентности, полученные
методом серийных разведений. На основании тестирования 133 штаммов методом
серийных разведений сделан вывод о низкой резистентности в Смоленске в 2010 г.
[29]. В нашем исследовании, при использовании сходной технологии тестирования,
резистентность составила 25%, что еще раз иллюстрирует межрегиональные различия
чувствительности микроорганизмов.
Фенотипический метод определения чувствительности к антибиотикам рекомендован
Институтом по клиническим и лабораторным стандартам (CLSI), EUCAST, а также
Маастрихтским соглашением IV пересмотра в качестве основного метода определения
чувствительности H. pylori к кларитромицину [38]. Культуральный метод
является высокоспецифичным тестом, однако характеризуется низкой
чувствительностью [39]. Определение чувствительности H. pylori к
антибиотикам в нашей стране сопряжено с рядом трудностей. Успех
бактериологического выделения H. pylori во многом связан с
правильностью отбора биопсийных образцов и соблюдением условий транспортировки
материала в лабораторию. Хеликобактер является труднокультивируемым
микроорганизмом, что требует не только навыков работы с его чистой культурой, но
и четкого соблюдения методики разведения рабочих концентраций исследуемых
антибактериальных препаратов. Учитывая объективные сложности, описанные выше,
становится понятным отсутствие широко представленных данных об истинном
состоянии антибиотикорезистентности в различных регионах нашей страны.
Большинство исследователей в своих суждениях об антибиотикорезистентности H.
pylori опираются на метод ПЦР как единственную доступную альтернативу
бактериологическому методу, который позволяет определить генетические мутации
H. pylori и прогнозировать фенотипическую резистентность [7].
Данное исследование ограничено относительно небольшим числом наблюдений — 48
чистых культур микроорганизма. Безусловно, для разработки региональных
протоколов ведения пациентов требуется дальнейшее изучение состояния
антибиотикорезистентности H. pylori. Однако в ходе исследования выявлен
высокий уровень первичной резистентности к кларитромицину — 25%. При таком
уровне резистентности эффективность стандартной тройной терапии не превышает 70%
[40]. Кроме того, левофлоксацин при выявленной 27,1% резистентности не может
быть рекомендован в нашем регионе как альтернатива кларитромицину. Широко
применяемая еще несколько лет назад «последовательная» терапия,
позиционированная Маастрихтским соглашением IV пересмотра для регионов с высокой
резистентностью к кларитромицину в качестве терапии первой линии, в настоящее
время потеряла актуальность в связи с накопленным негативным опытом [41].
Дополнительным аргументом против «последовательной» терапии служит выявленный
нами высокий (42,5%) уровень резистентности к метронидазолу, существенно
снижающий эффективность данной схемы [6].
Анализ литературных данных позволяет констатировать кризисные явления в
поиске эффективных схем эрадикации. Большинство стратегий направлены на
увеличение количества одновременно назначаемых препаратов. Ярким примером может
служить набирающая популярность «гибридная» и «одновременная» схемы эрадикации
H. pylori [42]. Отсутствие реальных эффективных и безопасных
альтернатив «классической» тройной терапии, полученные данные о резистентности
H. pylori в Санкт-Петербурге диктуют необходимость использовать все
возможности для повышения эффективности стандартного подхода: двойные дозы
ингибиторов протонного насоса, увеличение длительности с 7 до 10–14 дней,
добавление препаратов висмута и пробиотиков [2, 43].
Такая стратегия была использована нами для лечения пациентов, гастробиоптаты
которых использовались в данном исследовании. Применение стандартной тройной
терапии с двойной дозой ингибиторов протонного насоса, усиленной препаратом
висмута трикалия дицитрата, привело к уничтожению H. pylori у 93,2%
пациентов, несмотря на выявленную высокую резистентность к кларитромицину [44].
Выводы и рекомендации
На основании проведенного бактериологического исследования
антибиотикорезистентности штаммов H. pylori можно сделать следующие
выводы и рекомендации:
- Выявлен высокий уровень первичной резистентности к кларитромицину в
Санкт-Петербурге — 25%, что не позволяет рекомендовать использование
стандартной тройной терапии. - Проведенное исследование ограничивает возможности применения
левофлоксацина в качестве альтернативы кларитромицину, поскольку
резистентность к нему превышает 27%. - Высокий уровень резистентности к метронидазолу, превышающий 40% (42,5% в
данном исследовании), ставит под сомнение целесообразность использования
«последовательной» терапии в качестве терапии первой линии. - Бактериологический метод определения чувствительности H. pylori
является «золотым стандартом» определения чувствительности H. pylori
к кларитромицину. Для повышения чувствительности метода требуется четкое
соблюдение методики работы с биоматериалом.
Полученные данные о резистентности H. pylori в Санкт-Петербурге
делают актуальным использование всех возможностей для повышения эффективности
стандартного подхода: двойные дозы ингибиторов протонного насоса, увеличение
длительности с 7 до 10–14 дней, добавление препаратов висмута и пробиотиков,
поиск новых стратегий эрадикации.
Литература
-
Wald N. J. The treatment of Helicobacter pylori infection of the
stomach in relation to the possible prevention of gastric cancer. In: IARC
Helicobacter pylori Working Group. Helicobacter pylori Eradication as a
Strategy for Preventing Gastric Cancer. Lyon, France: International Agency for
Research on Cancer (IARC Working Group Reports, № 8); 2014, p. 174–180. http://www.iarc.fr/en/publications/pdfs-online/wrk/wrk8/index.php. -
Ивашкин В. Т., Лапина Т. Л., Шептулин А. А., Трухманов А. С. и
соавт. Практические шаги по профилактике рака желудка в Российской Федерации:
алгоритм ведения пациентов с хроническим геликобактерным гастритом (Материалы
и резолюция совета экспертов 9 декабря 2013 г.) // Рос. журн. гастроэнт.,
гепатол., колопроктол. 2014; 24 (2): 102–104. -
Lambert T., Megraud F., Gerbaud G., Courvalin P. Susceptibility
of Campylobacter pyloridis to 20 antimicrobial agents // Antimicrob. Agents
Chemother. 1986. 30: 510–511. -
McNulty C. A., Dent J., Wise R. Susceptibility of clinical
isolates of Campylobacter pyloridis to 11 antimicrobial agents // Antimicrob.
Agents Chemother. 1985. 28: 837–838. -
Дехнич Н. Н., Захарова Н. В., Кузьмин-Крутецкий М. И. и др.
Резолюция экспертного совещания «Тактика ведения пациента с инфекцией
Helicobacter pylori. От простого к сложному» // Клин. микробиол. и
антимикробная хим. 2014. Т. 16. № 3. С. 176–180. -
Graham D. Y., Lee Y. C., Wu M. S. Rational Helicobacter pylori
therapy: evidence-based medicine rather than medicine-based evidence // Clin
Gastroenterol Hepatol. 2014; 12: 177–186. -
Lee J. W. GenoType HelicoDR test in the determination of
antimicrobial resistance of Helicobacter pylori in Korea // Scand J
Gastroenterol. 2014, Jun 24: 1–10. -
Жебрун А. Б., Сварваль А. В., Ферман Р. С., Гончарова Л. Б.
Методы лабораторной диагностики инфекции, обусловленной Helicobacter pylori.
СПб, 2014. 60 с. - EUCAST. Breakpoint tables for interpretation of MICs and zone diameters.
2013; Version 3.1. Available from: URL: http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Consultation/EUCAST_clinical_breakpoints_for_Helicobacter_pylori.pdf.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru






