Введение
Остеоартритом (ОА) страдают 7% населения мира, треть из которых — люди старше 65 лет, что составляет около 500 млн человек; с 1990 по 2019 г. этот показатель вырос на 48% [1, 2]. В 2021 г. общая заболеваемость ОА в Российской Федерации (РФ) выросла на 2% и составила 3287,4 случая на 100 тыс. населения (3 806 414 человек), с наиболее высокой общей заболеваемостью в Южном (5947,1 на 100 тыс. населения) и Северо-Западном (4374,8 на 100 тыс. населения) федеральных округах [3]. Необходимость в проведении тотального эндопротезирования коленного сустава (ТЭКС) увеличивается во всем мире, в том числе в РФ, и декомпенсированная форма (сумма баллов по скрининг-системе — 25–39) ОА КС [4] — основное показание к его выполнению [5].
При ОА поражаются все ткани сустава, включая суставной хрящ (СХ), субхондральную кортикальную и трабекулярную кость с аномальным ремоделированием, синовиальную оболочку, воспаление которой приводит к отеку, синовиту и боли [6]. Ангиогенез и воспаление синовиальной мембраны являются тесно связанными процессами в патогенезе ОА [7, 8].
Процесс ремоделирования субхондральной кости (СК) в суставах при ОА является реакцией адаптации к прогрессирующему разрушению СХ, первоначально возникающей для поддержания гомеостаза суставных тканей. Понимание механизма ремоделирования СК при ОА способствует прогрессу в разработке перспективных методов лечения ОА на его ранней стадии [9], а также выбору лекарственных средств со структурно модифицирующим эффектом с целью их применения в периоперационном периоде после ТЭКС и улучшения исходов операции [10].
Ангиогенез в синовиальной мембране — результат дисбаланса между проангиогенными (фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов (bFGF), фактор роста нервов (NGF), ангиопоэтин (Ang-1), матриксная металлопротеиназа (ММП) 2) [11–14] и антиангиогенными факторами (ингибитор роста эндотелия сосудов (VEGI), тромбоспондин (TSP-1 и -2)) [15], и интерлейкин (ИЛ) 1β вызывает этот дисбаланс.
Хондроитина сульфат (ХС) — основной компонент внеклеточного матрикса СХ, участвует в поддержании его эластичности и устойчивости к нагрузке и является одной из наиболее часто используемых молекул для базисной терапии ОА. В клинических исследованиях и метаанализах продемонстрированы терапевтические преимущества ХС в отношении уменьшения боли, улучшения функциональной активности в суставах и снижения потребления нестероидных противовоспалительных препаратов (НПВП) или ацетаминофена пациентами с ОА [16–18]. Для этого препарата описано несколько механизмов действия [19, 20], при этом вопрос о точном механизме действия ХС остается открытым [21]. Оценка возможного влияния ХС на ангиогенные процессы в синовиальной оболочке при ОА и связанный процесс ремоделирования СК должна привести к лучшему пониманию механизмов его действия и фармакологических эффектов [22, 23]. Оценка эффектов ХС в отношении неоангиогенеза и связанного ремоделирования СК у пациентов с декомпенсированной формой ОА и показаниями к ТЭ имеет большое значение, так как интенсификация этих патологических процессов связана со снижением эффективности ТЭ, обусловленным неконтролируемой болью после операции, воспалением, остеолизом с асептической нестабильностью протеза, оссификацией, инфицированием, артрофиброзом, с прогрессированием ОА в контралатеральном суставе в связи с нагрузкой на него в раннем послеоперационном периоде и в периоде реабилитации [24].
Цель исследования: изучение влияния ХС в парентеральной форме (Хондрогард®) на процессы неоангиогенеза и ремоделирования СК у пациентов с декомпенсированной формой ОА КС при проведении ТЭКС.
Содержание статьи
Материал и методы
Настоящее исследование является частью открытого проспективного контролируемого рандомизированного исследования, выполненного в ООО «МЦ «Новомедицина» (Ростов-на-Дону, протокол № 1/02 от 01.02.2022), ФГБОУ ВО БГМУ Минздрава России, ООО «Башкирский НИИ травматологии и ортопедии» (Уфа, протокол № 3 от 01.02.2022) с учетом критериев включения и невключения пациентов (n=67, из них 43 женщины, в возрасте от 41 года до 73 лет) с рентгенологическими признаками ОА III стадии по Kellgren — Lawrence оперируемого сустава и ОА II стадии контралатерального сустава [25]. Дизайн и протокол исследования представлены в наших предыдущих публикациях [23, 26]. Все пациенты получали НПВП (целекоксиб, диклофенак, мелоксикам) в стандартной суточной дозе при включении в исследование и в дальнейшем были разделены на контрольную группу (КГ; n=35) и основную группу (ОГ; n=32), в которой в дополнение к НПВП пациенты получали парентеральную форму ХС (Хондрогард®, ЗАО «ФармФирма «Сотекс», Россия): первые 3 дня внутримышечно в дозе 100 мг/сут; 4–25 инъекций в последующие дни в дозе 200 мг/сут каждые 48 ч продолжительностью 50 дней за 2 мес. до проведения ТЭКС.
Методика операции ТЭКС [27], методы и временные точки исследования уровней биомаркеров в крови (ультрачувствительный С-реактивный белок (СРБ), фактор некроза опухоли α (ФНО-α), ИЛ-6, лептин, остеокальцин, ММП-3 и ММП-13, склеростин), морфологический анализ биообразцов СК, СХ бедренной и большеберцовой костей, суставной капсулы c детальным описанием интенсивности неоангиогенеза в тканях, оценка выраженности синовита [28, 29] и тяжести ОА по Шкале полуколичественной гистохимической оценки состояния хряща по H. Mankin (1971) в модификации V.B. Kraus et al. [30, 31] и Шкале оценки гистопатологии хряща OARSI (2006) [32] также представлены в наших более ранних этапных публикациях [23, 26].
Забор синовиальной жидкости (СЖ) проводили в стерильную пробирку на визите 0 во время пункции сустава и хирургического вмешательства для исследования концентрации ИЛ-1β, ФНО-α и ИЛ-6 методом ИФА (набор реагентов ЗАО «Вектор-Бест», Новосибирск, Россия).
Выполнена оценка синовиальной оболочки по степени выраженности изменений макроскопических параметров (степени 0; 0,5; 1) [28, 32].
Методы статистической обработки полученных данных подробно описаны нами ранее [26].
Результаты исследования
Клинико-анамнестическая характеристика пациентов с оценкой интенсивности боли по ВАШ, KOOS, индексу WOMAC, функциональной недостаточности в суставах по индексу Лекена, шкале WOMAC, детальное описание гистоархитектоники гиалинового хряща бедренной и большеберцовой костей, полученного в момент выполнения ТЭКС, в КГ (значительные участки деструкции в поверхностной и глубокой зонах, деформированные остеоны в промежуточной зоне, участки с дистрофическими изменениями на границе с костью и в глубокой зоне хряща) и ОГ (признаки адаптивной перестройки с регенератами и колонкообразными структурами с активным синтезом гликозаминогликанов) представлены в работах [23, 26].
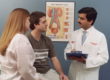
Исследование гиалинового хряща дополнительно выявило у пациентов с ОА в КГ значительное количество капиллярных петель в хрящевой ткани со стороны СК (рис. 1).
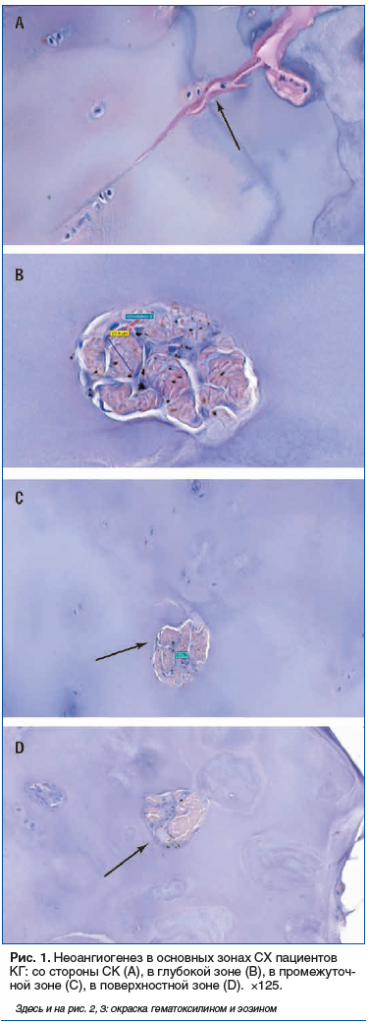
Дополнительная оценка морфологии СХ бедренной и большеберцовой костей пациентов ОГ выявила вместе с признаками его адаптивной перестройки отсутствие признаков неоангиогенеза (рис. 2).
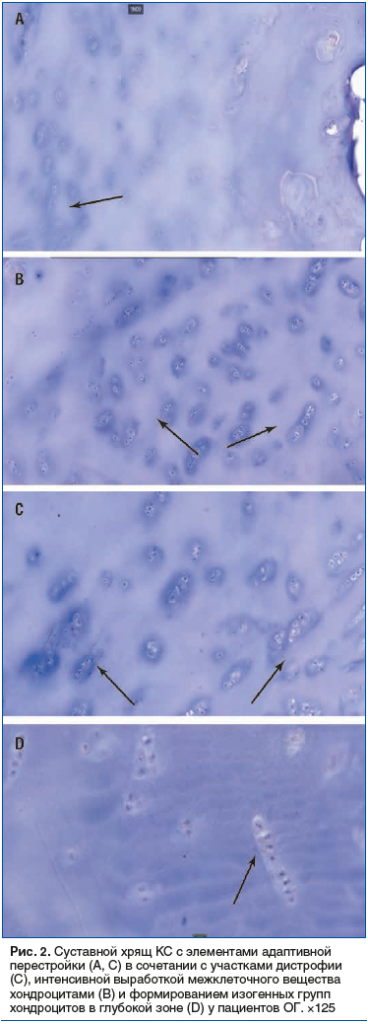
Макроскопическая оценка синовиальной оболочки у пациентов КГ показала воспаление 1-й степени с выраженной гиперваскуляризацией и пролиферацией гипертрофированных и гиперемированных ворсин (рис. 3) с высокоуровневым синовитом (7 баллов) по шкале GSS [23, 26].
Макроскопическая оценка синовиальной оболочки у пациентов ОГ показала наличие реактивной синовиальной оболочки (степень 0,5), ворсинки имели нормальную морфологию или были несколько утолщены, сосудистая сеть не видна из-за потери прозрачности (см. рис. 3) с низкоуровневым синовитом по шкале GSS (3 балла) [23, 26].
Следовательно, прием курса препарата Хондрогард® до выполнения ТЭКС сопровождался ограничением процесса неоангиогенеза в синовиальной мембране, что способствовало уменьшению выраженности синовита при ОА КС и, вероятно, ограничению патологического ремоделирования СК.
При сравнительном полуколичественном анализе морфологии СХ пациентов КГ выявлена выраженная структурно-функциональная трансформация СХ с существенным увеличением баллов по шкалам Mankin и ОARSI. Прием ХС в парентеральной форме за 2 мес. до ТЭКС сопровождался значимым снижением баллов по шкале Mankin — 9 [8; 10] против 11,5 [10;13] в КГ (р<0,0001, U-критерий Манна — Уитни), а также существенным снижением баллов по шкале OARSI — 2 [2; 3] против 3 [2; 4] в КГ (p=0,002, U-критерий Манна — Уитни).
На предшествующем этапе исследования мы обнаружили статистически значимое снижение уровня всех лабораторных показателей крови, за исключением существенного увеличения концентрации остеокальцина, на визитах 1 и 2 у пациентов, принимавших Хондрогард® до ТЭКС, при сравнении с динамикой данных параметров в КГ у пациентов, принимавших НПВП до ТЭКС [26], что свидетельствовало о противовоспалительных и структурно-модифицирующих эффектах ХС, связанных с влиянием ХС на неоангиогенез и ремоделирование СК.
По результатам исследований мы не наблюдали значимых различий концентрации ИЛ-1β и ФНО-α в СЖ у пациентов КГ и ОГ (см. таблицу). ИЛ-6 в большой концентрации выявлялся в СЖ пациентов КГ, при выраженном снижении его содержания в СЖ пациентов ОГ (см. таблицу).
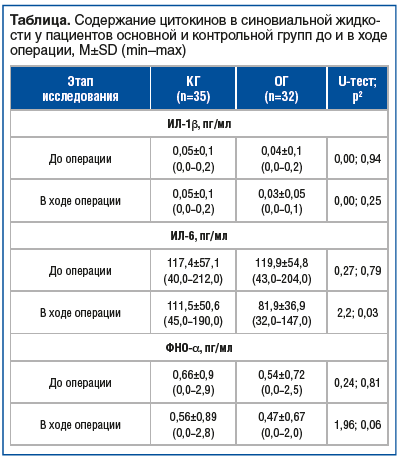
Таким образом, данные клинических, морфологических и лабораторных методов исследования СХ, синовиальной оболочки и биологических жидкостей у пациентов с ОА КС III рентгенологической стадии и функциональной недостаточностью суставов 2-й степени в КГ и ОГ до и после ТЭКС позволили сделать вывод о наличии противовоспалительного и структурно-модифицирующего эффектов ХС в парентеральной форме (Хондрогард®), связанных с механизмами его влияния на неоангиогенез в синовиальной мембране и со стороны СК.
Обсуждение
Выявленные закономерности в изменении параметров макроскопической оценки синовиальной оболочки, полуколичественной гистологической оценки и гистоархитектоники СХ и морфологической характеристики синовиальной мембраны, в изменении лабораторных биомаркеров воспаления и структурных изменений в СХ и синовиальной оболочке, в СЖ и крови у пациентов с ОА КС III рентгенологической стадии и функциональной недостаточностью суставов 2-й степени в КГ и ОГ до и в ходе операции, после проведения ТЭКС подтвердили тот факт, что неконтролируемый ангиогенез является критическим событием синовиального воспаления и ремоделирования СК при ОА [33].
Существенное уменьшение концентрации ИЛ-6 в СЖ и крови в ходе операции у пациентов с ОА КС, получавших ХС перед проведением ТЭКС, и дальнейшее снижение его уровня в крови при выписке пациента из стационара и через 3 мес. после операции обусловливают уменьшение интенсивности боли и воспаления при отсутствии экспрессии ИЛ-1β и ФНО-α в СЖ, значимом снижении уровня ФНО-α и СРБ в крови пациентов ОГ, что соответствует результатам зарубежных исследований [34, 35].
Значимое снижение концентрации ИЛ-6 в крови при выписке пациента из стационара и через 3 мес. после операции и ИЛ-6 в СЖ во время операции у пациентов с ОА КС, получавших ХС перед проведением ТЭКС, в совокупности с данными об ограничении ангиогенеза в синовиальной мембране и СК в ОГ, вероятно, свидетельствуют об одновременном снижении экспрессии доминантного проангиогенного фактора VEGF, связанного с синовиальным ангиогенезом [36]. Одновременно с уровнем VEGF, возможно, уменьшается продукция в крови, синовиальной мембране и СК проангиогенных факторов и факторов роста нервных волокон — bFGF [37], NGF [38], Ang-1 [39] — и увеличивается экспрессия в таргетных суставных тканях антиангиогенных факторов — TSP-1 [40], TSP-2 [41] и VEGI [42], что отражает смещение баланса антиангиогенных факторов, ограничивающих неоваскуляризацию и иннервацию при приеме ХС (Хондрогард®).
Увеличение уровня склеростина приводит к замедлению костного обмена при ОА, что доказано в исследовании [43]. Курс терапии ХС до проведения операции ТЭКС приводил к существенному уменьшению концентрации склеростина в крови пациентов. Следовательно, прием Хондрогарда до проведения ТЭКС ограничивает тормозящее влияние склеростина на Wnt/β-катенин-сигнальную систему, способствует усилению пролиферации и дифференцировки остеобластов с устранением остео-кластогенеза, ремоделирования СК с активным неоангиогенезом [44].
Снижение уровня склеростина в крови при приеме ХС до проведения ТЭКС связано со стабилизацией в крови уровня остеокальцина, являющегося маркером костного ремоделирования, и интенсификацией образования остеобластов в контралатеральном суставе, уменьшением дестабилизации хрящевой ткани со стороны СК, достаточной минерализацией костного матрикса и ограничением неоангиогенеза через ангиостатический фактор хемокиновый лиганд 9 (Cxcl9) [45, 46].
Курс терапии Хондрогардом у пациентов с ОА КС до проведения ТЭКС сопровождался существенным снижением концентрации факторов воспаления и катаболических факторов в СХ (лептина, ММП-3) с уменьшением интенсивности разрушения СХ в контралатеральном суставе и увеличением остеобластогенеза со снижением выраженности неоангиогенеза, что подтверждается данными других исследований [47, 48]. Одновременно мы отметили значимое снижение уровня ММП-13 в крови, которое сопровождается уменьшением распада коллагена II типа и аггрекана в СХ контралатерального сустава, а также замедлением процессов патологического ремоделирования СК обоих КС [49, 50]. Снижение уровня ММП-13 и провоспалительных цитокинов ФНО-α и ИЛ-6 в крови лежит в основе ограничения неоангиогенеза, деградации экстрацеллюлярного матрикса в СХ, воспаления в синовиальной оболочке и ремоделирования в СК [51].
Следовательно, новые данные, полученные в ходе исследования, позволяют рекомендовать применение препарата Хондрогард® в эффективном режиме, согласно медицинской инструкции, за 2 мес. до выполнения операции ТЭКС с целью ограничения неоангиогенеза и патологического ремоделирования СК в контралатеральной нижней конечности при увеличении нагрузки на нее в послеоперационном периоде, а также в оперированном суставе с целью предупреждения осложнений в послеоперационном периоде.
Заключение
Таким образом, данные нашего исследования свидетельствуют о том, что благоприятный эффект ХС в парентеральной форме (Хондрогард®) в отношении клинических, морфологических и лабораторных маркеров прогрессирования ОА может быть обусловлен его антиангиогенными свойствами и является новым направлением таргетирования ОА. Ограничение исследования в реальной клинической практике связано с недостаточным объемом полученных данных, что требует проведения дальнейших исследований, посвященных детализации механизма развития антиангиогенного эффекта препарата Хондрогард® при ОА с учетом такого инструмента, как «анализ ценности данных».
Конфликт интересов
Статья опубликована при поддержке компании ЗАО «ФармФирма «Сотекс». В статье выражена позиция авторов, которая может отличаться от позиции компании ЗАО «ФармФирма «Сотекс». Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами.
Информация с rmj.ru