Введение
Остеоартрит (ОА) является наиболее распространенным заболеванием суставов во всем мире с растущим глобальным бременем инвалидности и обращаемости за медицинской помощью. Число людей с ОА во всем мире за период с 2010 по 2019 г. выросло на 28%, затронув более 500 млн человек, или около 6%, по всему миру. В ближайшие годы из-за старения населения, увеличения числа людей с ожирением и травмами суставов, в том числе связанными со спортом, это заболевание станет еще более распространенным. В 2019 г. ОА был 15-й по значимости причиной лет, прожитых с инвалидностью. ОА считается тяжелым заболеванием с высокой коморбидностью и снижением качества жизни вследствие боли, скованности и связанных с этим ограничений движений. Оптимальное лечение ОА тазобедренных и коленных суставов имеет важные последствия для пациента и общества в целом [1].
Такие организации, как Международное общество исследований остеоартрита (OARSI) [2], Американский колледж ревматологии (ACR) [3], Американская академия хирургов-ортопедов (AAOS) [4], Европейский альянс ассоциаций ревматологов (EULAR) [5] и Европейское общество клинических и экономических аспектов остеопороза и остеоартрита (ESCEO) [6], за последние 5 лет опубликовали обновленные рекомендации, отражающие меняющиеся данные о методах лечения, а также особое место гиалуроновой кислоты (ГК) в терапии данного заболевания. ГК, являясь неотъемлемой частью синовиальной жидкости, используется для внутрисуставных инъекций в лечении ОА. OARSI рекомендует использовать внутрисуставное введение ГК лицам с ОА коленных суставов, в том числе пациентам с сопутствующей патологией [2]. В рекомендациях подчеркнуто, что внутрисуставное введение ГК является безопасным и может оказывать благотворное воздействие на боль в долгосрочной (около 12 нед.) перспективе.
Содержание статьи
Место ГК в терапии ОА
Одной из основных проблем в лечении ОА является замедление или, скорее, обращение процесса вспять, однако в настоящее время достигнуть этих целей в полной мере не удается. Несмотря на возможность частичного замедления воспалительного процесса, полная регенерация хряща по-прежнему остается недостижимой целью. Консервативные методы лечения, такие как нестероидные противовоспалительные препараты (НПВП), болезньмодифицирующие препараты замедленного действия, нутрицевтики, физиотерапия, обучение пациентов правильному образу жизни и снижение массы тела, могут облегчить симптомы и улучшить функцию суставов, но не могут остановить прогрессирование заболевания [7].
В последние годы применение ГК при лечении ОА различной локализации набирает популярность [8]. ГК — это гликоз-аминогликан, который в изобилии присутствует в синовиальной жидкости, хряще и других соединительных тканях [9]. Она эндогенно вырабатывается организмом человека и обладает уникальными физико-химическими и биологическими свойствами, проявляя биосовместимость и способность к биологическому разложению [10].
Более того, в ряде исследований сообщалось о противовоспалительном потенциале ГК и ее специфическом действии в замедлении процесса дегенерации суставного хряща. Так, систематический обзор, проведенный R. Altman et al. [11], был сосредоточен на общих противовоспалительных эффектах ГК при ОА, опосредованных связыванием с рецепторами с кластерной детерминантой 44 (CD44), toll-подобными рецепторами 2 и 4, молекулой межклеточной адгезии 1 (ICAM-1) и рецепторами клеточной поверхности лайилина (LAYN). В обзоре отмечено, что ГК с более высокой молекулярной массой обладает противовоспалительным эффектом, в то время как короткие олигосахариды ГК вызывают воспалительные реакции.
Гиалуроновая кислота продемонстрировала свое участие в ослаблении фагоцитоза, а также в снижении уровней простагландинов, фибронектина и цАМФ. Также существует гипотеза, что ГК может предотвращать высвобождение арахидоновой кислоты, блокировать ноцицепторы и уменьшать образование брадикинина [12]. ГК способствует регенерации мениска человека путем ингибирования апоптоза, стимулирования миграции клеток и ускорения клеточной пролиферации, потенциально через путь PI3K/MAPK, опосредованный рецептором CD44 [13]. Связывание ГК с ее основным рецептором, CD44, активирует пути фосфоинозитид-3-киназы (PI3K) и митогенактивируемой протеинкиназы (MAPK), вызывая пролиферацию и дифференцировку клеток хряща [13].
Представляет большой интерес недавно проведенное многоцентровое рандомизированное контролируемое исследование, в котором рассматриваются различные изменения биомаркера С-концевых телопептидов коллагена II типа (CTX-II) после внутрисуставного введения высокомолекулярной ГК и пероральных НПВП у пациентов, страдающих ОА коленных суставов [14]. Результаты этого исследования показали, что оба метода лечения улучшают симптомы у пациентов с ОА коленных суставов, но за счет различных механизмов действия: в то время как внутрисуставная ГК стимулирует обмен коллагена II типа во внеклеточном матриксе на границе между хрящом и костью, НПВП, по-видимому, снижают такой обмен. Это многоцентровое рандомизированное контролируемое исследование может стать отправной точкой для объяснения роли ГК в замедлении процесса дегенерации суставного хряща.
В многочисленных исследованиях отмечены безопасность и эффективность ГК [15]. В систематическом обзоре C. Chavda et al. [16] было продемонстрировано, что инъекции ГК безопасны и эффективны, а наиболее распространенными побочными эффектами являются местная боль и отек, которые обычно появляются через несколько часов после инъекции ГК и имеют тенденцию самопроизвольно проходить в течение нескольких дней без серьезных последствий. Тяжелые аллергические реакции возникают крайне редко, и их вероятность возрастает при сочетании использования ГК с другими методами лечения ОА коленных суставов. По этой причине следует всегда контролировать комбинацию препаратов.
При ОА концентрация и молекулярная масса ГК в синовиальной жидкости снижаются, что ухудшает ее смазывающую и противовоспалительную функции [17]. Инъекция ГК направлена на восстановление концентрации гликозаминогликанов и реологических свойств синовиальной жидкости, что может уменьшить боль, улучшить функцию сустава и замедлить прогрессирование заболевания [18]. Было показано, что в дополнение к своим физическим свойствам ГК обладает хондропротективным действием, модулируя различные клеточные и молекулярные сигнальные пути [19]. Действительно, она может стимулировать пролиферацию, дифференцировку и синтез внеклеточного матрикса, который необходим для поддержания целостности хряща и ингибирования апоптоза хондроцитов, который повышен при OA и обусловливает деградацию хряща [20]. Более того, она способна усиливать экспрессию коллагена II типа и аггрекана, основных компонентов внеклеточного матрикса хряща, и, с другой стороны, понижать экспрессию матриксных металлопротеиназ [20]. Несколько исследований in vitro и in vivo продемонстрировали хондропротективные эффекты ГК при ОА, хотя точные механизмы действия до конца не изучены [19].
Основываясь на вышеупомянутых свойствах ГК, ее введение можно рассматривать как перспективную терапию ОА. Пораженный ОА коленный сустав, безусловно, является наиболее изученным суставом с точки зрения эффективности всех методов лечения ОА, особенно при малоинвазивном лечении. Хотя в последние годы регенеративная медицина активно экспериментировала с новыми препаратами, такими как PRP и мезенхимальные клетки, с очень многообещающими результатами, ГК остается надежной и научно обоснованной инъекционной терапией OA крупных суставов [21, 22].
Хирургическое лечение ОА
Хирургическое лечение суставов, измененных вследствие прогрессирующего ОА, в первую очередь показано пациентам с постоянной болью и функциональными ограничениями, тяжелым поражением сустава, подтвержденным рентгенологически, а также тем, у кого предшествующий длительный мультимодальный консервативный подход больше не обеспечивает адекватного облегчения симптомов [23].
Хирургическое вмешательство при ОА, по сути, преследует основную цель — восстановить неизлечимо поврежденный сустав. Тотальное эндопротезирование (ТЭ) сустава (ТЭС) представляет собой единственный успешно зарекомендовавший себя хирургический вариант лечения при терминальной стадии ОА. ТЭ тазобедренных и коленных суставов — одна из наиболее успешных процедур в медицине [24], которая обеспечивает значительное облегчение боли, функциональное восстановление и улучшение качества жизни.
В настоящее время ТЭ — наиболее распространенный метод, используемый при ОА тазобедренного сустава, поскольку обычно поражаются как вертлужная впадина, так и головка бедренной кости. Эндопротез для ТЭ включает в себя оболочечный вертлужный компонент, который имеет полиэтиленовую или керамическую вставку (вкладыш), и шарик из керамики или металлического сплава в качестве головки бедренной кости, надеваемый на металлическую ножку, которая вводится в проксимальный отдел бедренной кости. Выбор и сочетание материалов опорной поверхности, фиксация и размер головки зависят от возраста пациента, предполагаемого уровня активности и качества кости. Эти хирургические решения напрямую влияют на продолжительность жизни эндопротеза, что особенно актуально для молодых пациентов [25]. Более старший возраст и выраженный болевой синдром предсказывают неблагоприятный исход после ТЭС, а сопутствующие заболевания опорно-двигательного аппарата, такие как боли в пояснице и ОА неоперированного тазобедренного сустава, могут стать причиной менее долгосрочного функционального улучшения, как показано в проспективном когортном исследовании [26].
Показанием к ТЭ коленных суставов считается наличие значительных патологических изменений во всех его отделах, выраженный болевой синдром, деформация, сгибательная и/или разгибательная контрактура, которые вызывают стойкое нарушение статико-динамической функции, а также неэффективность предшествующего консервативного лечения [27].
Осложнение ТЭС
Несмотря на преимущества ТЭС, у многих пациентов, перенесших одностороннюю операцию, наблюдается прогрессирование ОА контралатерального коленного сустава [28]. Это прогрессирование может произойти быстро: у тех, кому требуется контралатеральное ТЭС, время до повторной операции составляет всего 3,2 года. Даже среди пациентов с односторонними симптомами, предшествовавшими первичной процедуре, почти 25% подвергаются операции ТЭС на контралатеральной конечности в течение нескольких лет [29].
Возможно, определенную роль в прогрессировании ОА контралатерального сустава играет измененная механика походки после одностороннего ТЭС [30]. В частности, большая нагрузка на сустав, которая определяется более сильной нагрузкой при приведении колена, является известным фактором риска прогрессирования первичного ОА [31], а уменьшенная экскурсия сгибания колена — фактором риска проведения ТЭС в будущем [32]. Пациенты после односторонней операции ТЭС при выполнении функциональных задач и переносе веса, таких как ходьба [33] и вставание со стула [34], как правило, отдают предпочтение контралатеральной конечности, т. е. они прикладывают бóльшую силу к контралатеральной конечности, которая при этом испытывает на себе более высокую нагрузку.
Считается, что неоптимальная механическая нагрузка играет ключевую роль в структурных повреждениях и проявлении симптомов, связанных с ОА [35]. Выявление потенциально вредных последствий изменения биомеханики имеет ключевое значение для достижения наилучших результатов лечения [36]. Во время движения мышцы и связочный аппарат сустава влияют на хрящ и потенциально могут способствовать развитию ОА или влиять на характер его течения [37].
У некоторых пациентов с ОА механическая нагрузка на субхондральную кость увеличивается из-за таких факторов, как изменение оси конечности, истончение хряща и снижение способности субхондральной кости поглощать нагрузку [38, 39].
Так, по данным исследования, проведенного Е.В. Тицкой и соавт. [40], после ТЭ тазобедренных суставов 57,38% пациентов предъявляли жалобы на умеренные и выраженные боли в тазобедренном суставе контралатеральной конечности, 95,08% — на болевые ощущения в коленных и голеностопных суставах гомо- и контралатеральной конечностей. У 85,25% больных отмечено наличие гипотрофии мышц гомолатеральной конечности [40]. Использование кросс-линк препарата ГК в раннем послеоперационном периоде оказывает выраженный профилактический эффект, достоверно снижает уровень болевых ощущений в контралатеральном коленном суставе, обеспечивая, таким образом, благоприятное течение восстановительного лечения после проведенного ТЭ коленного сустава [41].
Клиническое наблюдение 1
Пациент В., 63 года, обратился с жалобами на боли в тазобедренных суставах, больше слева, стартового характера в течение около 10 лет. Периодически принимал НПВП по потребности, в течение последних 6 мес. стал отмечать стойкость болевого синдрома в левом тазобедренном суставе, что обусловило ежедневную потребность в приеме НПВП. Также стал отмечать ограничения движения в левом тазобедренном суставе (сложности при наклонах, ограничение ротации). Обратился за медицинской помощью.
При обследовании на рентгенограмме тазобедренных суставов был обнаружен ОА слева стадии III, справа стадии II по Kellgren — Lawrence (рис. 1A).
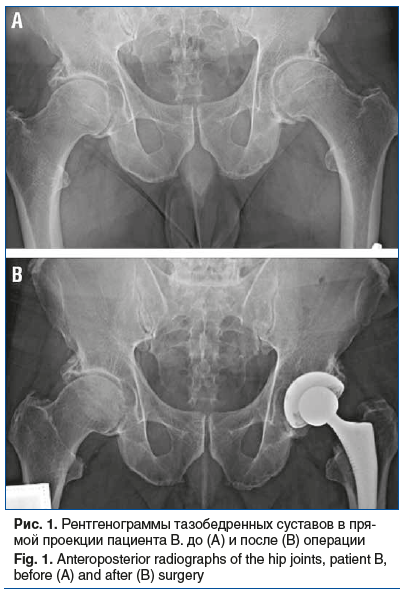
С учетом выраженного болевого синдрома, постоянной потребности в НПВП и их низкой эффективности была проведена имплантация специальных диспластических компонентов эндопротеза левого тазобедренного сустава с костной аутопластикой крыши и дна вертлужной впадины (рис. 1B). Послеоперационный период протекал без осложнений.
После выписки из стационара пациент отмечал значительное уменьшение болевого синдрома и отсутствие потребности в приеме НПВП. Через 2 мес. после операции стал отмечать боли стартового характера в правом тазобедренном суставе, усиление которых наблюдал в течение последних недель, боли в левом тазобедренном суставе не беспокоили. Обратился за медицинской помощью. При ультразвуковом исследовании (УЗИ) сустава были обнаружены явления синовита, состояние околосуставных мягких тканей без изменений.
Данное состояние расценено как прогрессирование ОА контралатерального тазобедренного сустава. Согласно данным ряда исследований, в которых было продемонстрировано быстрое прогрессирование ОА при наличии синовита [42, 43], и опираясь на собственный опыт применения ГК при лечении ОА тазобедренных суставов [44], пациенту было предложено внутрисуставное введение ГК.
В асептических условиях под контролем УЗИ из переднего доступа введена игла под углом 45° по отношению к датчику. После визуализации головки бедренной кости произведена эвакуация жидкости около 20 мл. После визуальной УЗ-ревизии сустава и подтверждения отсутствия жидкости в полости сустава к игле присоединен шприц, содержащий препарат Флексотрон® Кросс, который представляет собой так называемый бионический кросс-линк — сшитый гиалуронат натрия 2%, 20 мг/мл, 3 мл. Под контролем УЗИ препарат введен в полость сустава (рис. 2).
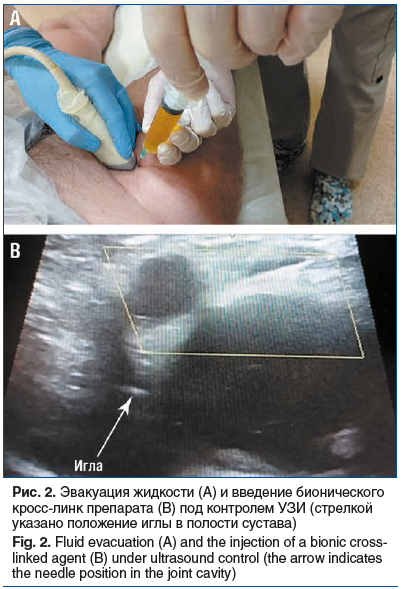
Через 1 нед. после манипуляции отмечалось значительное снижение боли, при активном наблюдении через 3 мес. пациент не предъявлял жалобы на боли в тазобедренных суставах. В настоящее время продолжает курс реабилитации.
Клиническое наблюдение 2
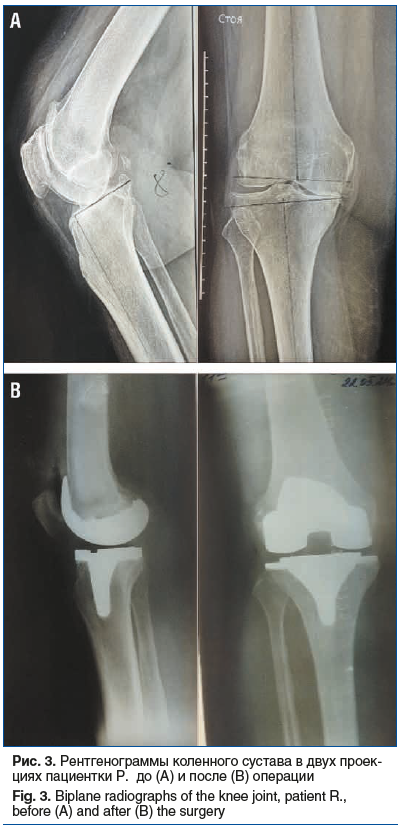
Пациентка Р., 62 года. Более 15 лет наблюдалась по поводу двустороннего гонартроза. В течение последнего года стала отмечать усиление боли в правом коленном суставе. Постоянно принимала НПВП, которые провоцировали повышение давления и частый пересмотр гипотензивной терапии. Обратилась за медицинской помощью. При осмотре отмечены болезненность при пальпации правого коленного сустава, выраженные ограничения движения, варусная деформация. Пальпация левого коленного сустава болезненная минимально, ограничений движений нет, выраженной деформации сустава нет. На рентгенограмме обнаружен ОА коленных суставов слева стадии II, справа стадии III по Kellgren — Lawrence.
Пациентке была проведена имплантация эндопротеза правого коленного сустава с одновременной реконструкцией биологической оси конечности (рис. 3). Послеоперационный период протекал без осложнений.
Через 2,5 мес. пациентка обратилась за медицинской помощью ввиду нарастания боли в левом коленном суставе: боль носила стартовый характер, а также появлялась после нагрузки и во второй половине дня. Боль в правом коленном суставе не беспокоила. При осмотре ось суставов не изменена, отмечается выраженная болезненность при пальпации в медиальных периартикулярных точках левого коленного сустава; отека и гиперемии суставов нет. При УЗИ обнаружены явления минимального синовита левого коленного сустава и умеренно выраженного лигаментита медиальной коллатеральной связки.
С учетом риска прогрессирования ОА и наличия осложнения в виде лигаментита пациентке была предложена комбинированная локальная терапия (внутрисуставная и периартикулярная). В асептических условиях в верхний внутренний заворот введена игла, аспирировано примерно 6 мл светло-желтой жидкости, после отсоединения шприца был присоединен шприц с препаратом Флексотрон®Кросс. В область прикрепления коллатеральной связки к медиальному мыщелку бедренной кости веерообразно под углом 45°, не извлекая иглу из области триггерной зоны, был введен препарат Плексатрон. Процедура периатрикулярного введения была проведена 3 раза с интервалом 3 дня.
Через 1 мес. наблюдения пациентка отмечала значительное снижение боли после нагрузки, пальпация левого коленного сустава безболезненная, при контрольном УЗИ явлений синовита и лигаментита нет. Продолжен курс реабилитации. Через 6 мес. при активном наблюдении пациентка не отмечает боли в суставах, НПВП не принимает.
Обсуждение
Терапия ОА направлена на снижение боли, сохранение функции сустава и профилактику прогрессирования. Если консервативное лечение недостаточно эффективно, с целью облегчения симптомов применяется ТЭС. Показанием к ТЭС является выраженный болевой синдром, потеря функции сустава. По данным исследований, одним из частых осложнений ТЭС является усиление боли в контралатеральной конечности. Это связано с изменением биомеханики движения в послеоперационном периоде, которое может проявляться как изолированным синовитом (клиническое наблюдение 1), так и синовитом в сочетании с лигаментитом (клиническое наблюдение 2). Как было показано ранее [42, 43], оба этих патологических состояния могут негативно влиять на прогрессирование ОА. Использование в данных клинических ситуациях препаратов ГК может способствовать снижению выраженности проявлений синовита [45] и снижать прогрессирование ОА [46, 47]. Выбор в пользу бионического кросс-линк препарата Флексотрон® Кросс для внутрисуставного введения был сделан ввиду особенностей его молекулы и сшивки. Препарат в суставе работает 23 дня как имплантат, а далее как биологически активный продукт, выполняя таким образом две важные для реконструктивной локальной инъекционной терапии задачи — вискозамещение и купирование воспалительного процесса. Этот класс препаратов предназначен для квалифицированных и опытных врачей, профессионально владеющих навыками проведения локальной инъекционной терапии.
С целью терапии лигаментита коленного сустава контралатеральной конечности как послеперационного осложнения был выбран Плексатрон — коллагенсодержащий имплантат для внутрисуставного и периартикулярного введения. Препарат при периартикулярном введении способствует замедлению процессов деградации хрящевой ткани суставных поверхностей и восстановлению повреждений, возникших в результате микротравматизации. Во втором клиническом наблюдении у пациентки при изменении биомеханики после проведенной операции причиной боли во второй половине дня и болезненности при пальпации послужил именно лигаментит коллатеральной связки, который был подтвержден данными УЗИ. Периартикулярное введение Плексатрона с целью купирования воспаления коллатеральной связки и ускорения регенерации ткани на практике продемонстрировало безопасность и эффективность этой терапии в долгосрочной перспективе. А введение внутрисуставно бионического кросс-линк препарата Флексотрон® Кросс является обоснованным в целях замедления прогрессирования ОА контралатеральной конечности.
Заключение
Остеоартрит является распространенным заболеванием, в лечении которого консервативные методы не всегда приводят к желаемому результату. Операция ТЭС, ввиду изменений нагрузки на контралатеральную конечность, может приводить к осложнениям, таким как боль. В большинстве случаев боль вызвана синовитом и/или лигаментитом. Оба этих процесса, согласно данным клинических исследований и метаанализов, являются не только проявлением ОА, но и фактором его прогрессирования. В таких случаях безопасным и эффективным методом лечения представляется введение препаратов ГК. Таким образом, реконструктивная локальная терапия препаратами ГК является хорошей возможностью отсрочить ТЭ сустава контралатеральной конечности.
СВЕДЕНИЯ ОБ АВТОРАХ:
Филатова Юлия Сергеевна — к.м.н., доцент кафедры терапии им. Е.Н. Дормидонтова Института непрерывного профессионального образования ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5; врач-ревматолог ООО «Медицинский центр диагностики и профилактики плюс»; 150040, Россия, г. Ярославль, пр-т Ленина, д. 33; ORCID iD 0000-0003-3024-9483.
Соловьев Игорь Николаевич — к.м.н., доцент кафедры травматологии и ортопедии ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5, врач травматолог-ортопед ООО «Медицинский центр диагностики и профилактики плюс»; 150040, Россия, г. Ярославль, пр-т Ленина, д. 33; ORCID iD 0000-0002-9347-1551.
Соловьев Егор Игоревич — студент 5-го курса лечебного факультета ФГБОУ ВО ЯГМУ Минздрава России; 150000, Россия, г. Ярославль, ул. Революционная, д. 5; ORCID iD 0009-0004-3138-0824.
Контактная информация: Филатова Юлия Сергеевна, e-mail: y.s.filatova@mail.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 21.02.2024.
Поступила после рецензирования 20.03.2024.
Принята в печать 12.04.2024.
ABOUT THE AUTHORS:
Yulia S. Filatova — C. Sc. (Med.), Associate Professor of the Department of Therapy named after E.N. Dormidontov, Institute of Continuing Professional Education, Yaroslavl State Medical University; 5, Revolyutsionnaya str., Yaroslavl, 150000, Russian Federation; rheumatologist, Medical Center for Diagnostics and Prevention Plus LLC; 33, Lenin av., Yaroslavl, 150040, Russian Federation; ORCID iD 0000-0003-3024-9483.
Igor N. Solovyov — C. Sc. (Med.), Associate Professor of the Department of Traumatology and Orthopedics, Yaroslavl State Medical University; 5, Revolyutsionnaya str., Yaroslavl, 150000, Russian Federation; orthopedic traumatologist, Medical Center for Diagnostics and Prevention Plus LLC; 33, Lenin av., Yaroslavl, 150040, Russian Federation; ORCID iD 0000-0002-9347-1551.
Egor I. Solovyov — 5th-year student of the Faculty of Medicine, Yaroslavl State Medical University; 5, Revolyutsionnaya str., Yaroslavl, 150000, Russian Federation; ORCID iD 0009-0004-3138-0824.
Contact information: Yulia S. Filatova, e-mail: y.s.filatova@mail.ru.
Financial Disclosure: the authors have no financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 21.02.2024.
Revised 20.03.2024.
Accepted 12.04.2024.
Информация с rmj.ru